氨基酮戊酸光动力疗法治疗宫颈低级别上皮内病变 及高危型HPV感染效果分析
2021-08-18左帆
左帆
(广东省第二人民医院 妇科,广东 广州 530000)
0 引言
宫颈癌发病率呈逐年上升和年轻化趋势,持续性高危型HPV感染(尤其是16/18型)是宫颈癌发病的重要因素[1]。虽然国内外指南对于宫颈低级别病变合并高危型HPV感染的建议均以随访为主,但长时间的随访可能加重患者经济和心理的双重负担,降低患者随访的依从性,为寻求一种既能达到满意的治疗效果,又能完全无创的新疗法,笔者于2016年11月至2018年10月采用5-氨基酮戊酸光动力疗法(ALAPDT)治疗病程>12月的低级别上皮内病变合并(或)高危型HPV感染患者53例,现报告如下。
1 资料和方法
1.1 一般资料
53例患者全部来源于本院妇科门诊,经HPV DNA试验确诊高危型HPV感染>12月,阴道镜+宫颈活检确诊排除为高级别上皮内病变(HISL)。其中未生育过或有生育要求者14例;锥切术后LISL合并HPV感染11例;子宫切除术后(包括宫颈癌术后2例)VIN1(或LISL)合并HPV感染7例;其他自愿加入ALA-PDT治疗者21例。入选前全部通过充分沟通并签署知情同意书。排除标准:(1)经阴道镜和宫颈组织活检诊断为高级别上皮内病变或宫颈癌者;(2)严重心、脑、肺、肝或肾脏疾病患者;(3)艾滋病、红斑狼疮、选择性IgA缺乏症、HIV感染、慢性淋巴细胞白血病、多发性骨髓瘤、淋巴瘤等免疫系统疾病或恶性肿瘤患者;(4) 12周内使用过皮质类固醇激素、免疫抑制剂、免疫调节剂或其他用药免疫系统的药物治疗者;(5) 12周内使用过系统或局部抗病毒治疗者;(6)细菌、滴虫、霉菌性阴道病未治愈者;(7)对氨酮戊酸过敏者;治疗组年龄为23~66岁,平均(40.3±10.05)岁。对照组共30例,全部为自愿要求随访,年龄为21~61岁,平均(40±10.25)岁。
1.2 方法
1.2.1 初筛
采用宫颈或阴道残端脱落细胞学(TCT)和高危型HPV DNA联合筛查,严格分层管理。
1.2.2 HPV DNA分型
采用经美国FDA批准的HR HPV杂交捕获试验(Hybrid Capture HPV DNA Assay)检测标本中HPV DNA 16、18、31、33、35、39、45、51、52、56、58、59、66、68型,其又分为2种高危型16、18型和其他12种高危型31、33、35、39、45、51、52、56、58、59、66、68型。(下文称为2种高危型和12种高危型),检测方法严格按试剂盒说明书。
1.2.3 阴道镜+活检
初筛结果符合以下情况者行阴道镜检查+活检:(1) 12种高危型HPV DNA感染>12月;(2) 2种高危型HPV感染; (3)细胞学筛查异常合并HPV DNA感染。满意的阴道镜活检结果提示病变不高于低级别上皮内病变即可纳入治疗组。不满意阴道镜者或高级别上皮内病变排除入组,以其他方法治疗。
1.2.4 治疗方法
治疗组:采用5-氨基酮戊酸(ALA,上海复旦张江生物医疗股份有限公司)光动力治疗,ALA常温保存,使用时1支ALA溶于0.5mL 0.9%氯化钠溶液,根据治疗面积使用3~5支ALA配液待用。将消毒好的薄棉片(宫颈治疗时需准备一条状棉片置入宫颈管)放入配置好的ALA溶液中浸泡后湿敷于宫颈或阴道残端。无菌手套塞阴道4h防止棉片脱落。4h后取出手套,清除宫颈及宫颈管内棉片,用特制激光光纤插入阴道。治疗仪为艾拉光动力治疗仪,激光波长为635nm红光,光纤分为宫颈端和阴道端,宫颈端治疗20min,功率80kW。阴道端治疗10min,功率20kW。在患者月经干净3~5d开始治疗(子宫切除术后即时治疗),治疗前先处理阴道炎症,分泌物多时生理盐水清洗即可。每周治疗一次,共3~6次。治疗期间禁性生活,忌烟酒辛辣饮食。治疗后每三个月复查TCT及HPV,共随访一年。对照组不做任何干预和治疗,随访时间同治疗组。
1.3 疗效和结果分析
治疗组全部疗程结束后开始进入随访期,对照组直接进入随访期。对两组患者在第3、6、9、12个月时分别脱落细胞学检查TCT和高危型HPV感染检测。两项结果均转阴为治愈,其中一项转阴为好转,两项均未转阴为无效。
1.4 统计学分析
采用c2检验和秩和检验分析。
2 结果
2.1 治疗结果
治疗组53例患者有2例未完成治疗,6例患者失访,失访率15%。有效病例45例。治愈37例,治愈率82.2%,好转5例,好转率11.1%,无效3例,无效率6.6%,具体结果分析见表1。

表1 ALA-PDT治疗LISL效果分析(例)
治疗组中细胞学异常共30例,其中LISL 29例,ASCUS 1例,转阴29例,无效1例;治愈率为96.6%。对照组中细胞学异常共20例,全部为LISL,随访一年自然转阴6例,转阴率为30%。提示ALA-PDT治疗LISL转阴率明显高于对照组(P<0.01),见表2。

表2 ALA-PDT治疗高危型HPV感染效果分析(例)
治疗组中16、18型HPV感染共15例,其中13例为混合感染,16、18型转阴率100%。12种高危型HPV感染共42例,转阴38例,4例无效,转阴率为90.4%。对照组中12高危型HPV感染共30例(16、18型感染者全部行阴道镜活检后纳入治疗组),自然转阴7例,转阴率23.3%,提示ALA-PDT治疗16、18型HPV感染效果满意,治疗12种高危型HPV感染转阴率明显高于对照组(P<0.01),见表3。
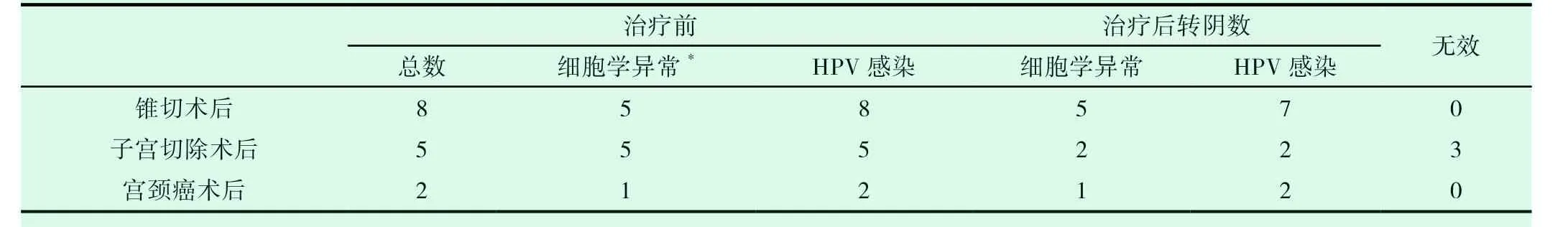
表3 ALA-PDT治疗术后LISL合并HPV感染效果分析(例)
治疗组中纳入术后复发或持续性感染患者(包括宫颈锥形切除术、全子宫切除术及宫颈癌根治术)共18例,3例患者失访,有效病例15例,其中锥切术后8例,5例细胞学异常全部转阴,8例HPV感染7例转阴,提示ALA-PDT对于锥切术后残留或复发性LISL及HPV感染患者治疗效果满意;但子宫切除术后5例患者有3例无效,提示ALA-PDT治疗子宫切除术后细胞学异常患者,特别是VIN患者效果不佳;宫颈癌根治术后患者2例,均达到满意效果,提示ALAPDT可作为宫颈癌根治术后HPV感染治疗的可选方案。
ALA-PDT治疗前后阴道镜活检病理结果对比见图1、图2:
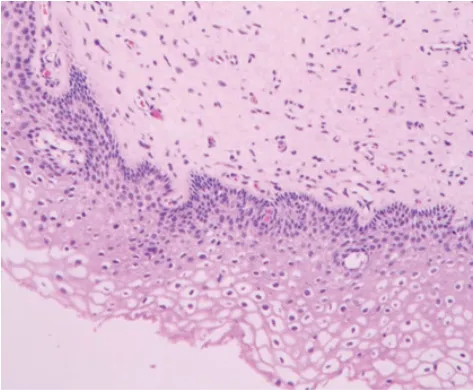
图1 治疗前LISL组织病理改变:鳞状上皮下1/3非典型改变
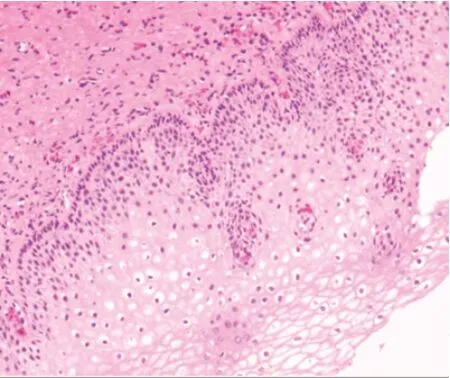
图2 治疗后鳞状上皮非典型改变消失
2.2 不良反应
治疗组中部分患者在光动力治疗时主诉下腹坠胀,但可耐受。少部分患者会出现阴道端治疗时刺痛,甚至难以耐受,治疗结束后上述症状均在数小时内消失,同时部分患者可能出现阴道分泌物增多,均在一周内消失。未出现出血、感染、瘢痕形成及宫颈管狭窄等不良反应。
3 讨论分析
3.1 ALA-PDT治疗的发展及优势
随着光动力治疗(PDT)技术的发展和不断进步,国外已将PDT广泛应用于皮肤肿瘤的治疗,同时也可用于乳腺癌、肺癌、膀胱癌、前列腺癌、直肠癌[2]等,2008年Trushina[3]等将PDT用于治疗CINⅢ及宫颈癌Ia1期,效果明显。国内PDT治疗尚处于起步阶段,多应用于低级别宫颈上皮内病变合并HPV感染者,2012年缪飞[4]等将75例病程>1年的宫颈高危型HPV感染者进行ALA-PDT治疗,HPV转阴率达到72.5%,效果明显。2016年黄乃艳[5]等报道了PDT治疗15例CIN I~II患者,转阴率达93.3%,效果明显。以上不同试验均表明,PDT可有效应用于HPV感染及CIN,其中ALA-PDT相比于其他光敏剂效果更加显著[6]。
5-氨基酮戊酸作为第二代光敏剂,以线粒体为靶点,在活性氧的作用下,使线粒体膜去极化,发生膨胀,导致细胞的呼吸运动和氧化磷酸化中断,从而启动细胞凋亡[7],达到治疗效果。女性宫颈通过生殖道自然腔道可与外界相通,有充分的氧环境,而插入式特制激光光纤能将特定波长的激光光源精准作用于宫颈,满足了PDT治疗的三大条件(激光、光敏剂、氧),使PDT应用于女性生殖道HPV感染的治疗有了生理及解剖条件。相比于传统手术治疗,PDT的优点在于精准、无创,避免了传统外科手术治疗引起的宫颈狭窄、机能不全、瘢痕形成,甚至不孕。同时大大降低了因手术治疗导致宫颈移行区内缩而产生更严重病变的漏诊风险,为患者的长期随访创造条件。
PDT的无创性使得PDT治疗具有可重复性,对于部分难治性或反复感染的患者,可重复治疗。本研究中有3例患者为锥切术后持续性LISL及HPV感染,治疗后6个月复查仍有阳性,予以补充3~4次PDT治疗后转阴,相比于二次锥切术,患者的接受度更高,治疗更容易,出现术中损伤、出血风险更小,远期收益更大。
3.2 CIN及高危型HPV感染治疗时机的选择
虽然国际及国内指南对于宫颈低级别病变及高危型HPV感染的治疗意见以随访为主,并提出低风险患者随访是安全的,但同时也提出病程超过24月时应与患者沟通治疗方案。考虑到国内患者依从性问题,长时间的随访可能导致患者的心理及经济负担,从而选择不恰当的治疗方式,或者失访。本研究有6例患者已完成全部治疗,但后续一年的随访期内也未进行随访,研究表明宫颈病变失访患者中有6%进展为宫颈癌,2001年马丁[8]等报道中国宫颈癌流行病学及病因分析农村宫颈癌的发病率明显高于城市,部分地区宫颈癌死亡率占比居首位,提示随访条件较差的地区宫颈癌发生几率更高。针对不同随访条件的地区,宫颈低级别病变合并HPV感染的治疗策略也应有所不同。需根据患者的意愿、随访条件、治疗的耐受情况选择个性化的治疗或随访方案,而不提倡积极处理的主要原因是担忧治疗过度和术后影响,PDT治疗的无创性可以使治疗影响降至最低,治疗时期选择为病程>12个月也最大限度的排除了过度医疗问题。本研究中ALA-PDT治疗可显著提高HPV感染的转阴率,尤其是16/18型HPV感染,逆转CIN病变,降低远期宫颈癌发病率。同时宫颈创面在4~6周即可恢复正常形态,保护宫颈机能,降低远期对于生育功能的影响。
3.3 锥切或子宫切除术后的病变及HPV感染
锥切或子宫切除术后出现HPV持续性感染和CIN复发是临床中比较常见的一个问题,其发生原因与宫颈病变累及腺体、术前HPV高负荷、术后切缘阳性、切除标本的宽度和深度均相关[9],对于其处理目前争议较大,保守的处理严密随访即可,积极处理可在确认复发后二次手术,但二次手术困难、术中出血风险极高,本研究中选取锥切或子宫切除术确认复发后患者共18例,选用光动力治疗,效果满意。锥切患者除3例患者失访外,其余8例全部转阴,且治疗创伤小。但子宫全切后的VIN治疗效果欠佳,6例患者有3例无效,考虑为子宫全切术后阴道残端治疗时间短,且阴道端神经敏感,患者长时间治疗不易耐受。VIN患者选择光动力治疗应充分评估适应证及告知替代治疗方案,取得知情同意后才可考虑光动力治疗。而锥切后的HPV持续感染或CIN复发,光动力治疗应为优先推荐的方案。
3.4 ALA-PDT对生育功能的保护
随着宫颈病变的年轻化,有生育要求的患者越来越多,但宫颈锥形切除术可能产生宫颈黏连、瘢痕形成甚至宫颈机能不全,导致妊娠不良结局,且经过手术的患者宫颈形态失常,挛缩后的宫颈出现更严重病变时漏诊率更高。PDT治疗不仅使年轻女性的生育需求收益更大,对于宫颈病变后续进展也提供了良好的观察条件。日本Sakamoto[10]等在对520例接受PDT治疗的宫颈病变患者结果分析表明,PDT与锥切术治疗效果相同,并且PDT的妊娠率和顺产率更高,早产率更低。本研究中选取有生育要求的患者14例,经治疗后全部转阴,其中三例患者已自然受孕,妊娠结局有待继续随访。
综上所述,ALA-PDT治疗宫颈低级别上皮内病变和HPV感染是一种安全、有效、副作用小的方法,对于年轻患者的生育功能可以起到保护作用,同时对于锥切及子宫切除术后的患者有着良好的治疗作用。
