大豆种皮膳食纤维的生物发酵与酶解法制备及其体外降脂的研究*
2021-08-16吴星会丁文文颜诗昱蔡文琪滕文静王馨莹杨立娜
吴星会,丁文文,颜诗昱,蔡文琪,李 丽,滕文静,王馨莹,杨立娜*,刘 贺*
(渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州121013)
膳食纤维(Dietary Fiber,DF)是一类不易被人体消化酶所消化的高分子糖类,主要包括纤维素、果胶质、木聚糖、甘露糖等[1],根据其品质特性可将其分为可溶性膳食纤维(Soluble dietary fiber,SDF)和不溶性膳食纤维(Insoluble dietary fiber,IDF)。DF 能够改善人体营养状况,调节机体功能,具有平衡血糖、降低血脂、促进减肥和预防癌症等作用,是医学界及营养学界公认的“第七营养素”[2]。近年来,随着人们生活水平的提高,膳食结构过于精细化的结果也逐渐导致了肥胖、高血压、糖尿病等一部分慢性非传染性疾病的发生[3]。有大量实验研究已经证实DF的摄入可以降低高血脂、减轻肝脏组织损伤等,并且其功效与食用剂量成正相关性[4-6]。
我国是名副其实的全球第一大豆消费国,大豆深加工产生的副产物大豆种皮被当作饲料或废弃物处理,造成极大的资源浪费和环境污染。然而大豆种皮中含有丰富的膳食纤维,是制备膳食纤维的良好原料。目前常用的大豆种皮膳食纤维的提取方法[7]主要有发酵法、酶法、化学法及膜分离法等。其中,发酵法是指选择合适的菌种,利用菌种自身产生的淀粉酶、蛋白酶等酶系来水解原料中的淀粉、蛋白质等杂质,从而提取膳食纤维[8]。采用发酵法制备膳食纤维不仅能够降低生产成本,而且在工业化的生产中容易实现,是一种既安全又高效、既经济又优产的膳食纤维制备方法[9]。酶法是采用酶制剂对原料进行酶解,以除去表面杂质得到不溶性膳食纤维粗品,再进一步酶解改性,获得水溶性膳食纤维的方法[10]。酶法提取膳食纤维的优点之一是提取的膳食纤维具有高纯度,它适用于蛋白质和淀粉含量较高的原料。酶法应用成本相对较高,但作用条件温和,水解专一性强,能最大限度回收有效成分,且获得的产品品质好,对环境无污染[11]。
本研究采用发酵法和复合酶法提取大豆种皮膳食纤维,对比、分析两种方法提取的大豆种皮膳食纤维的持水力、溶胀力、持油力等理化性质差异,并且通过测定其对体外吸附胆固醇能力及体外结合胆酸钠的能力,以此确定大豆种皮膳食纤维的降血脂能力,为大豆种皮膳食纤维的开发利用提供理论基础,同时增加大豆种皮的经济效益,具有一定的经济价值与现实研究意义。
1 材料与方法
1.1 材料与试剂
大豆种皮购于锦州大豆皮经销公司;米曲霉购于北京川秀科技有限公司;鸡蛋购于万达超市。
马铃薯葡萄糖琼脂培养基、α-淀粉酶、胰蛋白酶、糖化酶、磷酸氢二钠、磷酸二氢钠、乙醚、95%乙醇、硫酸、标准胆固醇、牛磺胆酸钠、浓硫酸、冰乙酸及邻苯二甲醛等试剂,均为国产分析纯。
1.2 仪器与设备
AR124CN电子分析天平,奥豪斯OHAUS公司;JB-2A磁力搅拌器,上海雷磁创益仪表有限公司;UV2550紫外分光光度计,日本SHIMADZU公司;ZLWY-100B台式恒温振荡器,上海一恒仪器有限公司;TDL-4OB离心机,上海安亭科学仪器厂。
1.3 方法
1.3.1 菌种活化与菌悬液制备
将米曲霉菌种接种到PDA平板上,37℃恒温培养箱中倒置培养4~5 d,采用平板划线的方法扩大培养2~3次。在米曲霉培养皿中加入2 mL无菌水,收集米曲霉孢子并计数,当数量达到106~107个/mL时备用。
1.3.2 大豆种皮膳食纤维的制备
(1)复合酶解法制备大豆种皮膳食纤维。将大豆种皮粉碎,过80目筛,获得大豆皮粗粉。在室温下称取200 g粗粉于通风柜中加入乙醇,立即密封,防止其挥发。静置1 h后,除去粗粉中的脂类物质。接着向其中添加 10 mL PBS(缓冲液)(pH=6.0),随后加入0.8 g α-淀粉酶,60°C下水浴 1 h。 冷却 10 min至室温后,加入0.16 g的胰蛋白酶,于60°C下水浴1 h。冷却10 min至室温后,加入0.8 g糖化酶,于60°C下水浴1 h,边加热边搅拌。冷却至室温,真空抽滤得到滤液和滤渣。将滤渣用95%的无水乙醇漂洗3次,70℃恒温干燥处理,将干燥后的滤渣粉碎后,过60目筛,得IDF。加入4倍体积的95%乙醇与浓缩后的滤液混合24 h进行沉淀,离心过滤后得到滤渣,70℃条件下,恒温干燥至恒重,将得到的干燥后的滤渣粉碎,过60目筛,即制得SDF。
(2)发酵法制备大豆种皮膳食纤维。准确称取20 g大豆种皮粗粉,放入容量为100 mL的锥形瓶中,按照料液比为1:4,加入蒸馏水,混合均匀,120℃灭菌15 min后,加入制备好的米曲霉孢子悬液,在37℃恒温培养4~5 d,发酵至呈凝乳状态,能闻到轻微的酸味。蒸馏水清洗发酵好的豆皮粗粉1~2次,真空抽滤得到滤液和滤渣。滤渣用95%的无水乙醇漂洗3次,进行70℃恒温干燥处理,将干燥后的滤渣粉碎后,过60目筛,得IDF。准备上述滤液4倍体积的95%乙醇溶液与滤液混合24 h进行沉淀,过滤后得到滤渣,70℃条件下,恒温干燥至恒重,将得到的干燥后的滤渣粉碎,过60目筛,即制得SDF。
1.4 持水力的测定
在烧杯中,准确称取m1g已经完全干燥的样品,在烧杯中加入20℃的蒸馏水,混合后让其充分浸泡1 h,使用滤纸将其滤干后所剩的样品转移至质量为m2g的表面皿上,称重,记为m3g,持水力用公式(1.1)计算。
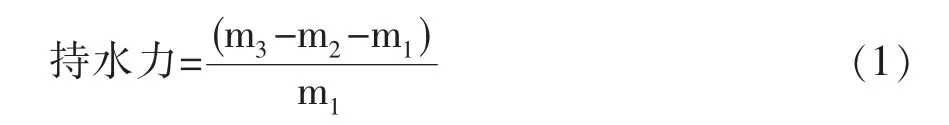
1.5 溶胀力的测定
称取质量为m的样品,放置在10 mL大小的量筒中,记录此时在量筒内的体积为V1,在量筒中加入适量蒸馏水,震荡均匀,室温条件下静置24 h,记录此时量筒内的体积为V2,溶胀力利用公式(2)进行计算。

1.6 持油力的测定
称取样品1.00 g,将其倒入15 mL的离心容器中,再将10 mL的大豆油加入离心容器中,充分摇匀混合,静置1 h,于37℃环境下,以5 000 r/min的速度离心10 min,除去上层大豆油,称量剩余残留物质量,根据公式(3)计算持油力。

1.7 体外胆酸盐结合能力的测定
分别取 0.2 g、0.4 g、0.6 g、0.8 g、1.0 g 膳食纤维粉末于试管中,加入蒸馏水加至10 mL。在37°C恒温振荡器中振荡2 h,向每个样品中加入4 mL牛磺胆酸钠(2%),在37°C的恒温振荡器中振荡2 h。将摇匀后的混合物转移到离心管中,4 000 r/min离心20 min,取上清液,计算胆酸盐结合率,公式如(4)。

式中:X为胆酸盐结合率,%;C1为实验组未结合的胆酸盐质量浓度,mol/L;1-C1为已结合的胆酸盐质量浓度,mol/L;C2为空白对照组总的胆酸盐质量浓度,mol/L。
1.8 体外吸附胆固醇的测定
1.8.1 胆固醇吸附随时间的变化
新鲜鸡蛋保留蛋黄部分,加入9倍量的蒸馏水,用磁力搅拌器充分搅打呈乳液状,将上述蛋液加入200 mL锥形瓶中,并加入2 g的膳食纤维粉,调节pH 7.0,放入震荡器内,于37℃恒温震荡,分别取出30 min,60 min,90 min,120 min 的溶液,4 000 r/min离心20 min,取上清0.04 mL,在550 nm下采用邻苯二甲醛法比色测定胆固醇含量。胆固醇的吸附量利用公式(5)计算。

1.8.2 胆固醇吸附随pH变化
新鲜鸡蛋保留蛋黄部分,加入9倍量的蒸馏水,用磁力搅拌器充分搅打呈乳液状,将上述蛋液加入200 mL锥形瓶中,加入2 g的膳食纤维粉(上述样品各做一份),并分别调节pH 2.0和7.0,放入震荡器内,于37℃恒温震荡2 h,4 000 r/min离心20 min,取上清0.04 mL,在550 nm下采用邻苯二甲醛法比色测定胆固醇含量。胆固醇的吸附量利用公式(5)计算。
1.9 数据处理
所有试验均重复做3次,以表格记录数据,相关数据处理采用Excel 2016并绘制图表。通过SPSS软件进行统计分析,p<0.05表示数据有效并具有统计学意义。
2 结果与分析
2.1 膳食纤维含量
由图1可知,发酵法制备的SDF提取率为9.18%,IDF的提取率为86.31%。酶解法的SDF的提取率为12.24%,IDF的提取率为72.18%。结果表明,大豆种皮中的膳食纤维以IDF为主,酶解法提取的SDF含量显著高于发酵法(p<0.05),而发酵法提取的IDF含量显著高于酶解法(p<0.05),造成这一现象的主要原因可能是在酶解过程中,随着酶添加量的增加,酶促反应速度也增加,使IDF发生降解,溶解度发生改变,一部分IDF变成SDF,从而使SDF提取率增加[12]。梁志宏等[7]以残次裂枣为原料,分别采用化学法、酶解法和发酵法制备红枣膳食纤维,结果发现SDF得率最高的是酶解法,IDF得率最高的是发酵法。这与本次研究结论一致。
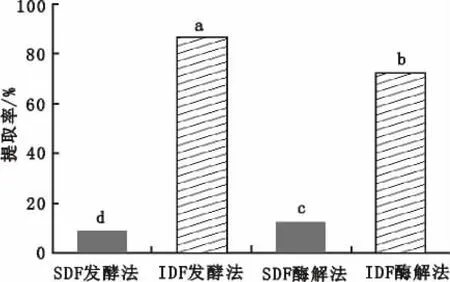
图1 不同工艺膳食纤维的提取率
2.2 膳食纤维持水力、溶胀力和持油力
持水力与溶胀力是衡量膳食纤维品质好坏的重要指标,值越大表示分子比表面积越大,结合水的能力越高,吸附性越强,生理活性越好[7]。持油力体现了膳食纤维降低血液中胆固醇的能力。如图2所示,不同提取方式对SDF和IDF的理化性质影响较大,通过比较可以看出,采用发酵法提取的SDF的理化性质最佳。这可能是由于发酵过程中,米曲霉产生纤维素酶使原来聚合度高的SDF部分降解成结构松散的小颗粒水溶性膳食纤维,从而增加了水与膳食纤维的接触面积,提高了持水力和溶胀力。有研究表明[13],膳食纤维的持水力和持油力与样品粒度有关。样品粒度减小,使得可供吸水或吸油的表面积增大,且细颗粒样品的纤维组成结构更为松散,毛细孔更多,能吸附更多的水和油。

图2 不同提取工艺大豆种皮膳食纤维的持水力、溶胀力和持油力
不仅如此,两种方法处理的SDF在持水力、溶胀力和持油力方面也都显著高于IDF,这可能是由于发酵法和酶解法生产过程温和,得到的SDF具有更好的疏松多孔结构,使水和油更容易包裹其中[7]。并且大豆种子在破碎过程中纤维聚合物的断裂,也可能导致样品SDF和其他组分相比,聚合度降低,吸水力增强。除此之外,已有研究表明SDF在水溶液中可形成凝胶,自身吸收水分的同时产生的胶状物也可防止水分流失[14]。
2.3 膳食纤维的胆酸盐结合能力
胆固醇的合成与代谢都与胆汁酸的肝脏循环密切相关。DF对胆汁酸的吸收可以阻碍肠道中胆汁酸的重复吸收,进一步加速胆固醇分解,降低血清胆固醇含量[15]。如图3所示,随着大豆膳食纤维含量的增加,各组样品与胆酸钠的结合率均呈上升趋势,且发酵法制备的SDF结合胆酸钠的能力最为出色。在加入大豆种皮膳食纤维0.8~1.0 g时,大豆种皮膳食纤维结合的胆酸盐基本达到饱和,此时发酵法制备SDF对胆酸钠的结合率为70.28%。酶解法制备的膳食纤维中,SDF的胆酸钠结合能力同样高于IDF。产生这种结论的主要原因可能是源于SDF和IDF在结构上的差异。张瑜等[16]对不同工艺制备的刺梨果渣膳食纤维进行电镜扫描,发现酶法IDF呈不规则多孔的块状结构,发酵法IDF呈小颗粒状结构;而这两种方法制备的SDF超微结构均呈疏松蜂窝状结构。周丽媛等[17]对黑小麦麸皮可溶性膳食纤维进行改性研究,发现超微提取的SDF持水、持油和溶胀性明显低于超高压和挤压膨化,说明SDF的疏松网格结构对胆酸盐的结合更为有利。另外,有研究表明SDF中的活性基团可以螯合吸附胆汁酸之类的有机分子[18-19],有利于SDF更好地发挥生理作用。
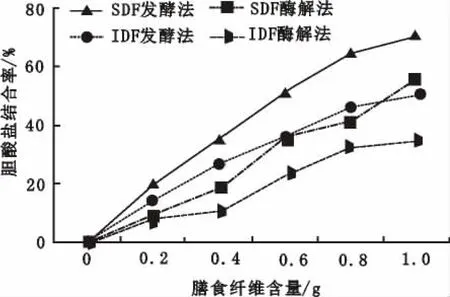
图3 不同用量膳食纤维的胆酸钠结合率
2.4 测定胆固醇吸附能力的结果
已知高胆固醇可以诱发心血管疾病,DF可以阻止胆固醇吸收。图4表示的是胆固醇吸附量与吸附时间的关系。图5表示胆固醇吸附量与pH关系。如图4中,在0~90 min时,各组分的胆固醇吸附量均随吸附时间的延长呈上升趋势,且发酵制备的SDF吸附能力最好。90~150 min时,膳食纤维达到吸附平衡。在不同的提取方法下,同一吸附时间时,SDF吸附胆固醇的能力均高于IDF。
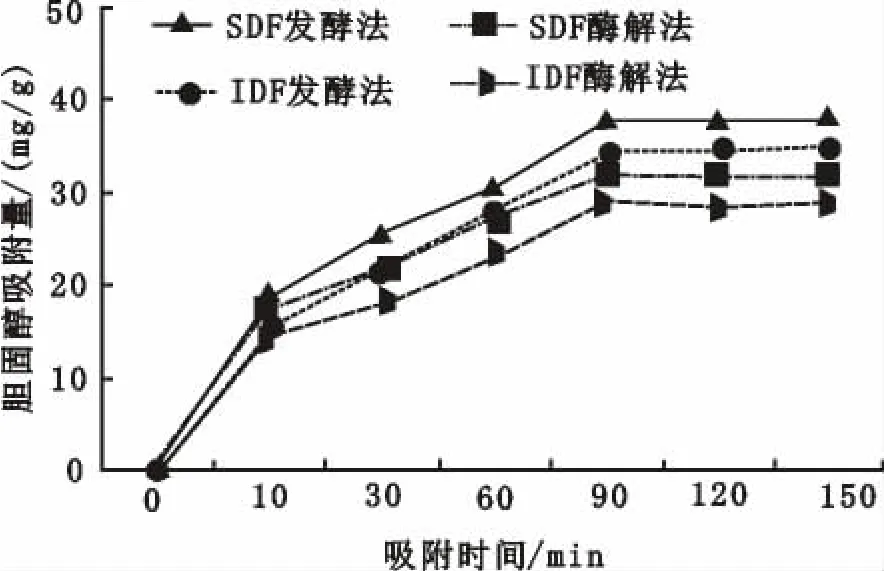
图4 胆固醇吸附量与吸附时间的关系
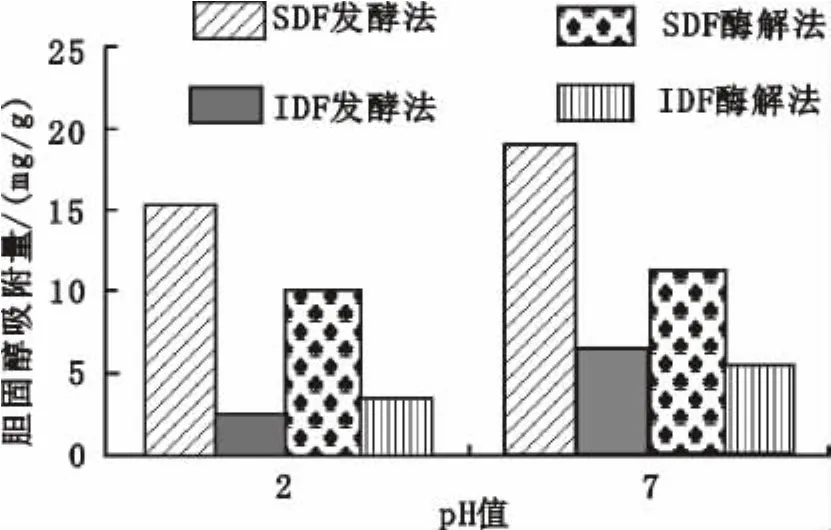
图5 胆固醇吸附量与pH值的关系
此外,pH值对膳食纤维胆固醇吸附效果影响显著。由图5可知,pH=7时的胆固醇吸附效果明显高于pH=2时的胆固醇吸附效果,且两种pH条件下SDF对胆固醇的吸附量均高于IDF。这可能是由于pH值为2.0的环境内有较多的氢离子存在,使得胆固醇和SDF带了较多正电荷,彼此存在互斥的力,导致结合能力减弱,从而降低了吸附量[20]。张瑜等[16]对发酵法、酶解法和化学法制备的刺梨果渣膳食纤维胆固醇吸附力进行研究,发现3种处理方法得到的DF对胆固醇吸附力在pH 7.0时明显高于在pH 2.0时,与本次研究结论一致。
3 结论
采用发酵法提取的大豆种皮中含有9.18%SDF和86.31%IDF,并且SDF的持水力、膨胀力以及持油力均高于IDF。膳食纤维在中性条件下高于酸性条件下对胆固醇的吸附作用。DF对胆酸盐的吸附趋势先加快后趋于平衡,当DF的添加量为1 g时,SDF(发酵法)对胆酸盐的结合率达到最大70.28%,IDF(发酵法)对胆酸盐的结合率达到最大50.13%。在0~90 min时,DF的胆固醇吸附量均随吸附时间的延长呈上升趋势;DF在中性条件下高于酸性条件下对胆固醇的吸附作用,且SDF>IDF。
采用复合酶法提取的大豆种皮中含有9.24%SDF,62.18%IDF,且SDF的持水力、膨胀力以及持油力均以微小差距高于IDF。胆汁酸结合能力与胆固醇吸附能力与发酵法表现类似,但是效果远不及发酵法。
