miR-129-5p调控MC3T3-E1细胞成骨分化的体外研究
2021-08-14赵长铭王振宁徐璐璐
赵长铭,黄 萌,王振宁,徐璐璐
1解放军总医院研究生院,北京 100853;2 解放军总医院第一医学中心 口腔正畸科,北京 100853
骨代谢过程中,许多小分子蛋白或RNA 通过对有分化潜能的干细胞发挥调控作用,进而影响骨骼发育和重塑。越来越多的实验研究表明microRNAs 参与调控干细胞增殖、成骨分化过程,并发挥重要调控作用[1-4]。最近一项研究显示,进行体育锻炼后人血清中microRNAs(miR-129-5p、miR-21-5p 和miR-378-5p)表达增加[5]。用锻炼后的血清培养人骨髓间充质干细胞,发现对成骨分化有抑制作用的PTEN 和SMAD7 蛋白表达下调,相关成骨分化基因表达上调。我们前期的实验发现,在小鼠骨髓间充质干细胞成骨分化7 d、14 d 后的miR-129-5p 表达水平均显著上调(P<0.05)。Liu 等[6]报道miR-129-5p 通过调控BMP2 基因促进肝癌的增殖和转移。而人滑膜间充质干细胞来源的miR-129-5p 通过靶向hMGB1 减轻IL-1 诱导的骨关节炎[7]。对miR-129-5p 研究主要集中在肿瘤增殖、转移及免疫调控方面,其在成骨分化和骨形成过程中的作用和机制尚不清楚。因此,本研究探究miR-129-5p 对MC3T3-E1 细胞成骨分化的影响,通过Targetscan 软件预测并筛选出miR-129-5p 的潜在靶基因,并进一步研究其作用靶点及具体调控机制,为骨发育和骨重塑提供理论支持。
材料和方法
1细胞和试剂 α-MEM 培养基(Gibco,美国);特级胎牛血清(Gibco,美国);磷酸盐缓冲液PBS(Gibco,美国);青链霉素混合液(Gibco,美国);0.25% 胰蛋白酶(Gibco,美国);MC3T3-E1 细胞(购自中国科学院上海生科院细胞资源中心;RIPA 裂解液(索莱宝,北京);小鼠成骨分化诱导液、茜素红染色液(赛业生物,北京);cDNA逆转录试剂盒(Thermo,美国);qRT-PCR 试剂盒(Roche,瑞士);慢病毒miR-129-5p mimic、inhibitor、control 和慢病毒助转剂HitransG A 25x(吉 凯,北 京);mRNA 引物10 µm(生工生物,北京);Runx2 抗体(Abcam,USA);OCN 抗体(Affinity Biosciences,USA);Smad6 抗体(成都正能生物科技公司);羊抗鼠、羊抗兔二抗(中杉金桥);ECL发光液(普利莱);碱性磷酸酯酶显色试剂盒(碧云天);碱性磷酸酶检测试剂盒(P0321S,碧云天)。
2慢病毒的转染和MC3T3-E1 细胞成骨分化培养 取生长状态良好的MC3T3-E1 细胞,0.25%胰蛋白酶消化后将MC3T3-E1 细胞以1 × 105/孔的密度接种于六孔板中,使用10%胎牛血清α-MEM全培养液培养,放置于5% CO2、37℃孵箱。第2 天细胞换液时,PBS 洗3 次后,直接加入miR-129-5p 的慢病毒(control、mimic 和inhibitor)、助转剂和无血清的α-MEM 培养基,4~6 h 后补液(含胎牛血清的培养基),24 h 换液。72 h 荧光显微镜下观察GFP 荧光,以确保转染效率达到80%~90%,进行后续实验。转染后的细胞直接进行成骨分化培养,每隔2 d 换成骨诱导液,在诱导分化7 d和14 d 时测定成骨表达标志物Runx2 和OCN。
3碱性磷酸酶染色观察细胞染色情况 转染慢病毒的MC3T3-E1 细胞,加入小鼠成骨分化诱导液(赛业,中国) 培养。成骨诱导分化培养7 d 后,弃去培养基,使用PBS 缓冲液冲洗3 次,按照碱性磷酸酯酶显色试剂盒(C3206,碧云天) 使用说明,将经过成骨诱导细胞样品用4% 多聚甲醛溶液固定30 min 后,PBS 清洗细胞3~5 次。按照说明书配置染色工作液,显色缓冲液3 mL,BCIP 液(300×) 10 µL,NBT 溶液(150×)20 µL,共计3.03 mL ALP 染色工作液。去除PBS,加入能适量ALP 染色工作液,确保能充分覆盖样品。室温避光孵育30 min,直至显色达到预期效果。PBS 清洗工作液3~5 次以中止显色反应,自然光下拍照。
4碱性磷酸酶活性检测ALP 表达 如“材料和方法 3”中的细胞培养方法,在7 d 时收集样品,进行ALP 活性检测。采用细胞裂解液裂解细胞后,加入溶液稀释10 倍显色底物1.5 mL,充分溶解混匀,冰上放置。取标准品溶液10 µL p-nitrophenol溶液,用检测缓冲液稀释至0.2 mL,最终浓度为0.5 mmol/L。使用96 孔板设置空白对照孔、标准品孔和样品孔。用枪头轻轻吹打混匀,37℃孵育5~10 min。每孔加入100 µL 反应终止液终止反应。在405 nm 测定吸光度,计算出样品中的碱性磷酸酶活性。
5茜素红染色检测钙结节 成骨诱导分化培养21 d 后,取各组细胞PBS 冲洗3 次,加入4%多聚甲醛,固定30 min,弃去固定液,PBS 冲洗3 次,使用茜素红(赛业) 染色10 min,PBS 冲洗3 次,拍照。再将染色的细胞用10%十六烷基吡啶氯化物溶解,并用酶标仪测定在562 nm 处的吸光度值用以半定量分析。
6实时荧光定量PCR 检测成骨基因mRNA 转染miR-129-5p 慢病毒的三组细胞(control、mimic和inhibitor),体外成骨诱导7 d 和14 d 后,将待检测的细胞六孔板中每孔加入1 mL Trizol,放入1.5 mL 无RNA 酶EP 管中。每1 mL Trizol 加200 µL三氯甲烷,剧烈震荡15 s 后,室温孵育10 min。提前预冷离心机至4℃,12 000 g 离心20~25 min。取上层水相到新管中加入600 µL 异丙醇,颠倒混匀,室温孵育15 min。低温离心机在4℃下12 000 g 离心15 min。去掉上清,加入1 mL DEPC水配制的75% 乙醇,涡旋或颠倒混合。4℃下7 500 g 离心7 min。去上清,用吸水纸小心将管壁和管盖上残留的液体吸干。加入20 µL DEPC,轻弹数次使其溶解。测定RNA 的浓度。按照说明书反转录体系,以1 000 ng 的RNA 为模版,反转录为更为稳定的cDNA(组分:2×mRNA master mix 10 µL,总RNA 1 µg,无RNA 水定容至20 µL)。使用实时PCR 系统,荧光反应条件为94℃ 2 min →95℃ 20 s→ 58℃ 30 s→ 循环40 次。根据标准曲线计算mRNA 水平,将每个样品与内参基因β-actin比较,结果以2-ΔΔCt表示。所用的引物均为生工生物有限公司提供,引物序列见表1。
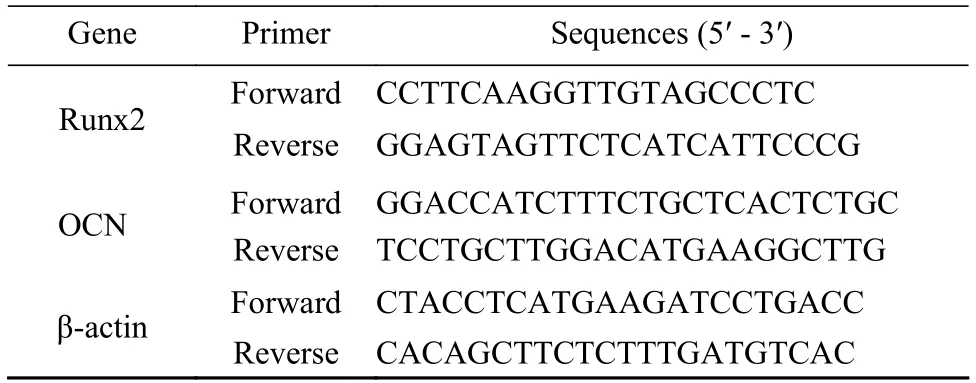
表1 引物序列Tab.1 Primer sequences
7Western blot 检测Runx2 和OCN 的蛋白表达 转染MC3T3-E1 细胞并成骨诱导7 d 和14 d 后,向6 孔板中加入含蛋白酶抑制剂(PMSF) 的RIPA 裂解液,冰上仔细刮取细胞并裂解30 min 收集蛋白产物。按照试剂盒(Thermo Fisher Scientific USA)的说明,BCA 法测定蛋白含量后,取定量的总蛋白量后进行凝胶电泳,转移到PVDF 膜后,TBST洗膜3 次,每次10 min。5% 的脱脂牛奶封闭1 h后,一抗Runx2(兔抗,CST,USA) 和OCN(兔抗,Affinity,USA) 按照1∶1 000 浓度配制后孵育,4℃过夜孵育,TBST 洗两次,室温二抗孵育1 h 后,TBST 洗3 次后,ECL 发光液显色。
8双荧光素酶检测miR-129-5p 与Smad6 的关系Targetscan 预测miR-129-5p 和Smad6 3’UTR 区可能的结合位点,合成包含Smad6 的野生型(Smad6-wt)或突变体(Smad6-mut) 种子区的序列,并将其克隆到荧光素酶质粒中。293T 细胞培养在α-MEM 培养基(含10% 胎牛血清) 中生长至80%融合后,将其与指定的报告基因构建体和海肾荧光素酶质粒一起接种于48 孔板中(1 × 104/孔)。转染后24 h 加入荧光素酶反应底物,使用酶标仪先后测定(Thermo Multiskan FC)萤火虫荧光素酶和海肾荧光素酶的吸光度值,用海肾荧光素酶荧光强度标准化后,统计比值数据并作图。
9统计学分析 采用Graphpad Prism 7 软件对数据处理及统计学分析。两组数据间的比较采用两独立样本t检验分析,多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
结果
1慢病毒转染效率 miR-129-5p 慢病毒过表达(mimic)、敲低(inhibitor) 和阴性对照(control)感染MC3T3-E1 细胞24 h 后收集细胞,PCR 检测显示mimic 组miR-129-5p 的表达量高于对照组,inhibitor 组表达低于对照组(P<0.05)。见图1。
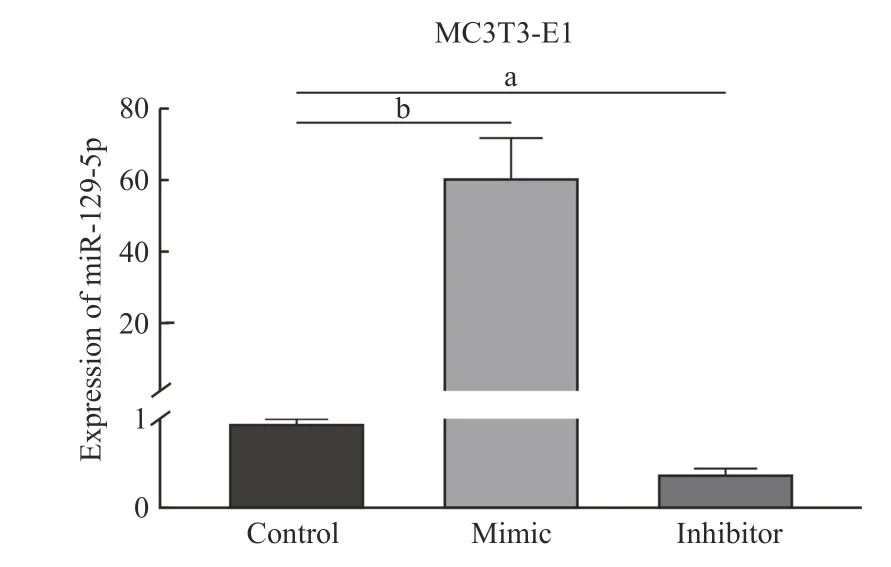
图1 miR-129-5p 在MC3T3-E1 细胞中的转染效率(aP<0.05,bP<0.01)Fig.1 Transfection efficiency of miR-129-5p in MC3T3-E1 cells(aP<0.05,bP<0.01)
2碱性磷酸酶及钙结节形成情况 成骨诱导分化培养7 d 时,碱性磷酸酶染色结果发现mimic 组较control 组碱性磷酸酶活性明显增强;inhibitor组则弱于control 组。成骨诱导分化培养21 d 时,倒置显微镜下观察茜素红染色检测钙结节形成和矿化情况,mimic 组钙化结节明显多于control 组,inhibitor 组钙化结节则少于control 组(P<0.05)。见图2。
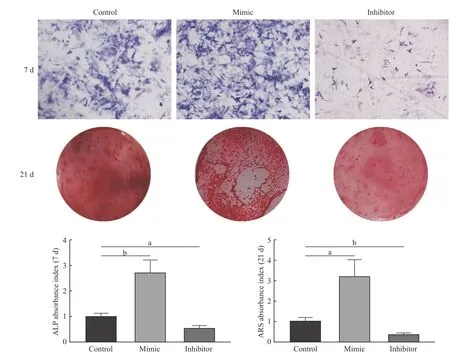
图2 碱性磷酸酶(7 d)和茜素红染色情况(21 d)(aP<0.05,bP<0.01)Fig.2 Alkaline phosphatase (7 days) and Alizarin red staining (21 days)(aP<0.05,bP<0.01)
3miR-129-5p 促进MC3T3-E1 细胞成骨分化基因Runx2 和Ocn 表达 在成骨诱导分化7 d 时,mimic组成骨早期转录因子Runx2 在mRNA 和蛋白水平上均升高。成骨诱导分化14 d 后,与inhibitor 组和control 组相比,过表达miR-129-5p 后成骨分化晚期基因OCN 的表达均上调。这些结果表明miR-129-5p 促进了MC3T3-E1 细胞向成骨细胞的分化。见图3。
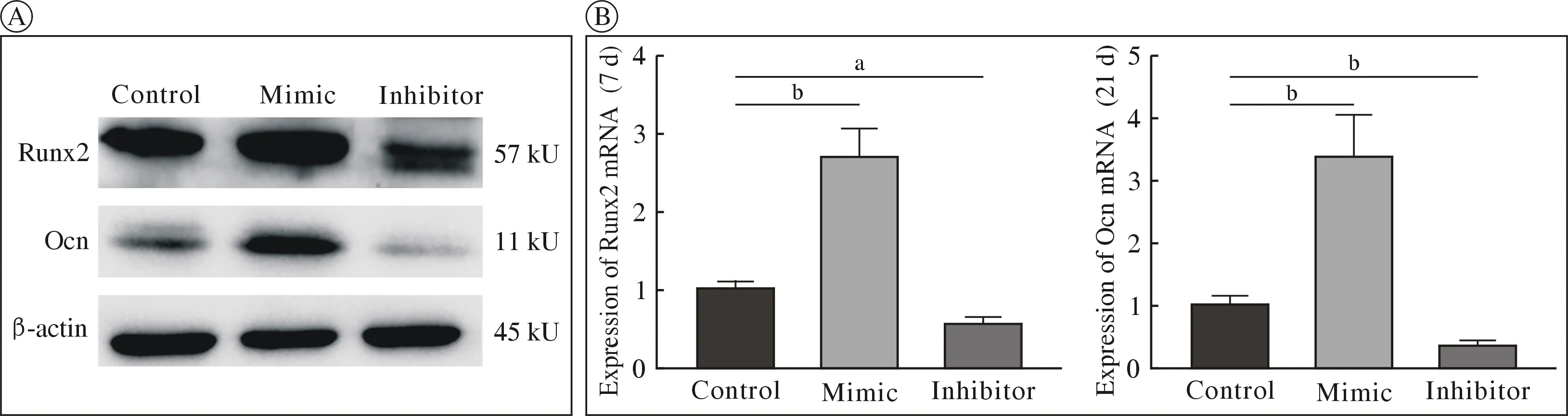
图3 Runx2 和OCN 的mRNA 和蛋白表达水平(aP<0.05,bP<0.01)A:成骨分化后control 组,mimic 组和inhibitor 组Runx2 和OCN 蛋白的表达水平(β-actin 标准化);B:成骨分化7 d 时,Runx2 的mRNA 表达水平。成骨分化14 d 时,OCN 的mRNA 表达水平Fig.3 mRNA and protein expression of Runx2 and OCN (aP<0.05,bP<0.01)A:The expression levels of Runx2 and OCN proteins in the control group,mimic group and inhibitor group (standardized by β-actin);B:Runx2 mRNA expression level at 7 days.OCN mRNA expression level at 14 days
4miR-129-5p 靶向调控Smad6 表达 Targetscan预测发现miR-129-5p 的潜在靶基因有1 000 多个,其中Smad6 是其中一个靶基因,双荧光素酶实验验证miR-129-5p 是否作用于Smad6 的3’UTR区域。结果表明转染Smad6 野生型的293T 细胞的荧光素酶活性明显低于对照组,而转染突变型的293T 细胞与其阴性对照组的荧光素酶活性无显著差异。Western-blot 检测Smad6 的蛋白水平,发现在MC3T3-E1 细胞过表达miR-129-5p 后,Smad6蛋白表达降低(图4),进一步说明Smad6 是miR-129-5p 潜在调控的靶基因。
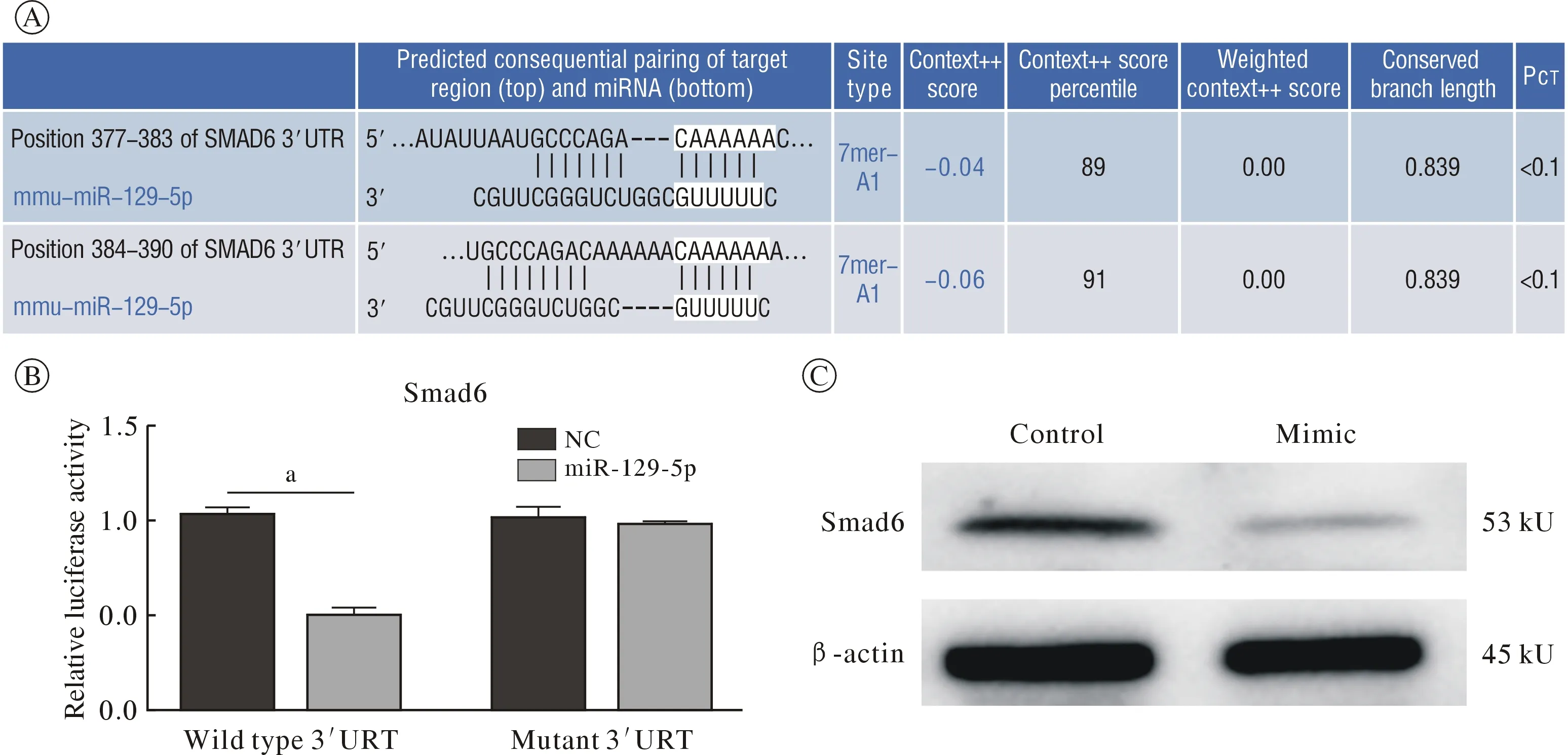
图4 Smad6 是miR-129-5p 调控的靶基因(aP<0.01)A:生物信息网站Targetscan 预测miR-129-5p 可能调控Smad6 基因及调控位点区域;B:Smad6 荧光素酶活性检测结果;C:过表达miR-129-5p mimic 后靶基因Smad6 蛋白水平下调Fig.4 Smad6 as the potential target gene regulated by miR-129-5p (aP<0.01)A:Bioinformatics website Targetscan predicts that miR-129-5p may regulate the Smad6 gene and its regulatory site region.B:Smad6 luciferase activity detection results;C:Down-regulation of target gene Smad6 protein level after miR-129-5p mimic
讨论
成骨细胞具有合成骨基质蛋白的能力,在维持骨骼微结构和体内平衡中起着关键作用[8]。MC3T3-E1 细胞是小鼠成骨前体细胞系,具有成骨分化的潜能,是研究成骨分化和骨形成的良好细胞载体[9]。microRNAs 是一种高度保守、非编码的RNA,主要通过与互补序列的mRNA 直接相互作用,诱导mRNA 降解或抑制其转录后翻译,进而影响许多生物学进程[10]。而且microRNA 和转录因子共同调控细胞增殖分化,并已成为近年来研究骨代谢治疗的相关靶点。Zhao 等[11]研究发现,miR-497-5p 在骨质疏松患者中低表达,在MC3T3-E1 细胞分化过程中表达上调。miR-497-5p 通过靶向Hmga2 抑制了JNK 通路的激活,促进了MC3T3-E1 细胞成骨分化。同样,成肌细胞分泌的胞外小泡中的miR-196a-5p 可促进ST-2 细胞和MC3T3-E1 细胞向成骨细胞分化[12]。而Chen等[13]发现miR-17-3p 下调Bmp2 诱导的MC3T3-E1细胞的成骨分化,是通过靶向调控Sox6 表达实现的。Tao等[14]发现miR-181a-3p通过靶向调节Bmp10从而抑制人骨髓间充质干细胞的成骨分化。
本研究发现,miR-129-5p 在细胞成骨分化中表达上调,继而猜想miR-129-5p 可能在成骨分化起作用。我们选取了小鼠成骨前体细胞MC3T3-E1 作为研究对象。碱性磷酸酶活性是衡量成骨细胞早期分化的指标,主要在细胞外基质分泌阶段分泌。慢病毒载体过表达miR-129-5p,发现mimic组碱性磷酸酶染色和活性高于对照组。茜素红染色可通过钙结节的染色间接反映出骨质形成的多少。mimic 组钙结节的染色较深、数量多,这说明miR-129-5p 在成骨分化晚期促进了成骨前体细胞矿化。为了深入研究miR-129-5p 的成骨分化作用,我们检测了成骨相关基因Runx2、OCN 的mRNA 和蛋白表达,过表达组均上调,这验证了我们之前的染色结果。
通过Targetscan 网站生物信息学分析发现,成骨相关基因Smad6 可能是miR-129-5p 潜在的靶基因。SMAD 家族蛋白主要分为受体调节型SMAD、共同伴侣SMAD 和抑制型SMAD。Smad6是抑制型SMAD,其会干扰SMAD 受体或SMADSMAD 的相互作用,并负反馈调节BMP/SMAD 通路[15-16]。SMAD 家族成员促进了来自配体激活受体的信号转导,转位至细胞核以调节下游靶基因的表达[17-18]。双荧光素酶报告基因实验证明,Smad6 可能是miR-129-5p 调控的靶基因,过表达miR-129-5p 后Smad6 蛋白水平下调,这表明miR-129-5p 可能是通过调控Smad6 的表达来调控MC3T3-E1 的成骨分化水平,具体机制需要进一步讨论。
综上所述,本研究发现miR-129-5p 参与了MC3T3-E1 细胞成骨分化,成骨分化相关基因Runx2 和OCN 表达升高,为揭示骨分化和骨再生的分子机制提供了初步的理论依据。
