软骨终板干细胞及骨髓间充质干细胞对软骨终板细胞增殖分化的影响
2021-08-14高健明汪爱媛徐宏光
高健明,汪 靖,刘 晨,肖 良,彭 江,汪爱媛,徐宏光
1皖南医学院 脊柱研究中心,皖南医学院第一附属医院弋矶山医院 脊柱外科,安徽芜湖 241001;2 解放军总医院 全军骨科战创伤重点实验室,骨科再生医学北京市重点实验室,北京 100853
下腰痛是临床常见疾病,目前认为椎间盘退变是导致下腰痛的主要原因[1]。椎间盘中,软骨终板由透明软骨组成,是供应成熟椎间盘营养物质的主要通道[2]。软骨终板细胞(cartilage endplate cell,CEP)功能异常和数量减少会导致软骨终板钙化或硬化进而减少椎间盘营养物质的供应,最终导致椎间盘退变的发生。有研究表明软骨终板存在原位干细胞即软骨终板干细胞(cartilage endplate stem cell,CESC),具有较强的克隆形成能力和多向分化潜能[3-5]。骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)是一种骨髓来源的干细胞,在一定条件下能够分化成为成骨细胞、成软骨细胞、成肌细胞、脂肪细胞、神经细胞等,可用于多种组织缺损的修复[6]。随着组织工程学的发展,BMSC 作为一种具有多种分化潜能的种子细胞越来越受到人们的关注。本实验获取了大鼠腰椎软骨终板组织,分离出CEP 和CESC,将CEP 分别与CESC、BMSC 进行体外非接触式共培养,通过检测各共培养组的增殖与凋亡,及软骨表型基因ACAN、COLⅡ及Sox9 的表达,对比探讨CESC、BMSC 对CEP 的影响,进而探讨CESC 作为组织工程种子细胞的潜在可能。
材料和方法
1实验动物 SD 清洁级大鼠20 只,体质量200~300 g,雌雄不限,由北京市科宇动物养殖中心提供。
2主要试剂 0.25% EDTA-胰酶(Gibco);0.2%Ⅱ型胶原酶(Sigma);DMEM/F12 (Gibco);干细胞培养用血清(上海双洳生物科技有限公司);干细胞成骨分化诱导培养基(赛业生物科技有限公司);干细胞成软骨分化诱导培养基(赛业生物科技有限公司);干细胞成脂分化诱导培养基(赛业生物科技有限公司);甲苯胺蓝染色剂(索莱宝生物科技有限公司);茜素红染色液(索莱宝生物科技有限公司);油红O 染色剂(索莱宝生物科技有限公司);番红染色液(索莱宝生物科技有限公司)。
3大鼠腰椎CEP 及CESC 的分离和培养 取5 只清洁级SD 大鼠,麻醉后分离出软骨终板,剪碎,将软骨终板置于DMEM/F12 配制0.02%的Ⅱ型胶原酶中,37℃下消化4 h,离心重悬后种植于培养瓶中,在37℃、5% 的CO2培养箱中培养,每3 d 换液1 次,获得CEP,按时用倒置显微镜观察、拍照。待细胞融合至90%时,进行甲苯胺蓝染色。同时将上述获得的部分原代细胞按照100/cm2的密度接种到底面积25 mm3培养瓶中[3,7],37℃、5%的CO2培养箱中培养,每3 d 换液1 次,培养10 d,获得CESC。
4大鼠BMSC 的分离和培养 取5 只清洁级SD大鼠,以3% 戊巴比妥钠40 mg/kg 腹腔注射麻醉,无菌操作下取其四肢的长骨,用注射器抽取长骨内骨髓,加含10%胎牛血清的培养液吹打制成单细胞悬液,分装于底面积为25 mm2培养瓶中。在37℃、5%的CO2培养箱中培养,每3 d 换液1 次,待细胞融合至90%时,用体积分数0.25%胰蛋白酶消化、传代。
5大鼠CESC 及BMSC 的三系诱导分化 分别取P3 代大鼠CESC 及BMSC,接种于6 孔板,待细胞融合至80%时分别加入成脂细胞诱导液、成软骨诱导液及成骨诱导液。培养21 d 后,分别用油红染液、番红染液及茜素红染液染色,倒置显微镜下观察拍照。
6Transwell 细胞共培养 分别将P3 代大鼠CEP、CESC 和BMSC 用体积分数0.25% 胰蛋白酶消化3 min,加入DMEM/F12 培养基终止消化,细胞悬液收集至离心管,1 500 r/min 离心5 min。收集细胞,弃上清后,细胞用含15%胎牛血清的培养液重悬,进行细胞计数。根据Transwell 小室上下室加入的不同细胞,分为CEP 组(上室为CEP,下室为CEP)、CESC 组(上室为CESC,下室为CEP)、BMSC 组(上室为BMSC,下室为CEP),即分别将CESC、BMSC 及CEP 悬液接种于Transwell 小室的上室,孔中细胞数约5 × 104个,加入培养基2 mL。而后分别将CEP 的悬液接种于Transwell小室的下室,孔中细胞数约5 × 104个,加入培养基2 mL,共培养1 d、3 d、5 d 和7 d,培养期间每2.5 d 换液1 次(图1)。

图1 实验分组 Transwell 共培养示意图Fig.1 Transwell co-cultivation diagram of experimental groups
7CCK-8 实验检测大鼠CEP 增殖能力 利用Transwell 小室将大鼠CEP 分别与CESC 和BMSC进行非接触式共培养1 d、3 d、5 d 及7 d 后,分别更换培养基,加入CCK-8 液后继续培养2 h,吸取上清液于96 孔板,每个孔设定3 个复孔,无细胞处理的CCK-8 试剂作为空白对照,用酶标仪测定吸光度值,每天同一时间进行检测,计算数据后,绘制共培养前后CEP 的生长曲线。
8流式细胞术检测CEP 凋亡率 待CEP 组、CESC 组及BMSC 组软骨终板细胞融合至80%左右时,用体积分数0.25%胰蛋白酶消化3 min,加入含10% 胎牛血清的DMEM/F12 培养基终止消化,细胞悬液收集至离心管,2 000 r/min 离心5 min,PBS 洗涤2 次,收集3 × 105个细胞,加入500 µL 的Binding Buffer 悬浮细胞,再依次加入5 µL Annexin V-FITC、5 µL Propidium Iodide 混匀,室温避光条件下反应10 min,在流式细胞仪下检测细胞凋亡情况。
9RT-qPCR 检测三组Transwell 小室CEP 软骨表型基因ACAN、COLⅡ、Sox9 的表达情况 分别在共培养1 d、3 d、5 d 和7 d 提取CEP RNA,反转录为cDNA。COL2A1 上游引物5’ CCTGAAA CTCTGCCACCCAG 3’,下游引物5’ GTTCTT CCGAGGCACAGTCG 3’,ACAN 上游引物5’ACACCCCTACCCTTGCTTCT 3’,下游引物5’AAAGTGT CCAAGGCATCCAC 3’,Sox9 上游引物5’ CGTCAACGGCTCCAGCA 3’,下游引物5’ TGCGCCCACACCATGA 3’。扩增反应条件:95℃预变性30 s,95℃变性10 s,58℃退火30 s,72℃延伸45 s,重复40 个循环。结果用-△△Ct表示。
10统计学方法 采用SPSS 18.0 软件分析实验数据,实验数据以表示,各组间差异用单因素方差分析,P<0.05 为差异有统计学意义。
结果
1大鼠CESC、BMSC、CEP 分离及培养结果 大鼠CEP 接种到培养瓶,在单克隆3 d 后,可见培养皿中有细胞集簇形成,5 d 后集簇明显,形态呈梭形,细胞排列有序(图2);CEP 培养10 d 后细胞接近融合,在 DMEM/F12 培养基中呈多角形或梭形,贴壁生长,细胞遮光性良好。通过穿刺抽吸法获得BMSC,细胞以分散集落方式增长,多呈纺锤形或短梭形,部分细胞呈多边形(图3)。
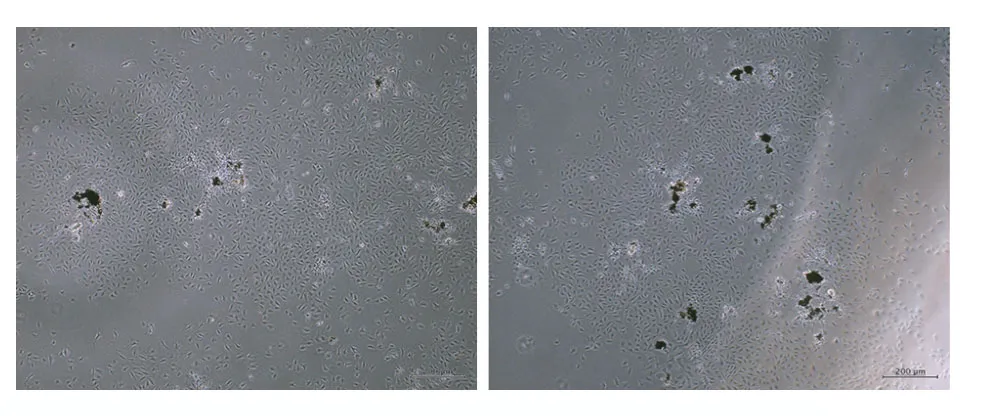
图2 单克隆法培养后获得大鼠CESC,细胞集簇生长Fig.2 CESC of rats was obtained after culturing by monoclonal method,and the cells grew in clusters

图3 大鼠BMSC 提取及培养,细胞呈现集落生长Fig.3 BMSC of rats was extracted and cultured,and the cells showed colony formation activity
2CEP 的细胞外基质分泌 CEP 通过甲苯胺蓝染色可见CEP 能够分泌细胞外基质酸性黏多糖及胶原如GAG,具有特征性多角形形态、呈铺路石样分布(图4)。
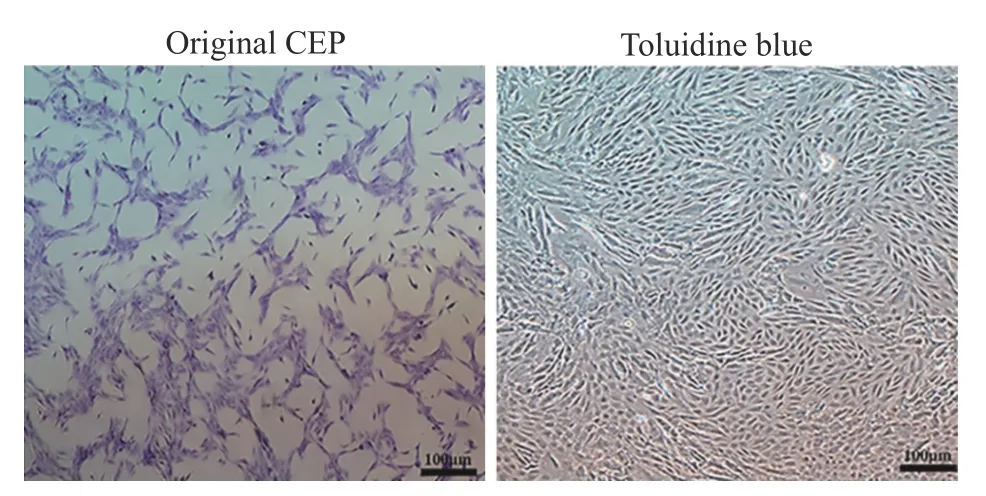
图4 大鼠CEP 培养与甲苯胺蓝染色,CEP 呈多角形或梭形,贴壁生长,细胞遮光性良好Fig.4 CEP of rats was cultured and stained with toluidine blue.The CEP was polygonal or fusiform,it grew adherently,and the cells had good shading properties
3CESC、BMSC 三系诱导分化鉴定 经过扩增后的CESC 进行成脂诱导20 d、21 d 后分别进行油红O 染色,显微镜下均可以观察到大量的红染脂滴空泡形成。CESC 经过28 d 成软骨诱导,番红染色显示CESC 染色为红色;经过扩增以后的CESC 进行成骨诱导28 d,经过茜素红染色,显微镜下均可以观察到有大量钙结节形成。BMSC 成脂诱导3 周后脂滴数量增加并相互融合,细胞由长梭形变为圆形或多边形,油红O 染色显示细胞含有丰富的脂肪颗粒;BMSC 成软骨诱导4 周,番红染色显示BMSC 染色为红色;BMSC 经成骨诱导28 d 后,局部细胞呈重叠生长,间充质逐渐堆积、间充质中矿盐沉积,形成多个结节,并逐渐融合,茜素红染色可见红色钙结节(图5)。
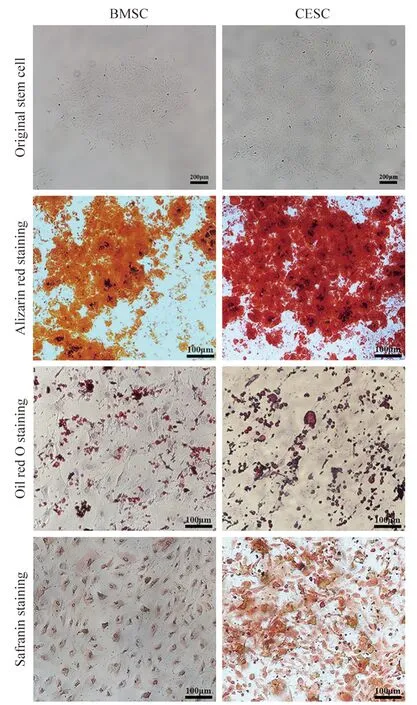
图5 CESC、BMSC 的三系诱导分化,CESC 成脂诱导后,油红O 染色可以观察到大量的红染脂滴空泡形成,成软骨诱导番红染色呈红色,成骨诱导茜素红染色观察到有大量钙结节形成;BMSC 成脂诱导后脂滴数量增加并相互融合,细胞由长梭形变为圆形或多边形,油红O 染色显示细胞含有丰富的脂肪颗粒,成软骨诱导番红染色显示BMSC 染色为红色,成骨诱导茜素红染色可见红色钙结节Fig.5 The three lines of CESC and BMSC induced differentiation.After CESC was induced into adipogenesis,a large number of red-stained lipid droplets formation could be observed by oil red O staining,the cartilage-induced safranin staining was red,and osteogenic-induced alizarin red staining showed the formation of a large number of calcium nodules.The number of lipid droplets increased and merged with each other after BMSC adipogenesis.The cells changed from a long spindle shape to a round or polygonal shape.Oil red O staining showed that the cells were rich in fat particles.Cartilage induced safranin staining showed that BMSC was stained red,and osteogenic alizarin red staining showed red calcium nodules
4三组细胞的增殖能力 CCK-8 实验结果显示,在3 d 时,CESC 组、BMSC 组及CEP 组组间有统计学差异(P<0.05),提示与CESC、BMSC、CEP共培养后促进了CEP 的增殖能力,且CESC 组增殖能力强于BMSC 组(图6)。

图6 CCK-8 检测共培养结果,在3 d 时,CESC 组和BMSC 组增殖能力均强于CEP 组,且CESC 组增殖能力强于BMSC(aP<0.05,vs CEP;bP<0.05, vs BMSC)Fig.6 CCK-8 test co-culture results showed that on the 3rd day,the proliferation ability of the CESC group and the BMSC group was stronger than that of the CEP group,and the proliferation ability of the CESC group was stronger than that of the BMSC group (aP<0.05,vs CEP;bP<0.05, vs BMSC)
5共培养对CEP 凋亡率的影响 流式结果提示,共培养7 d 后,三组细胞的凋亡率无统计学差异(图7)。
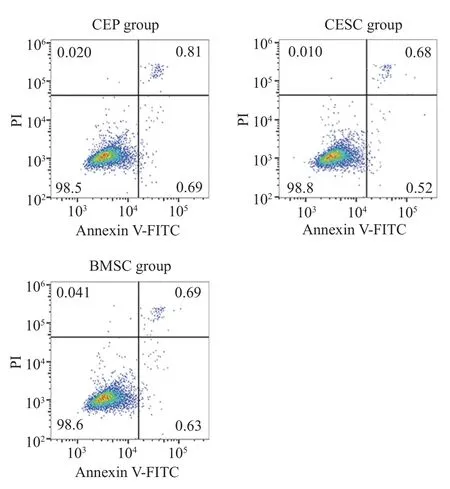
图7 流式细胞术检测,CESC 及BMSC 共培养对CEP 凋亡无影响Fig.7 Flow cytometry showed that the co-culture of CEP and BMSC had no effect on CEP apoptosis
6共培养后各组CEP 相关特异性基因的表达RT-qPCR 结果表明三组CEP 共培养1~7 d,ACAN、COLⅡ和Sox9 三种基因的表达均呈波峰状改变,3 d 表达水平最高。1 d、7 d 三组软骨表型基因ACAN、COLⅡ和Sox9 表达差异无统计学意义(P>0.05),3 d、5 d时CESC组ACAN、COLⅡ和Sox9 表达高于BMSC 组和CEP 组,差异有统计学意义(P<0.05)(图8)。
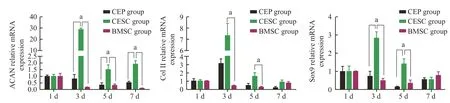
图8 共培养后各组CEP 相关特异性基因的表达情况,三组间差异有统计学意义(aP<0.05);1~ 7 d CESC 组三种基因ACAN、ColⅡ和Sox9 表达均呈波峰状改变,3 d CESC 组三种基因ACAN、ColⅡ和Sox9 表达水平最高,差异有统计学意义(P<0.05)Fig.8 After co-cultivation,the expression of CEP-related specific genes in each group was detected,and the difference between the three groups was statistically significant (aP<0.05);the expressions of the three genes ACAN,ColⅡ and Sox9 in the CESC group from 1 d to 7 d all showed peak-like changes.The expression levels of the three genes ACAN,ColⅡ and Sox9 were the highest in the CESC group at the 3 d,and the difference was statistically significant (P<0.05)
讨论
目前,以组织工程等为代表的治疗方法逐渐被人们所认知,其利用干细胞组织工程等技术手段从根本上延缓软骨终板退变[8]。既往的组织工程技术,大部分利用种子细胞的扩增和分化效应,或以细胞本身作为元件以求修复缺损组织。早在2004 年,Mizuno 等[9]采用髓核源性细胞作为种子细胞进行组织工程,再附加支架材料,实现了由修复单元新生组织与原生椎间盘组织结构类似的实验结果。在既往的椎间盘组织工程研究中,关于种子细胞的选择一直没有定论,包括髓核细胞、纤维环细胞和不同组织来源干细胞都是研究者们的研究目标[10-13]。
椎间盘终板软骨干细胞的获取,又提供了一种干细胞来源,且方法简单,能够快速大量得到种子细胞。在现阶段,对于软骨终板干细胞的研究还处于初级阶段,常献等[14]同样分离了人CESC,通过Transwell 的方式与退变的髓核细胞进行非接触式体外共培养,证实了CESC 向髓核细胞分化的功能,从一定程度上证明了CESC 作为种子细胞的潜质。早期,Liu 等[15]通过对比CESC 与BMSC 的增殖能力,证实了两者具备相同的增殖潜力。而最新的研究报道了CESC 对于髓核细胞存在调控作用,从一定程度上证明了CESC 作为种子细胞可对其他椎间盘组织部分产生积极作用[16-17]。但在目前的椎间盘组织工程技术领域中,应用较为广泛的仍是BMSC[18-20]。虽然BMSC 的获得方法也较为简单,但不同来源的干细胞分化趋向不同。早期的研究报道了CESC 具备与BMSC、髓核源性干细胞、纤维环源性干细胞相似的增殖能力和分化能力[21-22]。但并没有报道将CESC 作为种子细胞作用于CEP 的实验。因为CESC 具备较强的成骨分化能力而不是成软骨分化能力[23]。所以研究者们在对CESC 成软骨分化调控方面做出大量的研究[24]。我们认为在探究CESC 作为种子细胞潜质的同时,需同时考虑CESC 对CEP 的影响。为了更好地研究CESC 对CEP 的表型影响,同时对比BMSC 对CEP 的影响效果,本实验分离鉴定了CESC 和BMSC。
提取CESC 的方法包括差速贴壁法[21]、Fibronectin 差别筛选法[17]、琼脂糖凝胶法和单克隆法[25-26]。本实验通过单克隆法的低密度培养,从软骨终板中分离出CESC,同时按照公认的软骨细胞提取方法提取出CEP[27-29]。在获取CESC 过程中,我们发现细胞接种密度达100/cm2时,获取效率最高。骨细胞分泌的含钙基质能够被茜素红染成红色,脂肪细胞内部形成的脂肪滴能够特异性地与油红O 染色液结合而被染成鲜红色,软骨细胞所分泌的软骨基质能够被番红染成红色。利用以上的染色原理,我们对CESC 及BMSC 的多向分化能力进行了初步鉴定与比较,发现CESC 的成骨及成软骨方向分化能力要强于BMSC,而BMSC 的成脂肪分化能力要强于CESC,这也证明了CESC 良好的分化能力和应用在椎间盘组织工程中的潜力。在进行多向分化诱导后,未检测成骨、成脂肪及成软骨方向的基因变化情况,是本实验的不足之处,也是我们未来的研究方向之一。
目前的共培养体系主要包括非接触共培养及接触共培养两种。非接触式共培养的优点在于能更好地了解细胞共培养时的效应,以及能够排除其他因素的干扰。本实验采用Tanswell 小室,将不同的干细胞种在上室内,由于聚碳酸酯膜有通透性,上层培养液中的成分可以影响到下室内的细胞,从而可以研究上层培养液中的成分对细胞生长、运动等的影响[30]。这种在培养时使目标细胞间不直接接触的培养模式,可以更加清晰地分辨两种细胞之间的互相作用,也有利于探究其机制。但两种不同干细胞分别与软骨终板细胞非接触式共培养后,未进一步检测具体相关分子机制和信号通路,是本实验的不足之处,之后将对此进一步深化研究。
本实验发现,将CESC、BMSC 与CEP 进行非接触共培养后,CESC 可以促进CEP 软骨表型基因ACAN、COLⅡ、Sox9 表达,并且强于BMSC对CEP 的影响。这表明经过共培养的CESC 可增强CEP 特异性相关分子的表达,有延缓甚至逆转软骨终板退变的潜质。细胞增殖及凋亡实验发现,与CESC 及BMSC 共培养的CEP 增殖能力均增强,且CESC 对CEP 的增殖能力强于BMSC,CESC 和BMSC 对CEP 的凋亡没有影响。CESC作为椎间盘内源性干细胞,对椎间盘内环境具有天然的适应力,且CESC 在椎间盘术中容易获取,但目前无法满足自体应用的条件。因此,CESC 无法作为组织工程传统意义上的种子细胞应用于临床进行组织的退变、缺损修复,而需要与原生组织的CEP 进行共同作用[31]。
综上所述,我们发现CESC 对软骨终板原生的软骨细胞有促增殖和分化作用,在后续的研究和实验中,可以采取体内募集CESC 或诱导增强CESC 功能的方式进行椎间盘组织工程的修复,来实现我们再生修复软骨终板的最终目的,且相关的支架材料也是我们未来的重要研究方向[32-33]。鉴于此,我们认为CESC 满足作为种子细胞的必备条件,在组织工程技术修复椎间盘退变方面具有相当的潜力。
