炎症微环境中脐带干细胞外泌体对牙周膜干细胞增殖和迁移的影响
2021-08-14田萧羽赵立升廖思达
田萧羽,杨 烁,朱 彪,赵立升,李 琳,廖思达,4,温 宁
1解放军医学院,北京 100853;2 解放军总医院第一医学中心 口腔科,北京 100853;3 首都医科大学附属复兴医院 口腔科,北京 100038;4 解放军总医院 骨科研究所,北京 100853
牙周炎是一种与炎症相关的牙周支持组织受累的口腔疾病,也是造成成人缺牙的首要原因[1]。现有的治疗手段(如使用植骨材料和引导组织再生术等)引导牙周再生的能力有限[2]。因此,如何有效实现牙周再生已经成为当前牙周炎治疗的重要挑战。外泌体(exosome,Exo)是活细胞分泌的一种胞外囊泡。研究表明,外泌体具有与其来源细胞相似的生物学作用,可作为干细胞替代物用于组织再生[3]。牙周膜干细胞因扩增能力较弱、原代提取困难等因素限制了其作为外泌体来源细胞的应用。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)增殖能力强,是一种理想的组织工程种子细胞,被广泛用于多种组织的再生修复当中。在牙周再生方面,研究表明UCMSCs能够促进炎症状态下牙周软硬组织的再生[4]。而作为干细胞旁分泌主要成分,UCMSCs 来源外泌体促进牙周再生的相关研究仍缺乏。牙周膜干细胞(periodontal ligament stem cells,PDLSCs)是促进牙周再生的关键细胞。研究表明,在炎症微环境中PDLSCs 的生物活性受到抑制,是阻碍牙周再生的重要原因[5-7]。因此,本研究拟从hUCMSCs 来源外泌体在炎症微环境中对PDLSCs的调控出发,探讨其对PDLSCs 增殖和迁移能力的影响。
材料和方法
1主要材料、试剂与仪器 α-MEM 培养基(Gibco,美国);PBS(Hyclone,美国);胰酶(Sigma,美国)、Ⅰ型胶原酶(Sigma,美国);胎牛血清(Gibco,美国);成骨诱导液(赛业,中国)、成脂诱导液(赛业,中国);Dil(碧云天,中国);DAPI 染色液(碧云天,中国);4%多聚甲醛(索莱宝、中国);茜素红染液(赛业,中国);油红O 染液(Sigma,美国);Transwell 细胞小室(NEST,中国);CCK-8 试剂盒(碧云天,中国);蛋白裂解液(碧云天,中国);BCA 蛋白定量试剂盒(Thermo Fisher,美国);鼠抗人CD9 抗体(Abcam,美国);鼠抗人CD63 抗体(Abcam,美国);鼠抗人CD81抗体(Abcam,美国);TNF-α(赛业,中国);流式细胞仪(BD FACSCalibur 公司,美国);透射电镜(HITACHI,日本);超速离心机(Beckman,美国)。
2人脐带间充质干细胞来源外泌体的提取和鉴定 hUCMSCs 来源于本课题前期提取并鉴定过的细胞[8]。培养P3~ P8 代hUCMSCs,当细胞融合率达到70%~80%时,除去培养基,加入去外泌体血清的α-MEM 培养基,连续培养48 h 后,收集上清液。上清液通过300 g 离心10 min 去除死细胞,继续通过2 000 g 离心10 min,10 000 g 离心30 min 去除细胞碎片。离心后的上清用0.22 µm 滤膜过滤,通过超速离心机使用100 000 g 离心2 h,除去上清后获得hUCMSCs 来源外泌体,PBS 冲洗后重悬,通过BCA 蛋白定量试剂盒进行蛋白定量,-80℃冰箱保存备用。检测时用PBS 稀释外泌体后取10 µL 于铜网上静置5 min,之后进行磷钨酸负染染色10 min,待干燥后通过透射电子显微镜进行观察。用BCA 蛋白定量试剂盒对外泌体进行蛋白定量,对hUCMSCs 来源外泌体用Western-blot 检测鉴定其表面标记蛋白CD81、CD63、CD9。
3人牙周膜干细胞的提取和鉴定 选取解放军总医院第一医学中心口腔科患者因正畸拔除的健康前磨牙。无菌条件下用PBS 反复冲洗牙根表面,刮取根中1/3 的牙周膜组织,剪碎后用Ⅰ型胶原酶消化40~60 min,离心,去除上清,加入含10%胎牛血清的α-MEM 培养基重悬后接种于25T 培养瓶中,3~6 d 后有细胞爬出。胰酶消化细胞,接种于96 孔板中,隔天换液。7 d 后将具有克隆形成的细胞挑选出,标记为原代细胞并接种于培养瓶中,待细胞融合至80% 时,按照1∶2 比例传代。取状态良好的P3 代hPDLSCs 按照1 × 105/孔接种于6 孔板中,待细胞融合至60%~70%时去除原培养基更换为成骨诱导液或成脂诱导液,隔天换液,诱导21 d 后去除诱导液,PBS 冲洗2 次,4%多聚甲醛固定30 min 后分别进行茜素红染色和油红O 染色,染色5 min 后用PBS 洗去多余染色液于镜下观察拍照。取状态良好的P3 代细胞用流式细胞仪检测细胞的表面标志物CD90、CD73、CD29、CD105。
4hPDLSCs 对hUCMSCs 来源外泌体的摄取 收集Dil 标记后的hUCMSCs 上清,根据本文外泌体提取部分描述的方法提取外泌体,获得外泌体即为Dil 标记的外泌体。将hPDLSCs 以1 × 105/皿的密度接种于激光共聚焦培养皿,培养24 h 后加入25 µg/mL Dil 标记的外泌体,继续培养24 h 后去除原培养基,PBS 冲洗后4% 多聚甲醛固定,DAPI 染色15 min,PBS 冲洗后于激光共聚焦显微镜下观察拍照。
5CCK-8 检测外泌体对hPDLSCs 增殖的影响实验分组设置为对照组(hPDLSCs 培养于α-MEM培养基中)、炎症组[hPDLSCs 培养于添加10 ng/mL肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的α-MEM 培养基中]、炎症+不同浓度外泌体(25 µg/mL、50 µg/mL、100 µg/mL)组。先前研究表明10 ng/mL TNF-α 可以在体外实验中较好地模拟炎症微环境[9],本研究采用10 ng/mL TNF-α 构建炎症微环境,将hPDLSCs 以2×103/孔的密度接种于96 孔板中,每组设计3 个复孔连续培养,分别在0 d、1 d、3 d、5 d、7 d 按照CCK-8 试剂盒说明书加入CCK-8 液,孵育1 h 后于波长450 nm处检测分光光度值。
6细胞划痕实验检测外泌体对hPDLSCs 横向迁移的影响 实验分组设置为对照组、炎症组、炎症+不同浓度外泌体(25 µg/mL、50 µg/mL、100 µg/mL)组。将hPDLSCs 以1 × 105/孔接种于6 孔板中,待细胞融合至80%时去除原培养基更换为无血清培养基,用1 mL 枪头于孔板底划一道均匀横线,分别于0 h、24 h 后在显微镜下观察并测量划痕宽度,计算各组细胞迁移率。
7Transwell 实验检测外泌体对hPDLSCs 纵向迁移的影响 实验分组设置为对照组、炎症组、炎症+不同浓度外泌体(25 µg/mL、50 µg/mL、100 µg/mL)组。将hPDLSCs 以1×105/孔接种于6 孔Transwell板上室,按照分组在下室加入无血清培养基、TNF-α 及不同浓度外泌体(25 µg/mL、50 µg/mL、100 µg/mL)。24 h 后DAPI 染液染色,使用棉签擦除上室中未迁移的细胞,于荧光显微镜下观察细胞穿过情况,计算细胞透过率。
8统计学方法 采用SPSS19.0 软件进行分析,数据以表示,组间比较采用单因素方差分析,两两比较采用LSD 检验。P<0.05 为差异有统计学意义。
结果
1hUCMSCs 来源外泌体的提取及鉴定 磷钨酸溶液负染后于透射电子显微镜(TEM)下观察外泌体形态,可见外泌体呈直径约100 nm 的圆形或椭圆形结构,包膜完整(图1A);Western-blot 检测到外泌体表面蛋白CD81、CD63、CD9 表达阳性(图1B)。以上结果表明成功获取外泌体。
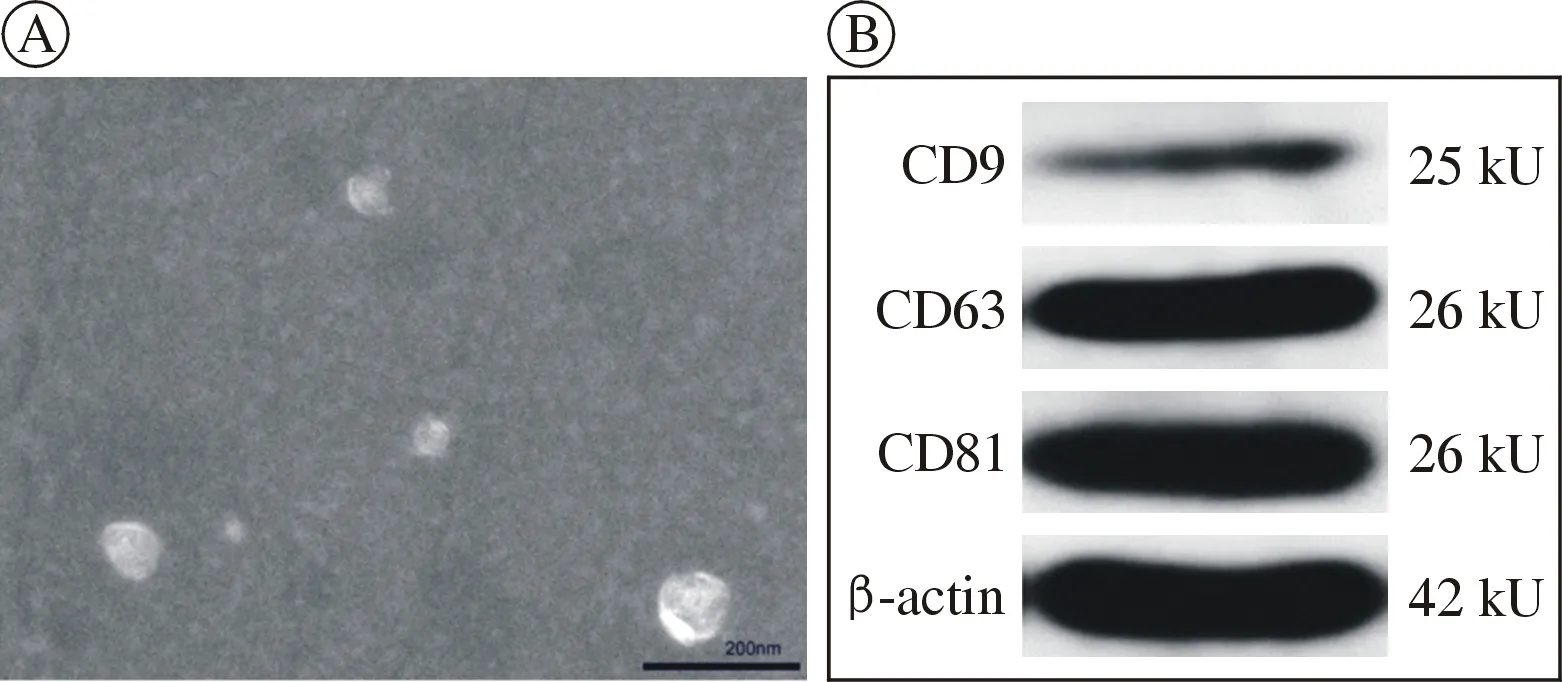
图1 hUCMSCs 来源外泌体的鉴定 A:透射电子显微镜下结果;B:Western-blot 检测外泌体相关蛋白CD9、CD63、CD81Fig.1 Identification of exosomes derived from hUCMSCs A:TEM results;B:Results of exosome surface proteins CD9,CD63 and CD81 were detected by Western-blot
2hPDLSCs 的分离及鉴定 于显微镜下观察提取的hPDLSCs,可见细胞贴壁呈螺旋状生长,形状呈长条状或纺锤状,生长迅速(图2A/B)。流式细胞仪结果显示(图2C):阳性表达间充质干细胞表面标志物CD90(99.10%)、CD73(97.96%)、CD29(98.8%)、CD105(97.64%),阴性表达造血干细胞表面标志物CD31(2.84%)、CD34(1.74%)。以上结果表明hPDLSCs 分离培养成功。

图2 hPDLSCs 的培养与鉴定 A:P0 代培养的hPDLSCs 形态观察;B:P3 代培养的hPDLSCs 形态观察 C:hPDLSCs 表面标志物鉴定Fig.2 Identification of hPDLSCs A:Morphological observation of hPDLSCs cultured in P0 generation;B:Morphological observation of hPDLSCs cultured in P3 generation;C:Identification of surface markers of hPDLSCs
3hPDLSCs 对hUCMSCs 来源外泌体的摄取 将外泌体与hPDLSCs 共培养24 h 后,激光共聚焦显微镜观察可见,蓝色标记的hPDLSCs 细胞核附近出现红色荧光,表明外泌体与hPDLSCs 共培养后被hPDLSCs 成功摄取,且分布在细胞核周围(图3)。

图3 hPDLSCs 细胞对hUCMSCs 来源外泌体的摄取观察 (蓝色为hPDLSCs 细胞核,红色为外泌体)Fig.3 Observation on the uptake of exosomes derived from hUCMSCs by hPDLSCs (hPDLSCs nuclei are shown in blue and exosomes are shown in red)
4hUCMSCs 来源外泌体在炎症微环境中对hPDLSCs 增殖的影响 通过CCK-8 实验检测在炎症微环境中不同浓度外泌体对hPDLSCs 增殖的影响。结果显示,在0~1 d 各组之间的细胞增殖情况无统计学差异(P>0.05)。在3~7 d,TNF-α 的加入促进了细胞的增殖,TNF-α 组与对照组相比细胞增殖明显(P<0.05)。在3 d,与TNF-α 组相比,TNF-α+25 µg/mL 外泌体组和TNF-α+50 µg/mL 外泌体组均无明显促增殖作用(P>0.05),但TNF-α +100 µg/mL 显著促进细胞增殖(P<0.05)。在5~7 d,与TNF-α 组相比,TNF-α+外泌体组均具有明显的促增殖作用且呈浓度依赖性(P<0.05),其中TNF-α+100 µg/mL 外泌体组促增殖作用最佳(图4)。
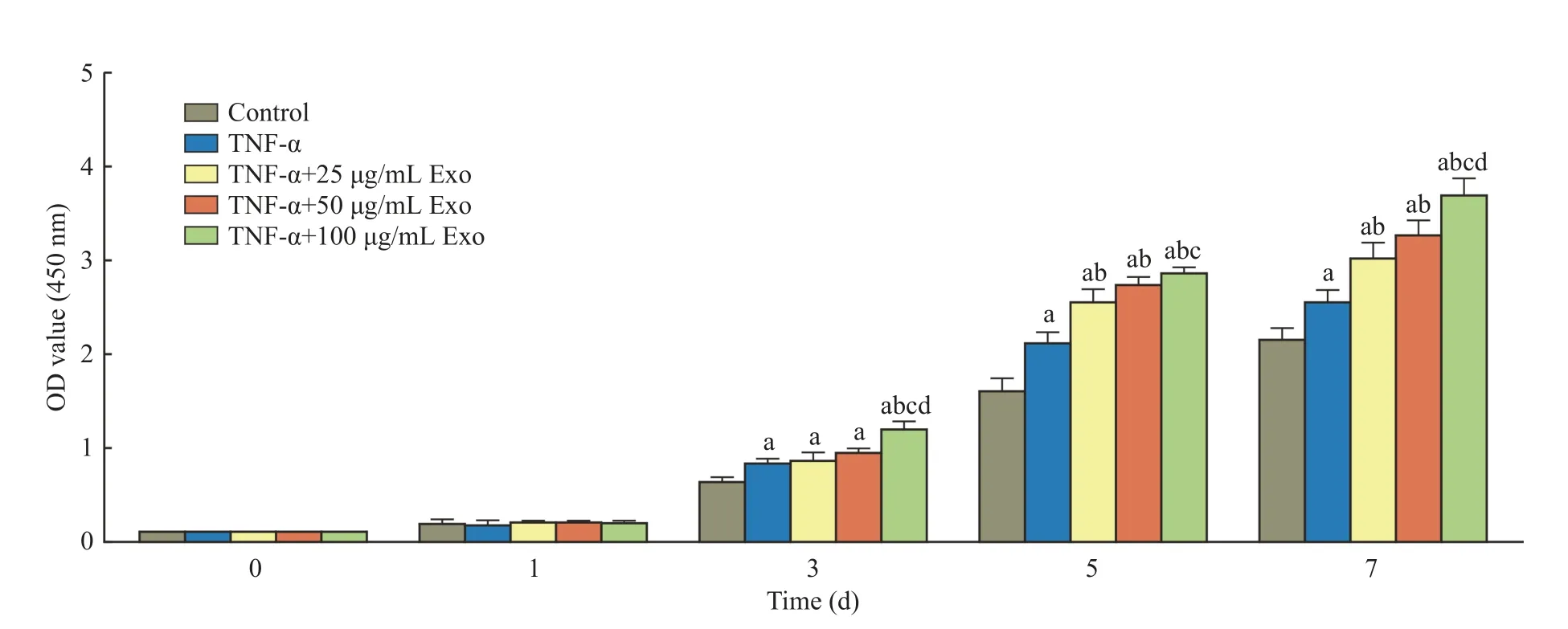
图4 hUCMSCs 来源外泌体在炎症微环境中对hPDLSCs 增殖的影响 (aP<0.05,vs control;bP<0.05,vs TNF-α;cP<0.05,vs TNF-α +25 µg/mL Exo;dP<0.05,vs TNF-α+50 µg/mL Exo)Fig.4 Effects of exosomes derived from hUCMSCs on hPDLSCs proliferation in the inflammatory microenvironment (aP<0.05,vs control;bP<0.05,vs TNF-α;cP<0.05,vs TNF-α+25 µg/mL Exo;dP<0.05,vs TNF-α+50 µg/mL Exo)
5hUCMSCs 来源外泌体在炎症微环境中对hPDLSCs 横向迁移的影响 划痕实验显示,在加入TNF-α 及不同浓度外泌体24 h 后,细胞发生了不同程度的横向迁移。其中TNF-α 组与对照组相比,迁移程度无统计学差异(P>0.05),表明加入TNF-α 未明显促进细胞的横向迁移。在TNF-α 培养条件下,TNF-α+外泌体组与TNF-α 组迁移程度差异有统计学意义(P<0.05),且外泌体浓度越高,细胞迁移程度越明显(P<0.05),证明在炎症微环境下hUCMSCs 来源外泌体以浓度依赖的方式促进了hPDLSCs 的横向迁移。见图5。

图5 hUCMSCs 来源外泌体对hPDLSCs 横向迁移的影响 A:划痕实验镜下观察 B:划痕实验定量结果(aP<0.05,vs control group;bP<0.05,vs TNF-α group;cP<0.05,vs TNF-α+25 µg/mL Exo group;dP<0.05,vs TNF-α+50 µg/mL Exo group)Fig.5 Effect of exosomes from hUCMSCs on lateral migration of hPDLSCs A:Observation under the microscope of the scratch test;B:Quantitative results of the scratch test (aP<0.05,vs control group;bP<0.05,vs TNF-α group;cP<0.05,vs TNF-α+25 µg/mL Exo group;dP<0.05,vs TNF-α+50 µg/mL Exo group)
6hUCMSCs 来源外泌体在炎症微环境中对hPDLSCs 纵向迁移的影响 Transwell 实验结果显示,荧光显微镜下可见对照组发生纵向迁移细胞量最少,加入TNF-α 后,纵向迁移细胞数目增加(P<0.05)。与25 µg/mL 和50 µg/mL 外泌体组相比,100 µg/mL 外泌体组促迁移作用最为明显(P<0.05)。Transwell 实验表明hUCMSCs 来源外泌体促进了炎症微环境下hPDLSCs 的纵向迁移。见图6。

图6 hUCMSCs 来源外泌体对hPDLSCs 纵向迁移的影响 A:Transwell 实验镜下观察;B:Transwell 实验定量结果(aP<0.05,vs control group;bP<0.05,vs TNF-α group;cP<0.05,vs TNF-α+25 µg/ mL Exo group;dP<0.05,vs TNF-α+50 µg/ mL Exo group)Fig.6 Influence of exosome from hUCMSCs on longitudinal migration of hPDLSCs A:Observation under the microscope of Transwell test;B:Quantitative results of Transwell test (aP<0.05,vs control group;bP<0.05,vs TNF-α group;cP<0.05,vs TNF-α+25 µg/ mL Exo group;dP<0.05,vs TNF-α+50 µg/ mL Exo group)
讨论
间充质干细胞来源外泌体是间充质干细胞发挥生物学功能的重要途径,与间充质干细胞相比,外泌体无伦理学限制,无免疫排斥反应,无突变致瘤风险,在使用过程中不易阻塞血管且易于保存[10],因此,近年来外泌体作为干细胞的替代物,越来越多应用于再生医学领域[11]。
hUCMSCs 因具有取材无创、便于体外分离培养等优势,成为外泌体的理想来源。多项研究已表明,hUCMSCs 来源外泌体在治疗脑卒中[11]、皮肤损伤[12]、脑损伤等疾病时均展现出了广阔的应用前景。这为hUCMSCs 来源外泌体应用于牙周再生提供了潜在的可能。目前已经有不少研究探究外泌体对hPDLSCs 的影响,但关注于炎症微环境中外泌体对hPDLSCs 影响的研究还很缺乏,炎症微环境中外泌体对hPDLSCs 是否有促增殖促迁移作用尚不明确。
本研究通过超速离心法成功提取hUCMSCs外泌体,透射电镜下观察外泌体为直径约100 nm的椭圆形,阳性表达特异性表面标志物CD9、CD63、CD81,提取结果与Hu 等[13]和Zhao 等[14]的结果相似。通过酶解法提取hPDLSCs,细胞呈长梭形,阳性表达间充质干细胞表面标志物CD90、CD73、CD29、CD105,阴性表达造血干细胞表面标志物CD31、CD34,符合hPDLSCs 特征[15]。
本研究发现在炎症微环境中hUCMSCs 来源外泌体可以为hPDLSCs 所摄取,在24 h 后可以在hPDLSCs 细胞核周围检测到大量红色荧光,这与Li 等[16]研究显示的共培养24 h 后荧光信号强烈一致,为后续实验奠定了基础。
本研究外泌体浓度为25 µg/mL、50 µg/mL 和100 µg/mL。在现有研究中,外泌体的浓度不尽相同。Wang 等[17]研究发现人脱落乳牙来源外泌体促 进hPDLSCs 增殖的起效浓度为25 µg/mL;Zhao 等[18]的研究显示,人羊膜干细胞来源的外泌体(浓度为25 µg/mL、50 µg/mL、100 µg/mL)可以促进成纤维细胞的增殖与迁移且呈浓度依赖方式。CCK-8 实验的观察时间为3 d~7 d,与细胞种类、接种密度、实验设计等多因素相关。本研究中观察时间设定为7 d,有助于阐明在较长时间范围内外泌体对hPDLSCs 增殖的影响,与现有相关研究时间设定一致[19]。本研究CCK-8 结果表明在炎症微环境中0~ 1 d 外泌体促增殖效果不明显,共培养3 d 后外泌体可以显著促进hPDLSCs 的增殖,且呈剂量依赖性。外泌体的促增殖作用已经在很多研究中得到证实[20]。本研究在此基础上证明在炎症微环境中外泌体仍具有显著的促增殖作用,但其机制尚不明确。Lv 等[21]通过体外实验提示这种促增殖作用可能通过促进DNA 合成及加速细胞周期来实现的,但相关机制还需进一步研究。
本研究证实hUCMSCs 来源外泌体在炎症微环境中可以促进hPDLSCs 迁移,包括横向迁移和纵向迁移,其促迁移作用随外泌体浓度升高而增强。现已有多项研究表明外泌体可以促进成纤维细胞、血管内皮细胞等多种细胞的迁移活动[22-23],但在炎症微环境下外泌体是否具有相同作用还缺乏相关研究。本研究证明在炎症微环境下外泌体同样具有促迁移作用。
综上,本研究证明了hUCMSCs 来源外泌体在体外炎症微环境中可以促进hPDLSCs 增殖和迁移,但对相关机制缺乏深入了解,在体内实验中hUCMSCs 来源外泌体能否促进hPDLSCs 的增殖和迁移进而促进牙周再生还需要后续研究。
