聚乙二醇改性聚乳酸神经导管修复大鼠坐骨神经缺损
2021-08-14史振伟黄转青程晓清王聪聪许文静徐风华
罗 东,史振伟,王 玉,孙 琦,黄转青,程晓清,马 玥,杨 飞,张 莹,王聪聪,许文静,徐风华
1 解放军医学院,北京 100853;2 解放军总医院医疗保障中心 药剂科药学基础研究室,北京 100853;3 解放军总医院 骨科研究所,北京 100853
周围神经损伤(peripheral nerves injury,PNI)会导致受支配区域感觉和运动功能障碍,甚至导致终身残疾,严重影响患者的生活质量,其临床常见体征和症状有麻木、刺痛、搏动、灼热、剧烈疼痛等[1-2]。目前,自体神经移植仍是临床治疗周围神经损伤的首选方法,同时也是研究其替代治疗措施的“金标准”[3]。但自体神经来源有限,且存在增加创伤、遗留供区感觉障碍、神经束支对合及匹配不佳等缺点[4]。为了满足大间隙修复的临床需求,解决自体神经移植的限制,基于组织工程的神经引导导管(nerve guidance conduit,NGC)开始发展起来,该方法通过植入天然、合成或半合成生物材料的NGC 来治疗周围神经缺损[5-6]。聚乳酸(poly lactic acid,PLA) 具有良好的生物相容性、良好的生物降解性和热塑性,其在神经再生组织工程中的应用引起了人们的极大关注[7]。但其代谢中间产物乳酸在局部堆积会导致局部pH 值下降,同时其亲水性差,细胞吸附率低,不利于细胞表面黏附,这都会影响神经损伤的修复再生。研究表明,细胞外酸性pH 可刺激巨噬细胞NLRP3 炎性小体活化和IL-1β 分泌,周围神经损伤常伴随局部酸中毒、缺血和炎症,而局部酸中毒又会进一步促进缺血和炎症的发生[8-9]。聚乙二醇(polyethylene glycol,PEG) 是一种常见的醇类水凝胶材料,在神经再生领域也有广泛应用[10]。用聚乙二醇制备的水凝胶有着良好的亲水性和生物相容性,其分子链含有羟基和醚键,因此能与含羧基、羟基的水溶性分子通过分子间的氢键形成网络结构[11-12]。本研究利用PEG 改善PLA 导管亲水性能,诱导免疫耐受,减轻免疫反应,同时防止PLA 中间降解产物乳酸在导管内聚集,维持神经再生局部微环境稳定,探讨其作为神经修复支架的可能性。
材料与方法
1试剂及仪器 聚乳酸(η=0.8 dL/g,相对分子质量1×105,山东省医疗器械研究所);二氯甲烷(国药化学试剂有限公司);PEG3000(Fluka 公司);丙烯酰氯(TCI 公司);三乙胺(Sigma-Aldrich);带线缝合针(上海浦东金环医疗用品公司);甲苯胺蓝染料(北京化学试剂有限公司),小鼠来源NF200 单克隆抗体(Sigma-Aldrich 公司),山羊抗小鼠IgG/Alexa Fluor®488(Abcam 公司),兔来源抗S100 多克隆抗体(Sigma-Aldrich 公司),山羊抗兔IgG/Alexa Fluor®594(Abcam 公司),兔来源抗CD31 多克隆抗体(Servicebio 公司),山羊抗小鼠CY3(Servicebio公司),山羊抗兔IgG/Alexa Fluor®488(Servicebio公司),DAPI 染色剂(北京百奥科技有限公司);RSC96 细胞(上海雅吉生物有限公司)。SU-8200 型扫描电子显微镜(日立公司);SHY-2A 型水浴恒温振荡器(江苏金坛国胜实验仪器厂);Catwalk XT 10.5 小动物步态分析仪(Noldus 公司);RM2016 病理切片机(上海徕卡仪器有限公司);JB-P5 型包埋机(武汉俊杰电子有限公司);Donatello 脱水机(DIAPATH 公 司);ECLIPSE C1 型荧光显微镜(Nikon 公司);108 AUTO/SE 型离子溅射仪(广州竞赢化工科技有限公司)。
2实验动物 健康雄性Sprague-Dawley(SD)大鼠30 只,10 周龄,体质量250~300 g,用于构建大鼠坐骨神经10 mm 缺损动物模型,由斯贝福(北京) 生物技术有限公司提供,许可证号:SCXK(京)2019-0010,经过解放军总医院实验动物管理和使用委员会批准,严格执行动物实验程序,饲养于自动供应食水、12 h 光照/黑暗循环条件的塑料鼠笼中。
3PLA 神经导管的制备 采用溶剂挥发法制备PLA 导管。称取20 mg 聚乙二醇溶于1 mL 二氯甲烷中,搅拌均匀后加入280 mg 聚乳酸,再次搅拌均匀。将不锈钢模具(直径1.5 mm、长80 mm)垂直浸入溶液30 s 后提出,室温放置,待溶剂挥发后,从不锈钢模具上取下,制备成内径1.5 mm、壁厚0.2 mm、长14 mm 的PLA 导管。封装后经γ 射线辐射灭菌,4℃保存备用。
4PEGDA 的合成 称取3 g PEG3000 于反应器中,加入20 mL 甲苯搅拌使PEG3000 完全溶解,密封,通入氮气保护。向其中滴加555 µL 三乙胺和325 µL 丙烯酰氯,38℃水浴,搅拌过夜。将反应液过滤,滤液用50 mL 的4℃冷乙醚重结晶。滤饼在38℃水浴溶解后,冷却至室温,再用50 mL 的4℃冷乙醚重结晶2 次。将滤饼常温避光干燥24 h,得到白色产物,避光-20℃保存。
5PEG-PLA 神经导管的制备 称取PEGDA 0.5 g溶于1 mL 纯净水中,待完全溶解后,再向其中加入100 µL 的APS 溶液(50 mg/mL)和50 µL 的TEMED溶液(20%,pH 7.4),反应30 s,用移液枪将尚未完全胶凝的溶液垂直注入PLA 导管,旋转PLA 导管,使溶液在管壁均匀分布。干燥24 h。PBS 洗3 次,每次5 min。封装后经γ 射线辐射灭菌,4℃保存备用。
6扫描电镜观察导管的结构和形态 将PLA 神经导管和PEG-PLA 神经导管沿矢状位切开,修剪成矩形小块,将两种移植物的内外侧分别用导电胶固定于SU82000 型扫描电镜的标本金属底座上,108 AUTO/SE 型离子溅射仪中氩气填充密闭条件下喷金。将固定有标本的金属底座移至显微镜扫描电镜内,调整坐标及焦距,真空条件下5 kV电压对标本进行检测并记录照片。
7细胞毒性评价将单纯PLA 和PEG-PLA 神经导管分别放入含有体积分数10% 胎牛血清的DMEM 培养基中,置于37℃、5% CO2的培养箱中培养48 h,弃去导管,得到预处理的DMEM 培养基。设置Control 组(未处理的DMEM 培养基)、PEG-PLA 组(PEG-PLA 预处理DMEM 培养基)和PLA 组(PLA 预处理DMEM 培养基),每组5 个复孔,将生长至对数培养期的RSC96 细胞以2.5 × 105/mL 的浓度接种于60Co 消毒的96 孔板中,每孔200 µL 细胞悬液,于5% CO2、37℃恒温培养箱中培养。过夜,待细胞贴壁后,更换为上述对应培养基,培养1 d、3 d 和5 d。于各检测时间点向每孔加入20 µL 的CCK-8 溶液,37℃孵育1 h 后,将96 孔板置于微量孔板分光光度计中,测定各孔在450 nm 处的吸光度值。
8动物分组及实验方法 SD 大鼠30 只随机分为自体神经移植组(ANG)、聚乙二醇改性聚乳酸神经导管组(PEG-PLA)、聚乳酸神经导管组(PLA),每组10 只。电子天平称量SD 大鼠体质量,3%戊巴比妥钠(30 mg/kg 体质量)进行麻醉。角膜反射确定麻醉可靠后于大鼠右后肢备皮,常规消毒铺巾。取右后肢后外侧纵行切口,长约2.5 cm,逐层切开皮肤、皮下、肌层,暴露坐骨神经,直尺测量下切除7 mm 坐骨神经,坐骨神经断端回缩,最终形成10 mm 坐骨神经缺损,以8-0带针缝合线分别在坐骨神经近、远端桥接缝合移植物,确认桥接物缝合可靠,0.9%氯化钠注射液冲洗术区,止血充分后以3-0 手术缝合线逐层缝合肌层和皮肤,碘伏消毒切口后等待麻醉苏醒。麻醉苏醒后按分组分笼饲养于自动供应食水、12 h光照/黑暗循环条件的塑料鼠笼中。
9再生神经免疫荧光染色 术后第2 周每组随机选取5 只大鼠腹腔注射过量3%戊巴比妥钠处死,充分暴露并完整切取再生神经。切取的移植段再生神经行10 µm 厚纵行冰冻切片,冰冻丙酮固定15 min,PBS 洗3 遍,每遍5 min。然后置于含10%山羊血清的PBS 中,在室温条件下阻断非特异性抗原2 h。切片用小鼠来源抗NF200 单克隆抗体(与PBS 按1∶200 稀释)和兔来源抗S100 多克隆抗体(与PBS 按1∶200 稀释) 作为一抗在4°C湿盒中孵育过夜。第2 天,去除多余一抗,切片用PBS 洗3 遍,每遍5 min,然后用山羊抗小鼠IgG/Alexa Fluor®488(与PBS 按1∶200 稀释)和山羊抗兔IgG/Alexa Fluor®594(与PBS 按1∶200 稀释)作为二抗在常温避光条件下孵育1 h。去除多余二抗后,PBS 洗3 遍,每遍5 min,切片再用DAPI 工作液常温避光条件下孵育5 min,蒸馏水清洗后水性封片剂封片。术后第12 周每组大鼠坐骨神经取材后行CD31/NF200 免疫荧光染色。
10大鼠运动功能恢复评价 术后4 周、8 周和12 周(每组5 只大鼠)中,使用Catwalk 步态分析系统评估运动功能的恢复。将大鼠放在走道板上,让其向前走。当脚趾接触踩踏表面时,将显示实时运动图像和3D 足迹。从每组的足迹中测量脚趾的长度和宽度以及静态坐骨神经功能指数(sciatic nerve function index,SFI)。SFI=0 表示运动功能正常,SFI=-100 表示运动功能完全损伤。
11大鼠腓肠肌湿重分析和组织学评价 术后12 周,各组大鼠腹腔注射过量3%戊巴比妥钠处死,取材各组大鼠双侧腓肠肌,立即称重以术侧腓肠肌与正常侧腓肠肌湿重的比值进行标准化,所得数据用于计算腓肠肌湿重恢复率;然后取腓肠肌肌腹用4%多聚甲醛固定2 h,石蜡包埋并行腓肠肌肌腹横断面10µm 厚石蜡切片。切片常规脱蜡复水,以改良Masson 染色试剂盒进行染色,常规脱水、透明、封片。每组随机选取5 个视野,测量腓肠肌纤维平均横截面积。
12统计学方法 统计分析使用SPSS23.0 软件进行,计量资料以表示,组间比较采用方差分析,两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
结果
1PEG-PLA 神经导管扫描电镜下形态 扫描电镜照片显示新制备的PEG-PLA 神经导管外壁质地紧密,无微孔(图1A)。而其内壁有质地疏松,呈轴向取向性的排列整齐的纹路(图1B)。而PLA 神经导管内外壁均为致密无微孔的结构(图1C)。

图1 PEG-PLA 和PLA 神经导管电镜 A:PEG-PLA 和PLA 神经导管外壁;B:PEG-PLA 神经导管内壁;C:PLA 神经导管内壁Fig.1 Scanning electron microscope of PEG-PLA nerve conduit A:PEG-PLA and PLA nerve conduit outer wall;B:PEG-PLA nerve conduit inner wall;C:PLA nerve conduit inner wall
2神经导管材料对RSC96 细胞增殖的影响 各组1 d、3 d、5 d 时在450 nm 处的吸光度值(OD value)无统计学差异(P>0.05),未处理的DMEM培养基培养的RSC96 细胞(对照组) 与PLA 神经导管预处理组和PEG-PLA 神经导管预处理组的细胞增殖差异无统计学意义(P>0.05),表明PEGPLA 神经导管预处理的RSC96 细胞可以正常增殖。见表1。
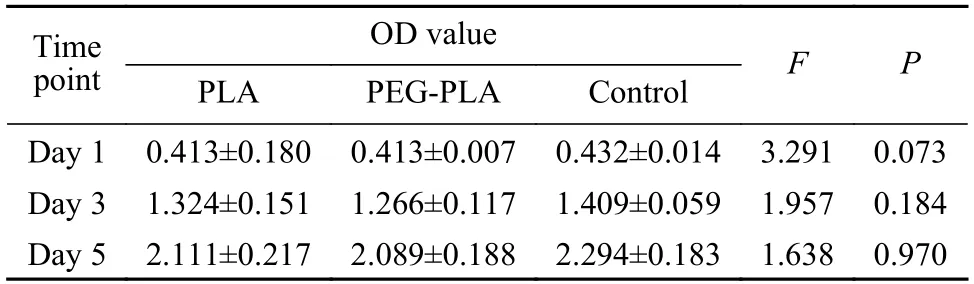
表1 神经导管材料对RSC96 细胞增殖的影响(n=5)Tab.1 Effect of nerve conduit on the proliferation of RSC96 cells in the three groups (n=5)
3大鼠运动功能恢复评价 Catwalk 步态分析提示,术后12 周,PEG-PLA 组的足趾分离程度较PLA 组明显改善,接近自体神经移植组(图2)。各组手术侧足趾(右侧)与地面的接触面积均较正常侧(左侧)减小。同时可见各组大鼠伤侧后足(右后足,RH) 受力重心均有不同程度后移,其中PLA 组RH 足印不明显,足跟部受力面积增加,重心后移程度大于PEG-PLA 组和ANG 组。PEGPLA 组大鼠RH 足趾宽度及中间足趾宽度均较对侧减小,而足印长度加大,且足趾受力强度较对侧(LH) 明显降低。而ANG 组大鼠RH 足趾宽度及中间足趾宽度接近对侧(LH),足印长度亦无明显加大,足趾受力强度略低于对侧(LH)。三组术后4 周SFI 均接近-100,表明术后神经功能恶化。随着神经再生,单纯PLA 组和PEG-PLA 组在第8 周和第12 周SFI 有所提高,但均明显低于ANG组,单纯PLA 组低于PEG-PLA 组,差异无统计学意义(P>0.05)。见图3。
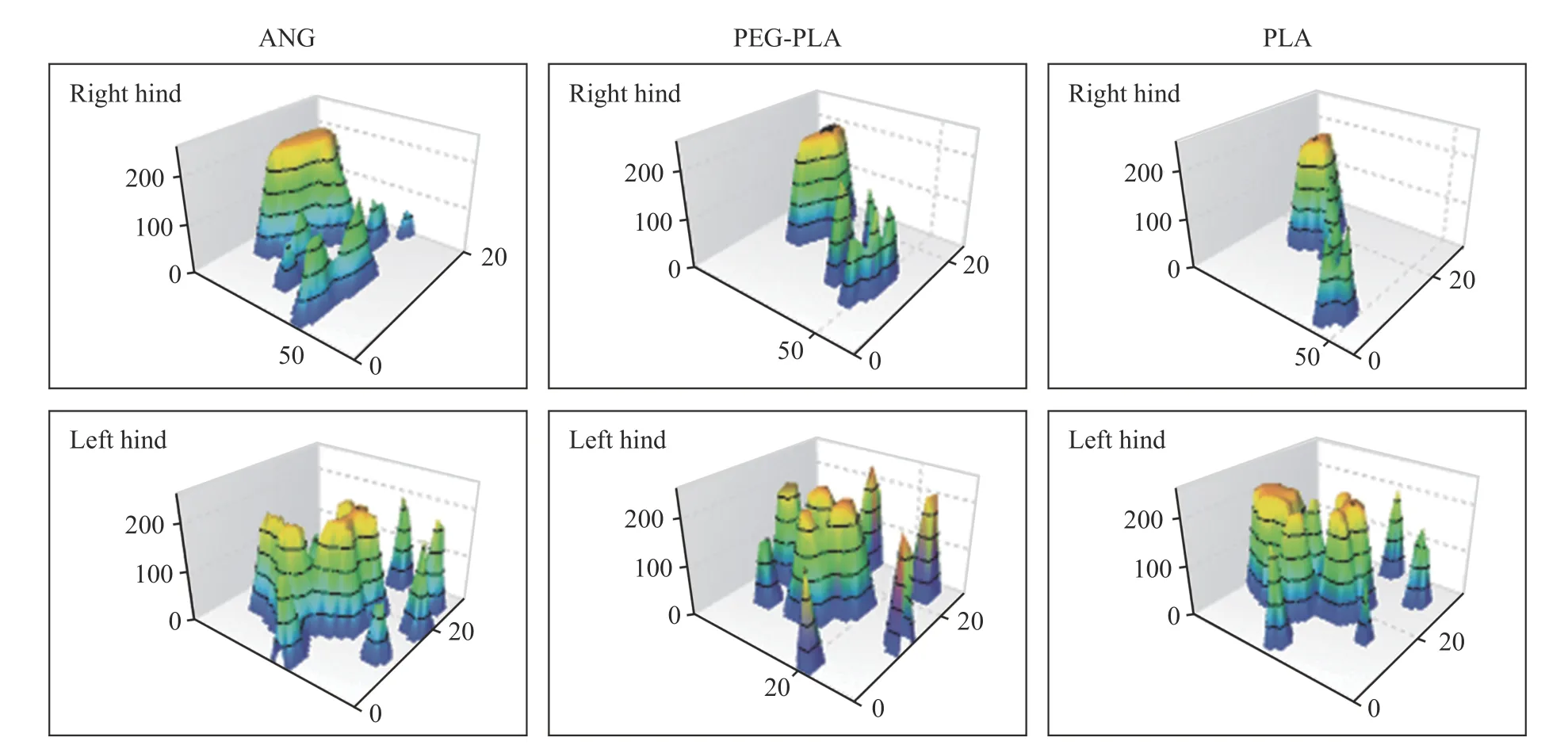
图2 术后12 周各组大鼠3D 步态足印Fig.2 At 12 weeks after operation,the 3D gait footprints of rats in each group were observed
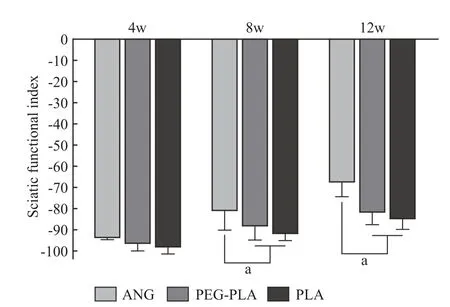
图3 术后4 周、8 周、12 周各组坐骨神经功能指数(aP<0.05)Fig.3 Sciatic nerve function index of each group at 4,8 and 12 weeks after surgery (aP<0.05)
4腓肠肌肌肉湿重恢复率 各组术侧与健侧腓肠肌大体观对比图(图4)可见,单纯PLA 组和PEGPLA 组术侧肌肉萎缩严重,与健侧差距明显;PEGPLA 组术侧与健侧间差距接近ANG 组。腓肠肌肌肉湿重恢复率由高到低依次为ANG 组(51.08±8.68)%、PEG-PLA组(31.74±6.56)%、PLA组(18.96±2.75)%,各组间差异均有统计学意义(P<0.05)(图5 左)。
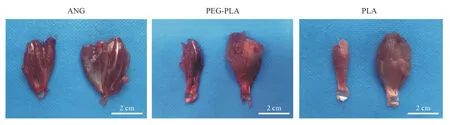
图4 术后12 周大鼠腓肠肌大体观Fig.4 Gross view of gastrocnemius muscle in rats at 12 weeks after surgery
5腓肠肌肌 纤维 横截面积 Masson 染色 可见PLA 组术侧腓肠肌肌纤维纤细,排列不规则,且红染的肌纤维间有大量的蓝染胶原纤维,横截面积明显小于其他两组;PEG-PLA 组和ANG 组腓肠肌肌纤维形态排列较为规整,但PEG-PLA 组横截面积小于ANG 组(图6)。数据统计显示各组腓肠肌肌纤维横截面积由高到低依次为(图5 右)。
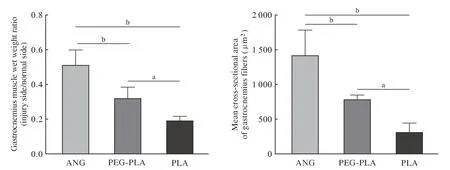
图5 腓肠肌湿重恢复率(左)和腓肠肌肌纤维横截面积(右)(aP<0.05;bP<0.01)Fig.5 Gastrocnemius muscle wet weight ratio (left) and mean cross-sectional area of gastrocnemius muscle fiber (right) (aP<0.05;bP<0.01)
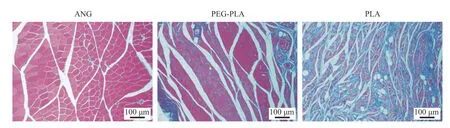
图6 术后12 周大鼠腓肠肌肌肉横截面Masson 染色Fig.6 Masson staining of cross section of gastrocnemius muscle in rats at 12 weeks after operation
6术后移植段神经组织免疫荧光染色 术后2 周移植段神经免疫荧光染色可见NF200 阳性的再生神经纤维被标记为绿色荧光,S100 阳性的施万细胞被标记为红色荧光。虽然两组神经再生效果都低于ANG 组,但仍可见PEG-PLA 组的神经再生效果优于单纯PLA 组。表明聚乙二醇改性聚乳酸神经导管改善了单纯PLA 导管的神经修复效果(图7)。术后12 周各组大鼠移植段中段端再生神经的横断面CD31/NF200 免疫荧光染色结果:NF200阳性的再生神经纤维被标记为红色荧光,CD31 阳性的血管内皮细胞被标记为绿色荧光。PEGPLA 组的神经纤维密度以及血管内皮细胞的密度明显高于PLA 组,接近ANG 组。其中,PEG-PLA组ANG 组的血管化程度接近,但三组再生神经纤维的数量却有所不同,从高到低依次为ANG 组、PEG-PLA 组、PLA 组(图8)。
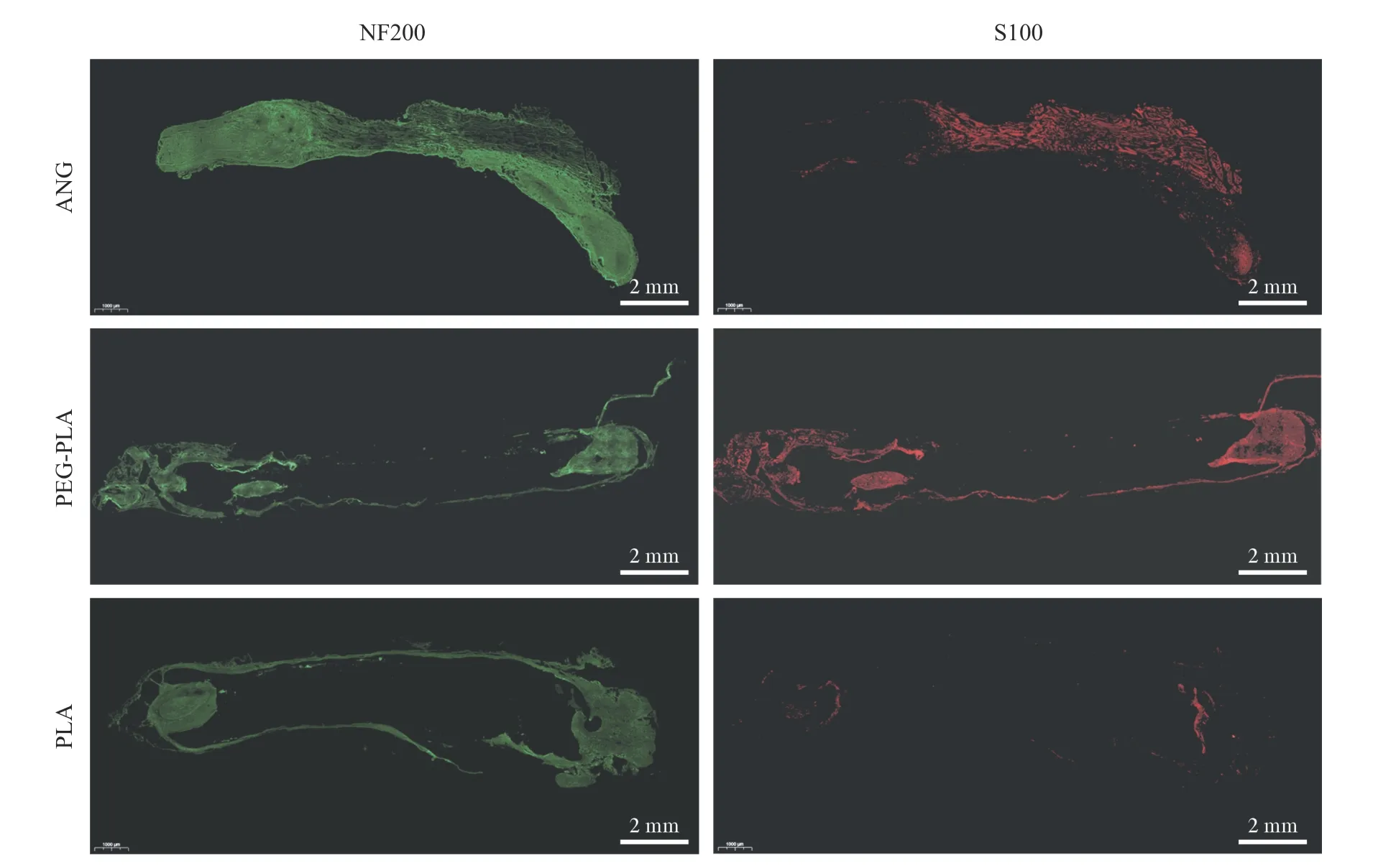
图7 术后2 周各组移植段再生神经的免疫荧光染色Fig.7 Results of immunofluorescence staining of regenerated nerve in each group at 2 weeks after surgery
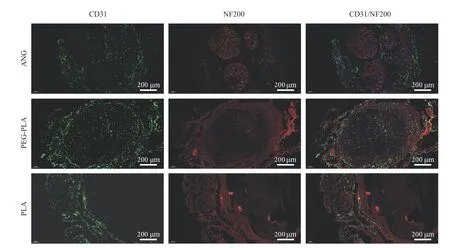
图8 术后12 周,各组移植段再生神经中段的免疫荧光染色结果。免疫荧光染色可见NF200 阳性的再生神经纤维被标记为红色荧光,CD31 阳性的血管内皮细胞被标记为绿色荧光Fig.8 Immunofluorescence staining results of the middle segment of regenerated nerve in each group at 12 weeks after operation.Immunofluorescence staining showed that NF200-positive regenerated nerve fibers were marked with red fluorescence and CD31-positive vascular endothelial cells were labeled with green fluorescence
讨论
随着社会的发展,各类交通事故和建筑事故高发,使得周围神经损伤在临床上越来越普遍,周围神经的再生速度缓慢,且损伤后效应器和感受器的功能迅速丧失,这种功能丧失往往会随着神经损伤修复时间的延长而最终不可逆转。周围神经损伤一直是临床上的“世界性难题”[13]。
周围神经损伤发生后短时间内就会发生瓦勒氏变性,由于神经纤维的连续性被中断,神经元轴突断裂,血运循环障碍,导致损伤平面营养代谢障碍,损伤部位远端神经纤维最终发生溃变[14]。同时施万细胞经蛋白酶途径降解髓鞘蛋白,神经纤维脱髓鞘,大量巨噬细胞通过血管聚集到神经损伤部位,与施万细胞吞噬变性髓鞘的碎片,引发炎症反应[15]。巨噬细胞在这一时期一方面由于吞噬作用产生了大量炎性因子,促进炎症发生,另一方面分泌活性因子将促进施万细胞的增殖,加快了早期变性髓鞘的清除[16]。另外神经损伤后血-神经屏障被破坏,神经相关性抗原经附近淋巴结产生特异性抗体,这些抗体最终进入血液循环引起免疫反应[17]。而炎症反应和免疫反应在早期都不利于神经再生修复。
聚乳酸是目前周围神经组织工程应用最广泛的一种可降解材料[18]。但其亲水性差,聚乙二醇是一种常见的醇类水凝胶材料,用聚乙二醇制备的水凝胶在有着良好的亲水性和生物相容性[13]。
用聚乙二醇改性PLA 神经导管,改善PLA 神经导管的亲水性,提高PLA 的生物相容性,有利于细胞表面黏附。PEG 水凝胶减少了PLA 的降解中间产物乳酸与神经再生微环境的接触,维持了神经再生微环境的稳定。用聚乙二醇修饰材料可以减少材料对体内补体系统的活化,诱导抗原特异性免疫耐受同时聚乙二醇有稳定蛋白的作用[19]。聚乙二醇还有促进周围神经损伤修复再生的潜力[20]。
本研究利用溶剂挥发法制备PLA 神经导管支架,并用聚乙二醇双丙烯酸酯(PEGDA)通过化学交联的方式在导管内壁形成PEG 水凝胶,构建聚乙二醇改性聚乳酸神经导管,并用其修复大鼠坐骨神经缺损。
本实验结果表明,PEG-PLA 神经导管内壁质地疏松,具有取向性排列整齐的纹路和生物相容性。坐骨神经支配大腿后侧以及整个小腿,因此坐骨神经损伤会引起大腿后侧和小腿的肌肉萎缩,表现为大鼠足下垂和足趾变形,反映在足印上即足趾间距离减小、重心改变和足印延长[21-22]。术后大鼠运动功能评价中,PEG-PLA 组和ANG组大鼠足趾间距离减小、重心后移和足印延长的程度明显低于PLA 组,提示PEG-PLA 组和运动功能恢复明显优于PLA 组,接近ANG 组。PEGPLA 组坐骨神经功能指数虽高于和PLA 组,但差异无统计学意义(P<0.05)。分析原因可能是神经导管由于不含有任何生物活性物质,如神经营养因子,而神经营养因子在调节各种细胞活动如细胞的增殖、分化、成熟等的过程中扮演了重要的角色[23]。而导管仅是神经再生的物理通道,所以其修复的效果并不令人满意。PEG-PLA 组的移植段神经再生情况、腓肠肌肌肉湿重恢复率以及Masson 染色等结果均明显优于PLA 神经导管组,更接近自体神经移植的修复效果。各组步态分析结果、SFI、腓肠肌湿重恢复率、移植段神经再生情况以及Masson 染色结果均接近同类研究。
综上所述,我们认为PEG-PLA 神经导管具有良好的组织相容性,是一种较为理想的神经导管。在今后的实验中我们将以PEG-PLA 导管负载神经营养因子并修复大鼠坐骨神经缺损。
