2019年汕头市登革热病例临床表现与病毒包膜蛋白分子特征研究*
2021-08-13张旭彬张志华
郭 川,张旭彬,张志华
广东省汕头市疾病预防控制中心,广东汕头 515041
登革热(DF)是流行于热带与亚热带地区的一种虫媒传染病。它以登革病毒(DENV)为病原体,以白纹伊蚊和埃及伊蚊为主要传播媒介,每年在世界上造成超过5 000万人感染[1],给世界公共卫生体系带来较大冲击。登革热根据所呈现的症状分为普通型和重症两种。普通型主要临床表现以发热(通常超过38 ℃)以及关节和肌肉疼痛为主;重症则以登革出血热(DHF)及登革休克综合征(DSS)为代表,较为严重时会危及生命[2]。有报道称登革病毒包膜蛋白上的潜在毒力位点决定了毒株的毒力,从而影响了病毒感染机体后的临床表现[3-4]。因此,对流行毒株包膜蛋白的分子特征,特别是氨基酸进行序列分析,可以对该毒株的毒力做出评估和预测,从而为登革热疫情流行期间病例所呈现的临床特征分析提供分子生物学依据[5]。本文将汕头市2019年登革热疫情期间的病例所呈现的临床表现及实验室检测的结果进行分析及总结,探讨临床表现、实验室结果同疾病病程之间的关系,为临床医生识别与判断登革热病例提供数据及技术支持;同时对主要流行毒株的包膜蛋白氨基酸序列进行比对分析,对潜在毒力位点进行判别和毒力评估,从分子生物学的角度为该年疫情中患者所呈现的临床特征进行解释。
1 资料与方法
1.1一般资料 收集2019年汕头市登革热病例就诊时所口述的发病时间,主要症状(剧烈头痛、骨关节肌肉疼痛、眼眶痛)及呈现的体征(体温、皮疹)等信息,以及病例的核酸检测结果。
1.2方法 将该年发现的所有登革热病例根据口述的发病时间进行聚类分组,发病24 h之内的归为0 d、列为0组,发病24~48 h的归为1 d、列为1组,以此类推,将发病≥10 d列为10+组,共分11个组。统计每个组的病例中各种临床表现的比率(具有该临床表现的病例数/该组病例数),以及实验室核酸检测的阳性率。对核酸阳性的确诊病例标本进行包膜蛋白编码基因(E基因)的全长扩增和序列测定,方法参照之前的报道[6]。获得序列以后,采用生物信息学软件DNAstar/SeqMan进行序列剪切和拼接,用MEGA6.0进行编码蛋白氨基酸翻译和比对(氨基酸序列系统进化树的构建采用Neighbor-Joining邻接法),同时参考赵卫等[7]所报道的潜在毒力位点,对流行毒株的毒力位点氨基酸进行分析。
2 结 果
2.1核酸检测结果随发病时间增加的变化 2019年所报道的943病例中,根据发病到标本采集的时间进行聚类分组,一共分为11个组,每组分别检测63、172、177、141、136、104、66、32、27、11、14份标本。从图1可以看出绝大部分就诊病例处于发病时间0~5 d的阶段,此阶段的核酸检测结果大部分呈阳性(构成比>80%)。也有一部分病例在发病6 d后才就诊,可见该部分病例的核酸检测结果阳性率明显下降。发病时间越长阳性率下降越明显,但也有病例发病10 d后核酸检测结果依然呈阳性。

图1 不同发病时间组核酸检测阳性率的变化
2.2临床表现的分析结果 943例病例中共追溯到了790例就诊时的临床表现情况,根据追溯到的病例的发病时间分为11组(分别代表发病从0~≥10 d),每组分别分析了41、139、147、120、126、83、51、32、27、10、14例,见表1。从总体上看,发热是病例最主要的临床表现,约有96.84%的病例有发热体征,而且发热体征在发病后10 d内都基本存在,可见发热是登革热病例最重要的体征;具有骨关节肌肉疼痛临床表现的病例构成比也较高(53.16%),主要分布在病程的前7 d,从第8天开始,有该症状的病例数迅速下降;有头痛症状的病例与骨关节肌肉疼痛类似,病程前期所占比例较高,后期较低;有皮疹出血体征的病例随着发病时间的延长,构成比逐渐上升,可见在病程后期,有较高比例的病例呈现皮疹出血体征;有眼眶痛症状的病例在整个病程中都呈现较低的构成比。临床上主要以轻症为主,尚未发现DHF或DSS的病例,未发现死亡病例。

表1 各种临床表现的病例数及构成比[%(n/n)]
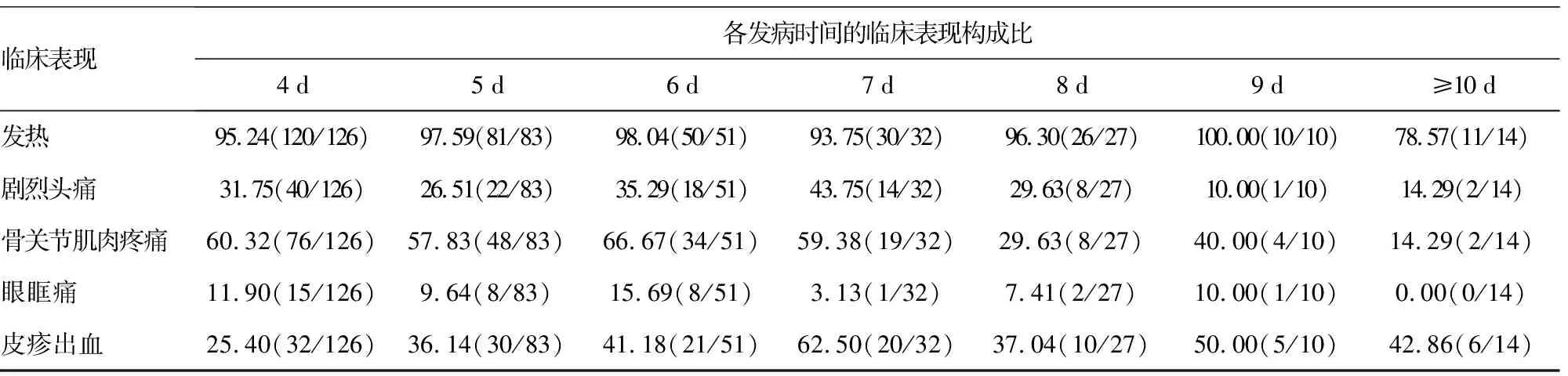
临床表现各发病时间的临床表现构成比4 d5 d6 d7 d8 d9 d≥10 d 发热95.24(120/126)97.59(81/83)98.04(50/51)93.75(30/32)96.30(26/27)100.00(10/10)78.57(11/14)剧烈头痛31.75(40/126)26.51(22/83)35.29(18/51)43.75(14/32)29.63(8/27)10.00(1/10)14.29(2/14)骨关节肌肉疼痛60.32(76/126)57.83(48/83)66.67(34/51)59.38(19/32)29.63(8/27)40.00(4/10)14.29(2/14)眼眶痛11.90(15/126)9.64(8/83)15.69(8/51)3.13(1/32)7.41(2/27)10.00(1/10)0.00(0/14)皮疹出血25.40(32/126)36.14(30/83)41.18(21/51)62.50(20/32)37.04(10/27)50.00(5/10)42.86(6/14)
2.3毒株包膜蛋白分子特征分析 从811例病例中共获得85条登革病毒E基因序列,其中1型病毒62条,2型病毒23条。3型和4型病毒由于阳性较弱无法获得其毒株序列。流行毒株包膜蛋白氨基酸序列经过精简(对氨基酸相似度100%的序列进行精简,1型病毒62条序列精简后剩下12条,2型病毒23条序列精简后剩下8条)后进行遗传进化分析。从分析(图2)结果可以看出,2019年流行的登革病毒毒株大致可分为主要流行毒株和次要毒株。主要流行毒株包括登革1型病毒中序号为D1/China/GDst19/9、D1/China/GDst19/16、D1/China/GDst19/600、D1/China/GDst19/604、D1/China/GDst19/793、D1/China/GDst19/961、D1/China/GDst19/1164等毒株(图2A),以及登革2型病毒中序号为D2/China/GDst19/25、D2/China/GDst19/340、D2/China/GDst19/413、D2/China/GDst19/532、D2/China/GDst19/846、D2/China/GDst19/983等毒株(图2B);同型主要流行毒株之间的氨基酸序列相似度达100%。次要毒株与主要流行毒株有1~2个位点的氨基酸发生变异,包括登革1型病毒中序号为D1/China/GDst19/3、D1/China/GDst19/13、D1/China/GDst19/591、D1/China/GDst19/1117和D1/China/GDst19/1159等毒株(图2A),以及登革2型病毒中序号为D2/China/GDst19/53和D2/China/GDst19/584等毒株(图2B)。将氨基酸序列相似度100%主要流行毒株序列中选择一条作为代表序列(登革1型选序号D1/China/GDst19/9,登革2型选序号D2/China/GDst19/25)与次要毒株氨基酸序列进行比对的结果显示,主要流行毒株与次要毒株的氨基酸序列在潜在的毒力位点(DENV-1的E44-E、 E156-T、E366-N和 DENV-2的E71-A、E126-E、E383-385-E-P-G、E390-S)氨基酸残基都保持一致。

注:A为登革1型病毒;B为登革2型病毒。
3 讨 论
每年夏秋之际,登革热疫情的预警及防控都得到各地卫生行政及疾病控制部门的重视。2018年卫生行政部门出台了新版的《登革热诊断标准:WS218-2018》[8],该方案将具有发热、头痛/骨关节痛/眼眶痛和皮疹临床表现的患者作为疑似病例。病例的临床表现判断在该病的早期识别中起到至关重要的作用。
2019年,汕头市暴发了严重的登革热疫情,截至2019年末共报道了943例病例[9]。在所报道的病例中,大多数患者为症状轻微的普通型病例,未发现重症登革热病例。主要临床表现为发热(96.84%)和骨关节肌肉疼痛(53.16%)。之前有报道称登革热患者最主要的临床表现为发热和肌肉关节疼痛[10-11],本文结论与之基本一致。症状轻微有可能是因为流行毒株属于弱毒株。对登革病毒的包膜蛋白氨基酸序列分析结果显示,主要潜在毒力位点登革1型病毒为E44-E、E156-T、E366-N;登革2型病毒为E71-A、E126-E、E383-E-P-G-E385、E390-S,不但2019年的所有毒株氨基酸残基都保持一致,而且与2015-2017年的流行毒株氨基酸序列保持一致[5]。因此可以解释病例的症状普遍与前些年流行的毒株十分相似,以发热和骨关节肌肉疼痛为主,未见重症病例。虽然在潜在毒力位点之外的区域,2019年毒株的包膜蛋白还是发生了1~2个氨基酸的变异,但是产生的变异对病例的临床表现没有产生明显的影响。感染主要流行毒株与次要毒株的病例的临床症状和体征没有表现出明显的差异。
症状轻微,虽然说明该病未对患者身体造成严重伤害,但也会造成患者未及时就医导致病例控制上的遗漏,给社区的登革热防控造成较大的压力。在疫情流行期间,临床医生为了防止遗漏病例,往往将具有轻微临床表现的患者列为疑似病例进行实验室筛查检测。一般来说,登革病毒的实验室检测共需要进行NS1抗原、核酸及IgM和IgG抗体4个项目的检测。其中NS1抗原在发病1 d后便可在患者体液中检测到,并持续到第9天左右。在检出NS1抗原的同时也可在体液中检出登革病毒核酸,并持续到第7天[12]。核酸检测结果作为登革热病例的确诊依据[8],确立了核酸检测在该病诊断中的地位。但核酸检测主要适合应用于发病早期病例标本的检测,此时血液中病毒核酸的丰度较高。在病程后期由于机体产生了免疫应答,病毒在血液中的浓度逐渐下降,此时无法在标本中检出核酸。但本文发现登革病毒核酸在发病7 d后的病例中仍有大部分能够被检出,可能是由于商业化检测试剂的不断优化改进,使得原来丰度较低的病毒核酸标本依然能被检出。这提示可将发病10 d之内的病例都进行核酸检测及分型,以提高确证病例的比例。发病10 d之后的病例需辅以抗体检测以区分恢复期病例或既往感染。
降低排查门槛(将具有轻微临床表现的患者列为疑似病例进行实验室筛查检测),增加排查检测项目,虽然提高了检出率,降低了遗漏病例的风险,但却给实验室带来较大的排查压力。本研究结果表明,可根据病例的临床表现,对该病例进行一定程度的病程研判,进而采取不同的检测策略。其中最有判别意义的两个临床表现为骨关节肌肉疼痛和皮疹。以发病7 d为界,骨关节肌肉疼痛提示病例可能处于发病7 d以内,核酸可能为阳性;而皮疹出现预示着病例发病已有7 d,核酸丰度降低,可能检测结果为阴性,必须进行抗体检测。
