TAMs来源的CCL5激活ERK1/2/p38信号通路在口腔鳞癌转移中的作用研究
2021-08-10林润台翟海昕朱智慧赵继志
马 超 张 韬 林润台 周 炼 翟海昕 朱智慧 赵继志
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一,它具有颈部淋巴结转移、远处转移率高的特点。在我国每年约有4.56万新发口腔鳞状细胞癌病例,其中16%~55%的患者伴有颈部淋巴结和远处部位转移[1,2]。研究表明,OSCC患者如伴有同侧或对侧单个颈淋巴转移,患者术后生存率较未转移患者降低50%[3],是导致患者预后差的主要原因。因此探究癌细胞侵袭、转移过程中的新机理,对OSCC转移性病例的有效治疗具有重要的意义。
CCL5(C-C chemokine ligand 5)是一种重要的趋化因子,它能够通过招募肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)促进肿瘤的发生发展[4]。TAMs是肿瘤微环境中最丰富的炎症细胞之一,其分泌的趋化因子(例如CCL5)是介导TAMs和癌细胞交联的重要载体。研究表明,来源于巨噬细胞的CCL5可以促进前列腺癌干细胞的生长和转移[5]。因此,通过抑制CCL5阻断TAMs与癌细胞的交联,可能成为恶性肿瘤转移的潜在治疗靶点。本研究旨在探究TAMs来源的CCL5在OSCC转移中的重要作用机制,以期为OSCC转移的治疗提供新的靶点和理论依据。
资料和方法
1.临床资料:选取北京协和医院口腔颌面外科2015年4月至2019年12月收集资料完整的OSCC患者81例,所有患者术前均未接受化疗或放疗,术中留取肿瘤原发灶和癌旁组织(对照)样本。本研究经北京协和医院伦理委员会批准,所有病例均明确诊断,所有参与者均知情同意。
2.免疫组化方法及判定标准:免疫组织化学检测按照文献所述的方法进行[6],一抗分别为CCL5抗体(1∶100 dilution,ab9679,Abcam),CD163抗体(1∶100 dilution,ab51037,Abcam)。免疫组化结果由两位病理学家采用免疫应答评分法(IRS)评估。
3.细胞培养:本研究使用两株OSCC细胞系(CAL27和SCC-9)以及人急性单核细胞白血病细胞株THP-1(ATCC,Rockville,MD,USA)。THP-1细胞经320nM PMA以及20ng/ml IL-4(PeproTech,Rocky Hill,NJ,USA)处理20h后,诱导分化为TAMs。OSCC细胞株在RPMI培养基中添加10%血清白蛋白和1%青霉素/链霉素。细胞使用PBS、20μM ERK抑制剂(pd98059)、10μM P38抑制剂(sb203580)、CCR5单克隆抗体(Mab17959,Abnova)以及CCL5 siRNA(sc-44066,Santa Cruz)在无血清培养基中处理1h,检测细胞侵袭和蛋白表达。
4.免疫印迹:免疫印记检测按照文献所述的方法进行[6]。一抗使用Vimentin(1∶500,10366-1-ap,Proteintech)和E-cadherin(1∶500,ab40772,Abcam)抗体。
5.免疫荧光:按照文献所述[6]采用免疫荧光法检测口腔鳞癌组织中CCL5和TAMs标志物CD163的共定位。
6.统计学处理:统计分析使用SPSS 19.0(Chicago,IL,USA)和Graphpad Prism(La Jolla,CA,USA)统计软件。CCL5和CD163表达相关性采用Spearman相关分析。P<0.05为差异有统计学意义。
结 果
结果显示,CCL5和CD163在癌旁组织中均无表达,而在癌组织中高表达(图1A-F)。CCL5在转移肿瘤组织中的表达明显高于无转移肿瘤组织(IRS评分,4~9;P<0.001),与CD163的表达具有相似趋势(P<0.001,图1A-F)。相关性分析发现,CCL5和CD163在39例患者中高表达,14例中低表达,两者表达显著相关(图1G),提示CCL5参与了TAMs诱导的口腔鳞癌转移。
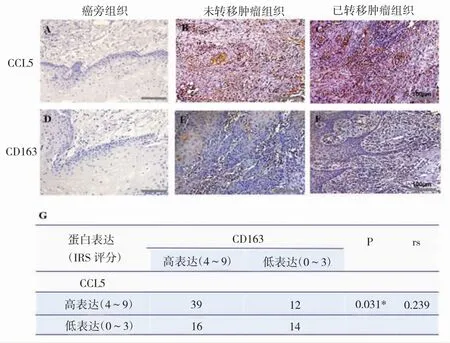
图1 CCL5和CD163在OSCC组织中表达升高
笔者首次发现OSCC肿瘤组织中CCL5与CD163存在共定位(图2A-C),且在转移肿瘤组织中检测到显著增强的共定位信号(图2D-F),证实OSCC肿瘤微环境中的CCL5主要来源于TAMs而非肿瘤细胞。细胞实验发现,CAL27和SCC-9细胞与TAMs共培养后比未经TAMs共培养的细胞具有更强的侵袭能力(图3),在培养基中加入CCR5单抗(10g/ml)以及CCL5 siRNA能够显著降低TAMs诱导的OSCC细胞侵袭。这些结果表明TAMs来源的CCL5推动了OSCC细胞侵袭。
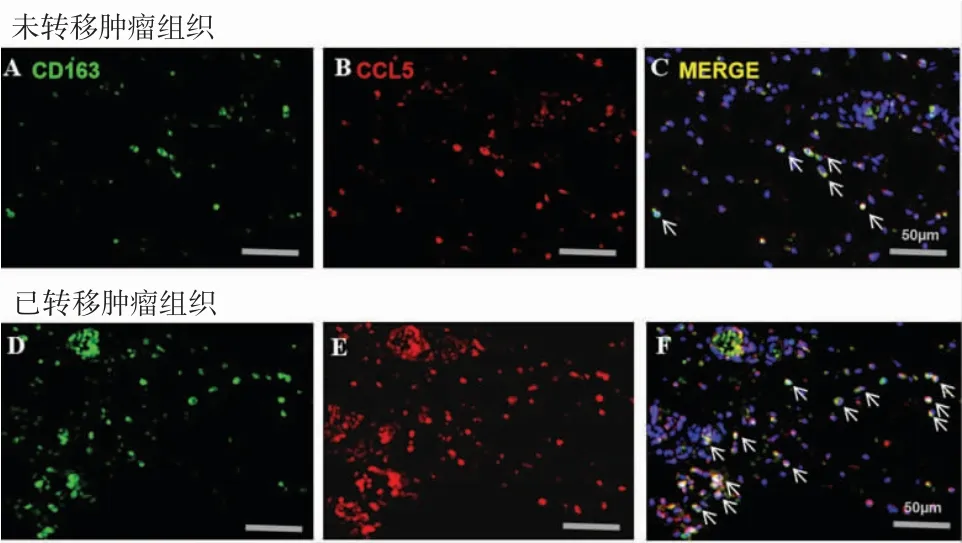
图2 CCL5和CD163在OSCC组织中共定位增加
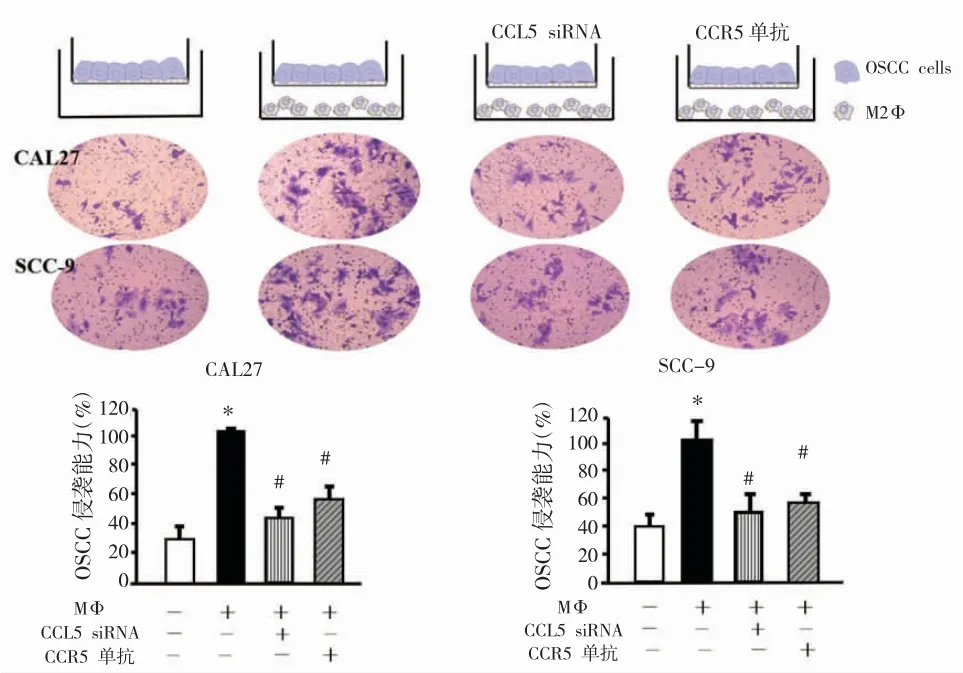
图3 抑制CCL5降低了TAMs诱导的细胞侵袭
笔者发现,CAL27和SCC-9细胞与TAMs共培养可降低上皮标记物E-cadherin的水平,同时提高间充质标记物Vimentin的水平(P<0.05)(图4)。ERK1/2和P38抑制剂显著降低E-cadherin的表达,同时增加了Vimentin的水平。结果表明TAMs来源的CCL5通过激活P38/ERK1/2通路,调节EMT转化,推动了TAMs介导的OSCC细胞的转移和侵袭。
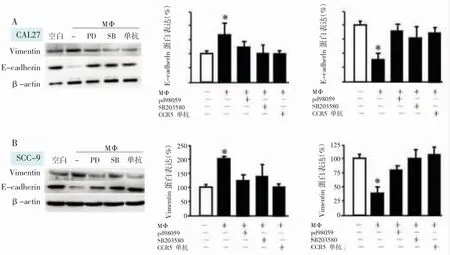
图4 P38/ERK1/2通路参与了OSCC细胞EMT转化
讨 论
CCL5是TAMs与肿瘤细胞之间恶性循环的重要交联,已被证实在胃癌、结肠癌、前列腺癌以及黑色素瘤的转移和进展中有重要的推动作用[7]。笔者通过临床样本检测,首次发现OSCC组织中TAMs与CCL5存在共定位,证实OSCC肿瘤微环境中的CCL5主要来源于TAMs而非肿瘤细胞。同时发现有淋巴结转移的OSCC组织中CCL5及CD163的表达高于无淋巴结转移的肿瘤组织和癌旁组织,且两者的表达呈正相关。该结果与affymetrix微阵列数据集分析结果一致(GSE2280,GSE3524)[8,9],证实TAMs来源的CCL5与OSCC的转移密切相关,在OSCC肿瘤治疗方面具有潜在应用前景。
笔者发现M2型巨噬细胞能够诱导OSCC细胞侵袭显著增加。给予CCL5 siRNA以及CCR5阻断抗体能够显著抑制肿瘤细胞的侵袭,这些结果再次佐证了TAMs来源的CCL5在OSCC细胞侵袭中起重要作用。口腔鳞状细胞癌是一种上皮来源恶性肿瘤,已有研究显示,TAMs来源的CCL5通过刺激上皮间充质转化(EMT)从而推动了肿瘤细胞的转移和侵袭[5]。笔者发现TAMs来源的CCL5能够下调OSCC细胞的E-cadherin表达同时上调波形蛋白Vimentin的表达,证实CCL5推动了EMT转化途径。研究发现,P38、MAPK和ERK通路的激活参与了口腔鳞状细胞癌EMT转化途径[10]。笔者证实p-ERK1/2和p-P38抑制剂明显阻断CAL27和SCC-9细胞的EMT转化。这些数据表明CCL5通过ERK1/2/p38信号通路,调节EMT转化,推动了OSCC细胞的侵袭。
