14-N-(3-乙酰基苯)-氨基粉防己碱的合成及生物活性研究
2021-08-07侯宏保
党 雯,侯宏保
(1山西医科大学第二医院药学部,太原 030001;2山西医科大学药学院;*通讯作者,E-mail:27780042@qq.com)
癌症成为了世界范围内威胁人类健康最严重的疾病之一,据估计,到2030年,全球癌症死亡人数将超过1 140万[1]。因此,全球对抗癌药物的需求正在上升。2020年以来,抗癌药物销售额达到1 500亿美元,在各类药物中排名首位。因此,癌症的流行及其对现有治疗药物的耐药性要求开发新药,以克服现有药物的局限性[2,3]。
超过200种化疗药物已被FDA批准用于治疗癌症,其中75%来自天然产物[4,5]。随着人们对抗肿瘤药物的深入研究,发现天然药物在抗癌药物中起重要作用,大约三分之二的抗肿瘤药物是发现的天然产物来源或衍生分子[6,7]。其中通过对天然活性成分的结构进行修饰改造,克服其局限性,从而发现新的高效低毒的抗肿瘤药物,已经成为了一条有效的途径。
粉防己碱(tetrandrine,Tet)是一种典型的二苄基异喹啉类生物碱,具有多种生物活性,包括抗炎、抑制肿瘤增殖、免疫调节等。还作为一种具有多种作用机制的潜在抗癌药物,能抑制肿瘤细胞的增殖,增加化疗药物的敏感性,逆转肿瘤细胞的多药耐药(MDR)[8]。其中,Tet可诱导多种肿瘤细胞凋亡,包括人肺癌细胞、肝癌细胞、白血病细胞、结肠癌细胞、淋巴瘤细胞、人乳腺癌细胞等[9,10]。文献研究显示,粉防己碱的结构修饰报道较少,改造主要是在C-5和C-14位置引入卤素再构建C-C或C-N键,制备异喹啉单元的季铵盐[11-13]。在这项研究中,为丰富粉防己碱衍生物的结构多样性和获得更好的抗癌候选药物,以粉防己碱为原料,依次经硝化、还原反应,获得关键中间体14-氨基粉防己碱,采用Chan-Lam-Evans偶联法再将其与硼酸类化合物合成了新型粉防己碱衍生物[14-17]。利用HL7702和HepG2细胞对新合成的粉防己碱衍生物进行生物活性评价。本文还对其抗肝癌HepG2细胞活性最强的化合物的迁移侵袭能力进行了研究。
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪;ZF-I型三用紫外分析仪;Bruker AVANCE 600 MHz型超导核磁仪(TMS为内标);Bruker AV-Ⅲ 400 MHz超导核磁共振波谱仪;Bruker ESI-QTOF型液质联用仪。
粉防己碱购自南京道斯夫生物科技有限公司;催化剂、配体均购自百灵威科技有限公司;实验用水为国药集团产蒸馏水;其他化学试剂均为分析纯,购自国药集团化学试剂有限公司。
HepG2细胞、HL2202细胞由中国科学院上海药物研究所提供。
1.2 14-N-(3-乙酰基苯)-氨基粉防己碱的合成
1.2.1 中间体C-14-硝基粉防己碱、C-14-氨基粉防己碱的合成 在惰性气体氮气保护下,温度为-10 ℃时,将HNO3(69%,1.2 ml,19.2 mmol)缓慢滴加到(CH3CO)2O(3.0 ml,32.0 mmol)的溶液中,继续搅拌20 min。待混合液温度至室温后,滴加溶解于CH2Cl2(5 ml)中的粉防己碱(1.0 g,1.6 mmol)中,在-5 ℃下反应6.5 h,反应过程中用薄层色谱法对反应进程进行监测,反应结束后,用饱和碳酸氢钠水溶液淬灭反应原液,用CH2Cl2(3×20 ml)萃取,用无水硫酸钠干燥,过滤。溶剂在减压下被除去,以CH2Cl2/MeOH(50/1,V/V)混合溶液为洗脱剂,经硅胶柱层析纯化,得到化合物C-14-硝基粉防己碱(见图1)。
将C-14-硝基粉防己碱(1.0 g,1.5 mmol)与钯(10%,100 mg)碳加氢催化剂的混合物加入水合肼(85%,1.65 ml,45.0 mmol)的无水甲醇(30 ml)中,在80 ℃搅拌。反应在2 h内完成。混合物冷却至室温,过滤除去催化剂。滤液采用减压旋转蒸发法进行蒸发。用CH2Cl2稀释残渣,用水清洗,在无水硫酸镁上干燥,过滤。溶剂在减压下被除去。原油由石油醚和丙酮(1/3,V/V)重结晶得到化合物C-14-氨基粉防己碱(见图1)。
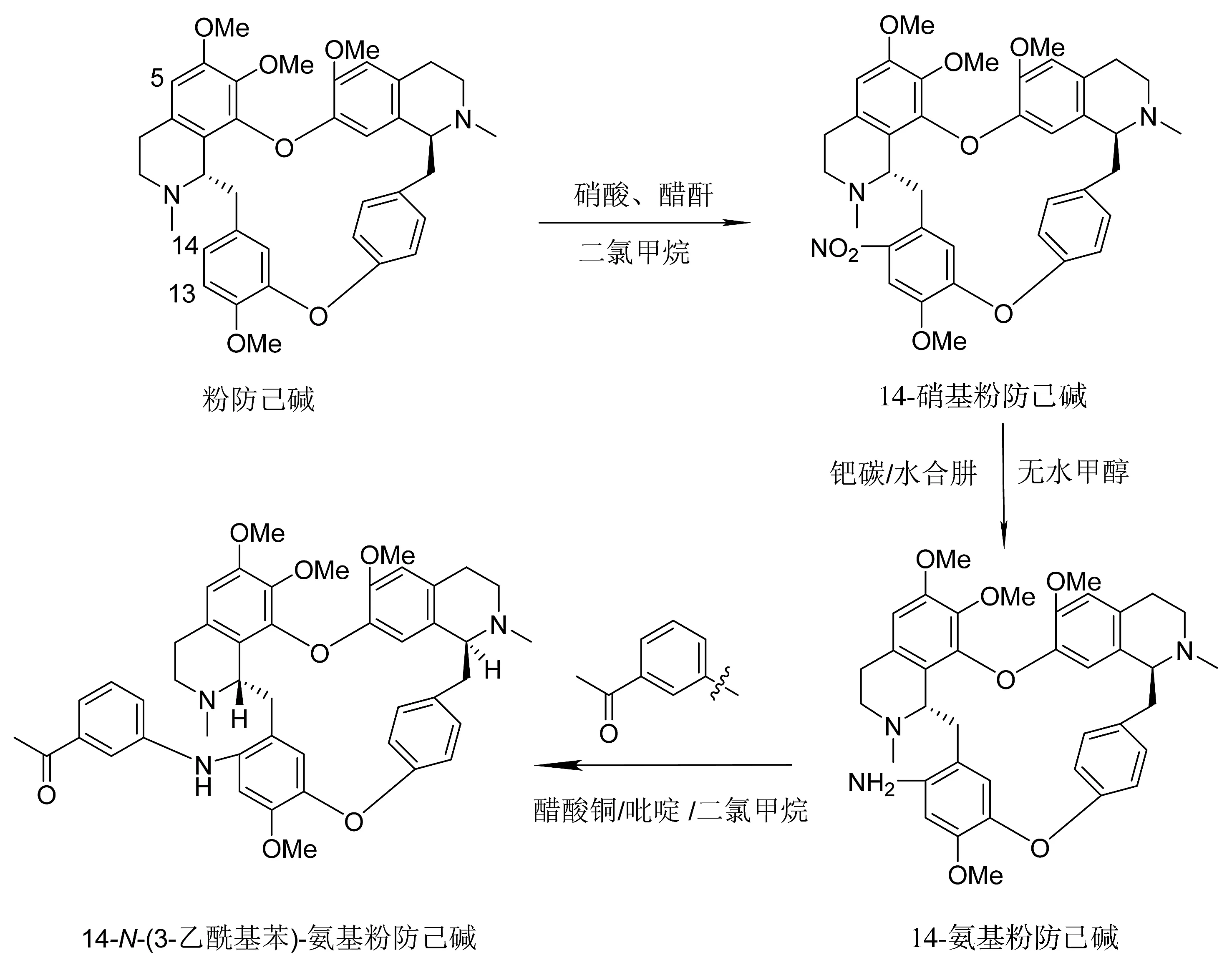
图1 14-N-(3-乙酰基苯)-氨基粉防己碱的合成路线Figure 1 The synthetic routes of 14-N-(3-acetylphenyl)-amino-tetrandrine
1.2.2 14-N-(3-乙酰基苯)-氨基粉防己碱的合成及鉴定 将中间体C-14-氨基粉防己碱(0.16 mmol,100 mg)、3-乙酰基苯硼酸(0.32 mmol,52.47 mg)、醋酸铜(0.32 mmol,63.89 mg)和吡啶(0.24 mmol,19.98 ml)在室温下进行“一锅化”反应。在干燥的氧气中搅拌12-24 h反应终止。用氨水淬灭反应,过滤,用CH2Cl2萃取3次。无水硫酸钠干燥,过滤,溶剂在减压下被除去。用硅胶层析法从CH2Cl2/MeOH(50/1,V/V)中分离得到产物(见图1)。
14-N-(3-乙酰基苯)-氨基粉防己碱:黄褐色固体85.57 mg;产率:70.8%;熔点:142.7-143.3 ℃;1H NMR(400 MHz,CDCl3)δ7.46(s,1H),7.25(dd,J=8.9,2.5 Hz,2H),7.20(d,J=5.0 Hz,1H),7.15(dd,J=8.1,2.5 Hz,1H),7.08(d,J=7.7 Hz,1H),6.95(s,1H),6.60(dd,J=8.4,2.5 Hz,1H),6.55-6.46(m,1H),6.42(d,J=5.2 Hz,1H),6.24(d,J=5.3 Hz,1H),6.10(dd,J=8.5,1.8 Hz,1H),5.84(d,J=9.4 Hz,1H),3.95-3.85(m,2H),3.85-3.78(m,3H),3.67(d,J=3.2 Hz,3H),3.61-3.49(m,2H),3.44(d,J=5.7 Hz,2H),3.30(d,J=3.3 Hz,3H),3.05(d,J=8.7 Hz,3H),2.57(m,3H),2.45(m,2H)。13C NMR(101 MHz,CDCl3)δ197.5,162.2,154.9,150.9,148.2,147.9,147.3,145.0,143.3,142.9,137.4,137.0,135.3,132.4,131.8,128.8,128.5,126.7,126.3,125.0,120.7,120.3,120.2,119.8,118.3,117.3,113.3,111.3,111.2,104.8,102.7,63.1,60.8,60.1,59.1,55.4,54.7,54.6,43.8,42.1,41.0,39.9,38.6,37.7,30.9,28.7,28.3,25.8,23.4,21.7,19.6。HRMS(ESI-TOF)m/z:756.37{[M+H]+},计算得C46H49N3O7。红外:3 356,2 942,2 831,1 453,1 021 cm-1。
1.3 抗肿瘤活性
1.3.1 抗肿瘤活性MTT测试 取处于对数生长期,生长状态良好的HepG2、HL7702细胞,以5×106个/孔接种于96孔板,分别标记为HepG2、HL7702细胞组,同时设空白组,37 ℃培养过夜(在细胞孔周围孔内加入100 μl无菌PBS),作用24,48,72 h。每孔加入10 μl(5 mg/ml)MTT,37 ℃培养4 h;吸出培养基,加入150 μl DMSO震荡10 min;酶标仪测定568 nm下的各孔吸光值(OD值)。对照组存活率记为100%。
1.3.2 细胞划痕实验检测14-N-(3-乙酰基苯)-氨基粉防己碱对HepG2细胞迁移能力的影响 marker笔在6孔板背后,用直尺比着,均匀的划横线,大约每隔0.5-1 cm一道,横穿过孔,每孔至少穿过5条线;取处于对数生长期,生长状态良好的HepG2细胞;用PBS清洗细胞,去除划下的细胞,加入无血清培养基,同时拍取0 h照片;放入培养箱培养48 h后拍照;本操作依据参考文献进行[18]。
1.3.3 细胞侵袭实验检测14-N-(3-乙酰基苯)-氨基粉防己碱对HepG2细胞迁移能力的影响 取处理好的HepG2细胞,加入PBS清洗细胞,胰酶消化收集离心,去上清。无血清MEM培养基重悬细胞,细胞计数板计数。结晶紫染液染色,室温中放置20 min,PBS清洗,用干净的棉球将上室一侧的未迁移的细胞擦干净,显微镜下观察拍照;本操作依据参考文献进行[19]。
1.3.4 统计学分析 使用SPSS 22对不同组间体外药效学的差异进行比较,采用单因素方差分析以及LSD-t检验(方差齐)和非参数检验(方差不齐)进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 生物活性
MTT法体外抗肿瘤活性测试结果表明:该化合物对所测肿瘤细胞有不同程度的增殖抑制作用(见表1)。

表1 不同化合物对肿瘤细胞及正常细胞的抑制作用
结果显示,合成的14-N-(3-乙酰基苯)-氨基粉防己碱对肝癌HepG2细胞有抑制活性,化合物(IC50=4.61 μmol/L)对肝癌HepG2细胞的IC50值远低于先导化合物粉防己碱(IC50=10.98 μmol/L)。
2.2 14-N-(3-乙酰基苯)-氨基粉防己碱对肝癌HepG2细胞生存率的影响
采用MTT法评价14-N-(3-乙酰基苯)-氨基粉防己碱对肝癌HepG2细胞生存率的影响,使用不同浓度的14-N-(3-乙酰基苯)-氨基粉防己碱作用于HepG2细胞24,48,72 h后,对细胞的的生长抑制作用结果见表2。14-N-(3-乙酰基苯)-氨基粉防己碱可以剂量依赖性地抑制HepG2细胞增殖(见图2)。在24,48,72 h的IC50值分别为7.25,4.61,2.98 μmol/L。
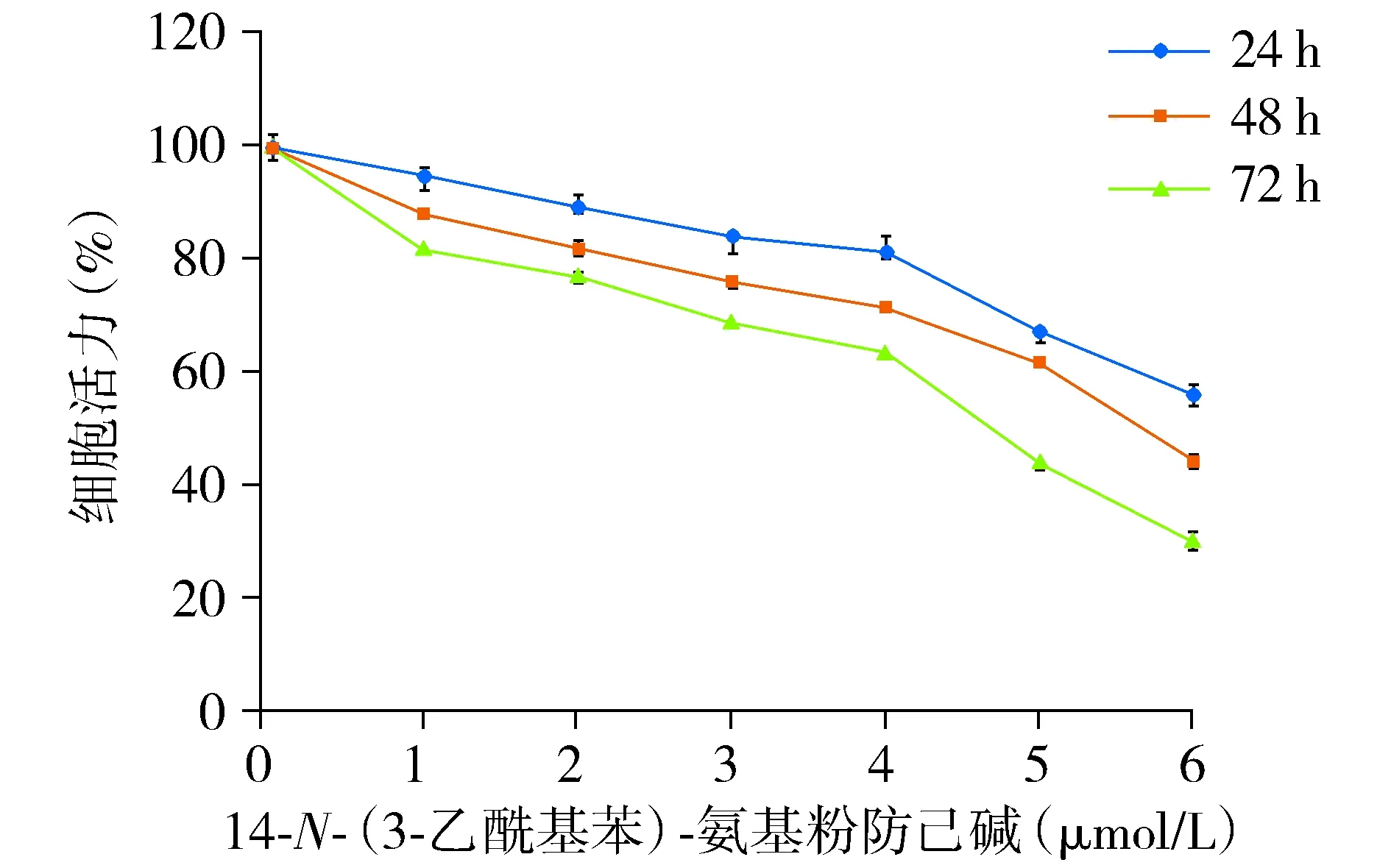
图2 14-N-(3-乙酰基苯)-氨基粉防己碱对HepG2细胞生存率的影响Figure 2 Effects of 14-N-(3-acetylbenzene)-amino tetrandrine on survival rate of HepG2 cells
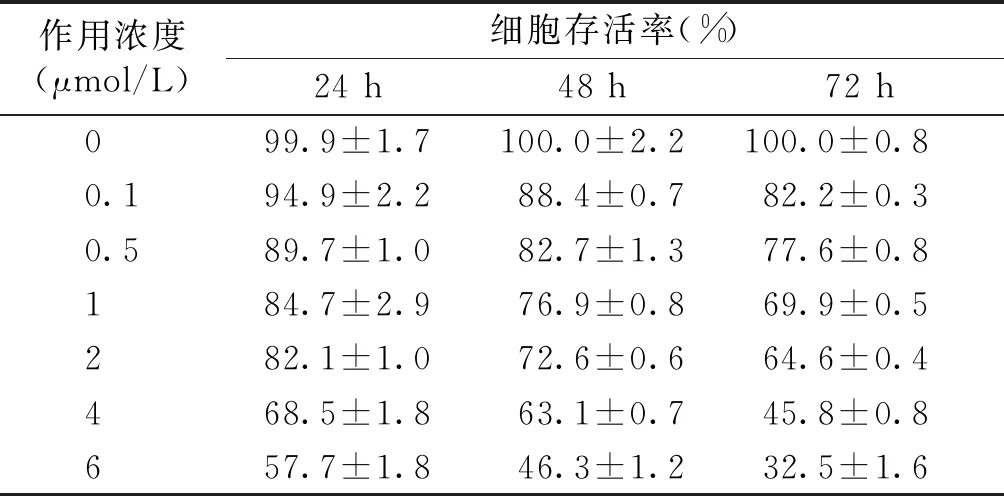
表2 14-N-(3-乙酰基苯)-氨基粉防己碱抑制HepG2细胞增殖的作用
2.3 划痕实验检测14-N-(3-乙酰基苯)-氨基粉防己碱对HepG2细胞迁移能力的影响
倒置显微镜观察化合物作用48 h后HepG2细胞划痕细胞面积的差异,结果见图3。划痕实验证实14-N-(3-乙酰基苯)-氨基粉防己碱抑制HepG2细胞迁移能力,0 μmol/L干预组0 h和48 h迁移距离分别为(51±4.1)μm和(181±4.6)μm,1 μmol/L干预组细胞划痕0 h和48 h迁移距离分别为(50±2.4) μm和(168±6.3)μm;2 μmol/L干预组细胞划痕0 h和48 h迁移距离分别为(52±1.3)μm和(135±2.1)μm;4 μmol/L干预组干预组细胞划痕0 h和48 h迁移距离分别为(53±1.9)μm和(50±5.3)μm。不同浓度作用后迁移距离差异有统计学意义(P<0.05)。表明14-N-(3-乙酰基苯)-氨基粉防己碱能够抑制HepG2细胞的迁移能力,且呈浓度依赖性。
2.4 Transwell实验检测14-N-(3-乙酰基苯)-氨基粉防己碱对HepG2细胞侵袭力的影响
0 μmol/L干预组通过膜过滤器的迁移数量为(40±1)个,2 μmol/L干预组通过膜过滤器的迁移数量为(20±2)个,4 μmol/L干预组通过膜过滤器的迁移数量为(11±1)个,6 μmol/L干预组通过膜过滤器的迁移数量为(3±1)个,不同浓度干预后通过膜过滤器的迁移细胞数量差异具有统计学意义(P<0.05)。提示14-N-(3-乙酰基苯)-氨基粉防己碱对HepG2细胞的侵袭能力表现出明显的抑制作用,且呈浓度依赖性。
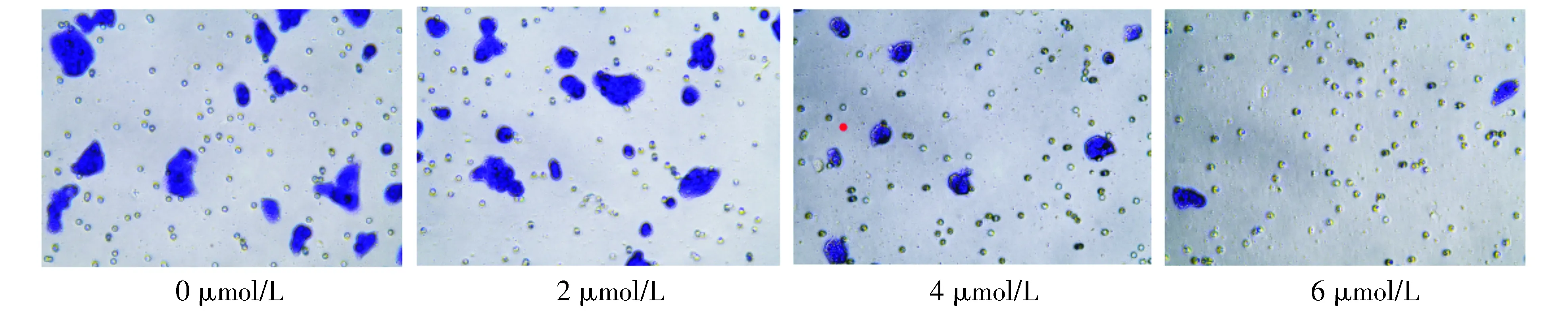
图4 Transwell实验分析14-N-(3-乙酰基苯)-氨基粉防己碱对HepG2细胞侵袭的影响 (倒置显微镜,×200)Figure 4 Effects of 14-N-(3-acetylbenzene)-amino tetrandrine on invasion of HepG2 cells by Transwell (inverted microscope,×200)
3 讨论与结论
以粉防己碱为先导化合物,经过中间体C14-硝基粉防己碱、C14-氨基粉防己碱,再经Chan-Lam-Evans反应合成了粉防己碱衍生物,并通过HRMS、1H NMR、13C NMR等技术手段进行了表征。采用MTT法对衍生物进行体外细胞增殖活性筛选,细胞划痕实验和Transwell侵袭结果均表明,14-N-(3-乙酰基苯)-氨基粉防己碱对肝癌HepG2细胞有较好的生物活性;此外,14-N-(3-乙酰基苯)-氨基粉防己碱(IC50=4.61 μmol/L)对HepG2细胞的毒性是粉防己碱原料药对HepG2细胞毒性的2.38倍和阿霉素对HepG2细胞毒性的2.91倍。由于14-N-(3-乙酰基苯)-氨基粉防己碱对HepG2细胞的抑制效果较好,进一步设置4个浓度分别进行干预,发现化合物可以剂量依赖性地抑制HepG2细胞增殖。
进一步的研究表明,14-N-(3-乙酰基苯)-氨基粉防己碱具有明显抑制肝癌细胞HepG2迁移和侵袭的能力。以上实验设计合成及初步活性探究结果可为进一步通过结构优化寻求更加有效的抗肿瘤化合物提供参考。
