表没食子儿茶素没食子酸酯对大豆分离蛋白凝胶的影响
2021-08-06王晨笑青舒婷王丹凤徐学兵
王晨笑,青舒婷,王丹凤,郑 妍,徐学兵,岳 进,3,*
(1.上海交通大学食品科学与工程系,上海 200240;2.丰益全球研发中心,上海 200240;3.上海交通大学四川研究院,四川 成都 610000)
大豆分离蛋白(Soy Protein Isolate,SPI)是食品工业中使用最广泛的植物蛋白之一。SPI的蛋白质组成、结构、变性和聚集程度对于其功能特性有较大影响。凝胶特性是蛋白质非常重要的一种功能特性,蛋白质凝胶可以在食品体系中提供一个容纳水、脂肪、风味物质和食品成分的结构基体。SPI凝胶被广泛用于肉类产品中,包括香肠、午餐肉和丸子等传统肉类产品或人造肉等新型肉类产品[1]。诱导SPI形成凝胶的常用方法有热诱导、酸诱导、盐诱导和酶诱导等,通过不同方法形成的凝胶在机械性能、流变性能、质地及保水能力方面各不相同。热诱导是指通过加热使球蛋白天然致密结构展开,从而导致原本被掩埋的疏水性残基暴露,进而促进变性蛋白质的聚集[2]。谷氨酰胺转氨酶(Glutamine Transaminase,TGase)又称转谷氨酰胺酶,是一种蛋白质-谷氨酰胺γ-谷氨酰转移酶,可通过催化蛋白质结合的谷氨酰胺的λ-羧酰胺与赖氨酸之间的酰基转移,形成ε-(λ-谷氨酰胺)-赖氨酸交联键来修饰蛋白质[3-4]。
由于SPI凝胶的硬度和黏弹性较差,限制了其应用,通常需要经过改性或加入一些交联剂进行辅助,增强凝胶强度[5-6]。在食品体系中,当酚类化合物与蛋白质均存在时,其间会发生相互作用使蛋白质的结构发生变化,进而影响蛋白质的一些功能特性,如乳化性和凝胶特性等[7]。这一相互作用可以以共价或非共价方式发生:在碱性条件下,多酚可以被氧化为醌,与蛋白质的巯基或氨基发生不可逆的相互作用,从而通过酚环形成共价结合;而非共价相互作用主要通过氢键、范德华力和疏水相互作用实现[8]。表没食子儿茶素没食子酸酯(Epigallocatechin Gallate,EGCG)是绿茶中最丰富、最活跃的儿茶素单体,其分子结构包含3个芳香环,1个吡喃环和8个酚羟基。由于EGCG分子具有多个羟基,使其具有卓越的功能特性和理化活性,包括常见酚类化合物中较高的自由基清除能力、抗炎症能力、降血脂能力和癌症抑制能力[9]。目前已有一些研究关注到多酚类物质与蛋白质的相互作用使得蛋白质结构和理化性质发生变化[10-11]。刘勤勤等[12]发现,茶多酚可以与SPI中的色氨酸残基发生相互作用,改变SPI的分子构象。Jia等[13]报道,乳清蛋白与EGCG之间的共价相互作用改变了乳清蛋白的构象结构并改善了其理化特性。李杨等[14]发现与EGCG复合后的SPI乳化特性显著提高。但多酚类物质与SPI共同形成凝胶的研究鲜有报道。
本研究重点考察EGCG对热诱导和TG诱导的SPI凝胶特性的影响,以表面疏水性、自由巯基含量、内源荧光光谱和圆二色谱探究EGCG对SPI结构的影响,并分析了EGCG/SPI凝胶体系的作用力、机械性能、流变学特性和微观结构。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
大豆分离蛋白(蛋白质含量85.1%),由丰益(上海)生物技术研发中心有限公司提供;表没食子儿茶素没食子酸酯(EGCG),纯度>95%,购自侨怡生物科技(上海)有限公司;谷氨酰胺转氨酶(TG),购自江苏一鸣生物股份有限公司。试验中所用试剂均为分析纯,所用水均为去离子水。
1.1.2 仪器与设备
M200 Pro多功能酶标仪,瑞士Tecan公司;J-815圆二色光谱仪,日本JASOC公司;TA.XTPlus Texture Analyzer质构仪,英国StableMicroSystems公司;Haake-RheoStress6000流变仪,美国赛默飞公司;D-1903拉曼图像-扫描电子显微镜联用仪,捷克WITec公司。
1.2 方法
1.2.1 SPI-EGCG复合凝胶的制备
用磷酸缓冲液(0.1 mol/L,pH 7.4)溶解SPI,磁力搅拌2 h,配制成12%的溶液备用。将EGCG(0.01、0.02、0.05 g/g)加入SPI溶液制备混合液。取适量样品,用磷酸缓冲液(0.1mol/L,pH 7.4)稀释至SPI浓度为1 mg/mL,用于蛋白性质测定。
参考Ben-Harb等[2]的方法,采用热诱导与酶诱导两种方法制备SPI-EGCG复合凝胶。将SPI-EGCG混合物置于90℃加热30 min,然后放入冰水浴中冷却,4℃下稳定24 h后,制得热诱导凝胶。在SPI-EGCG混合物中加入TG(50 U/g)后在45℃下保持2 h,制得酶诱导凝胶。
1.2.2 蛋白表面疏水性
表面疏水性能采用荧光法测定,荧光探针选用8-苯胺-1-萘磺酸(ANS)。取一定量的混合物稀释至SPI浓度分别为0.04、0.08、0.12、0.16、0.20 mg/mL。分别取不同浓度稀释样品4 mL,在390 nm激发波长和470 nm发射波长下分别测定样品的荧光强度(FI0)和样品加入20μL ANS溶液(8 mmol/L)后的荧光强度(FI1),两者差值记为FI。以蛋白质浓度为横坐标,FI为纵坐标作图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数,记为H0。
1.2.3 自由巯基含量
准确称取10.42 g Tris、6.76 g甘氨酸和1.49 g EDTA溶于900 mL去离子水中,调节pH至8.0后,定容至1 L,得标准缓冲溶液。准确称取0.2 g 5,5′-二硫代双(2-硝基苯甲酸)(DTNB)溶于50 mL标准缓冲液中,制得Ellman试剂。
取1 mg/mL的SPI溶液4 mL,加入40μLEllman试剂,混匀后于25℃恒温水浴中保温45 min,用紫外分光光度计在412 nm波长下测定吸光值。以不加样品只加Ellman试剂作为试剂空白,以Ellman试剂只加样品溶液作为样品空白。游离巯基含量可以通过下式计算得出:
式中:A412为除去样品空白和试剂空白后的吸光值;D为稀释倍数;13 600为DTNB的摩尔吸光系数,L/(mol·cm);C为样品中蛋白质含量,mg/mL。
1.2.4 内源荧光光谱
使用荧光酶标仪获得SPI-EGCG复合物的内源荧光光谱。激发波长设定为280 nm,激发和发射狭缝宽度分别设定为5 nm。发射波长范围设置为300~400 nm,扫描速度为10nm/s。
1.2.5 蛋白二级结构
采用圆二色谱(Circular Dichroism,CD)分析蛋白质二级结构。参考Zhou等[15]的方法,选择0.1 mg/mL的蛋白质浓度用于CD光谱分析。在室温下,用圆二色光谱仪在240~190 nm下扫描样品,扫描速度为1 nm/s,带宽为1.0 nm,响应时间为0.25 s。收集的光谱数据通过DICHROWEB软件进行分析。
1.2.6 凝胶分级溶解度
参考Gómez-Guillén等[16]的方法。将3 g凝胶样品与30 mL的四种溶剂混合:0.6 mol/L氯化钠(S1);0.6 mol/L氯化钠+1.5 mol/L尿素(S2);0.6 mol/L氯化钠+8 mol/L尿素(S3);0.6 mol/L氯化钠+8 mol/L尿素+0.5 mol/Lβ-巯基乙醇(S4)。将混合物以9 000 r/min离心15 min,并收集上清液。将5 mL 20%三氯乙酸添加到等体积的上清液中,并放置在冰箱中过夜以沉淀蛋白质。之后,将混合物以7 200 r/min离心20 min,收集沉淀,并将沉淀物溶解于1 mol/L的NaOH中,用缩二脲法测定蛋白质含量。凝胶在S1、S2、S3、S4中的溶解度分别代表离子键、氢键、疏水相互作用和二硫键的贡献。
1.2.7 凝胶流变特性
参考Pang等[17]的方法,使用流变仪分析凝胶的流变特性。使用直径27 mm的圆形平板探头进行测量,测量间距为1 mm。将混合物倒在流变仪上,按照测量间距设置探头位置,覆盖一层石蜡油,按照“1.2.1”的方法在流变仪上制备凝胶,并进行0.1%~100%,1 Hz的应变扫描。
1.2.8 凝胶强度
参考Li等[18]的方法,使用质构仪在室温下分析凝胶的强度。使用圆柱形探针(直径30 mm),测试前速度为1.5 mm/s,测试速度和测试后速度均为1.0 mm/s,压缩距离和触发力分别为4.0 mm和5 g。最大持续压缩力即为凝胶强度。
1.2.9 凝胶形态
根据Wu等[19]的方法,使用扫描电子显微镜观察SPI凝胶形态。将3 g样品在2.5%戊二醛磷酸钠缓冲液(0.2 mol/L,pH 7.2)中固定1 h,浸入磷酸盐缓冲液中在4℃冰箱中保存24 h。将样品用磷酸钠缓冲液(0.2 mol/L,pH 7.2)漂洗3次,每次15 min,并将样品冻干。扫描电子显微镜在5 kV加速电压下观察固定样品。
1.2.10 凝胶持水力(WHC)
参考Liu等[20]的方法,略有改动。将凝胶在4℃下用9 000 r/min转速离心10 min,除去上清液后,记录离心前后离心管和凝胶的总质量。WHC(%)可以通过以下公式计算得出:

式中:m0为空管的质量(g),m1和m2分别代表离心前后管和凝胶的质量(g)。
1.2.11 数据处理
凝胶强度试验重复10次,其他每项试验重复3次。均值和标准差的统计分析通过SPSS26.0完成,使用Duncan多范围检验(P<0.05)进行单向方差分析,以检测平均值之间的显著性差异。使用OriginPro 2018进行绘图。
2 结果与分析
2.1 SPI表面疏水性和自由巯基含量
SPI的表面疏水性随EGCG浓度的增加而增强(图1)。蛋白质的表面疏水性主要是由聚集的非极性基团与水分子之间的排斥作用力引起的[21],EGCG可以与蛋白质中的疏水基团发生相互作用,导致这一作用力增强。加入EGCG促进SPI自由巯基含量的增加,且低浓度下增加明显(图1),这表明EGCG与蛋白质的非共价结合促进了蛋白质的展开,使得更多的巯基被暴露。多酚对蛋白质表面疏水性和自由巯基含量的影响已有较多报道,Jiang等[22]发现,花青素的添加对SPI自由巯基含量有较大影响,在添加较高浓度花青素时可能生成SPI-花青素共价复合物,使自由巯基含量有所下降。
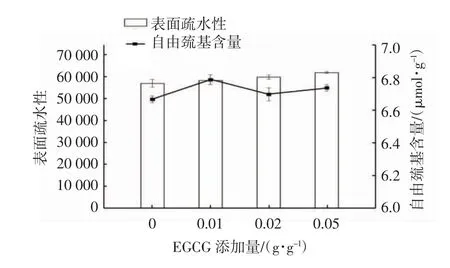
图1 EGCG 添加量对SPI表面疏水性和自由巯基含量的影响Fig.1 Effects of EGCG additions on surface hydrophobicity and free sulfhydryl contents of SPI
2.2 SPI内源荧光光谱
天然蛋白质分子中的色氨酸和酪氨酸残基是内源荧光的主要来源。SPI在325 nm处显示出最大发射波长(图2),加入EGCG降低了SPI的荧光强度,这可能是由于SPI结构由于EGCG的加入发生展开,色氨酸残基暴露程度增加,被亲水环境包围。较高浓度EGCG使SPI的最大发射峰出现轻微红移(6 nm)。Sui等[23]发现,花青素-SPI非共价复合物具有更低的蛋白质荧光强度,证明了SPI和花青素之间的相互作用诱导了SPI多肽链的解链和结构变化。

图2 EGCG 添加量对SPI内源荧光光谱的影响Fig.2 Effects of EGCG additions on fluorescence spectra of SPI
2.3 SPI二级结构
与未添加EGCG的SPI相比,添加EGCG后SPI的无序结构(β-转角和无规卷曲)含量明显增加,β-折叠含量明显减少(表1)。这一结果说明EGCG的加入导致SPI的聚集程度降低,蛋白质链出现松弛和拉伸,分子柔性增强。蛋白质的二级结构主要由氢键维持[24],而以上变化可能有助于SPI在凝胶形成过程中发生更多氢键之间的相互作用,形成更强的凝胶结构。Cao等[25]研究发现,多酚的添加会破坏维持α-螺旋结构的氢键,促进蛋白质的展开,从而导致在凝胶形成过程中形成更多的氢键。
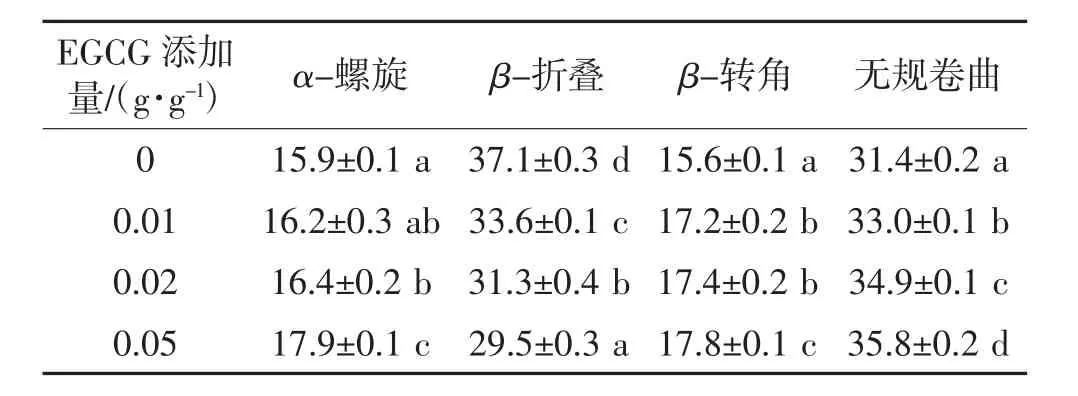
表1 EGCG添加量对SPI二级结构的影响Table 1 Effects of EGCGadditionson the secondary structure of SPI
2.4 SPI凝胶分级溶解度
离子键、氢键、疏水相互作用和二硫键等化学力的作用使蛋白质形成凝胶[26]。特定的化学试剂可以裂解特定的作用力,使凝胶部分溶解于其中,溶解的蛋白质含量与凝胶中该作用力的大小有关[17]。不同EGCG添加量下的SPI凝胶的分级溶解度如图3所示。TG可以在蛋白质分子间和分子内形成ε-(γ-谷氨酰基)-赖氨酸交联,建立稳定的蛋白质网络,从而形成凝胶[3],因而在TG诱导的SPI凝胶中的四种化学力均显著低于热诱导的SPI凝胶(P<0.05)。形成热凝胶的主要化学力为二硫键和疏水相互作用,EGCG的添加增强了热凝胶的氢键、疏水相互作用和二硫键。一方面,多酚的添加有助于凝胶网络中氢键的形成,并且二级结构的变化使得更多氢键可以相互作用;另一方面,由于EGCG的添加造成的蛋白质链拉伸使得其表面疏水性增强,二硫键增多,由自由巯基间的交联反应驱动的热诱导的蛋白质聚集增加,使得疏水相互作用及二硫键在SPI热凝胶网络中的数量增加,特别是在较低浓度EGCG的情况下[27-28]。

图3 不同EGCG 添加量对SPI凝胶分级溶解度的影响Fig.3 Effects of EGCG additions on protein fractional solubility of SPIgels
2.5 SPI凝胶机械性能
储存模量(G’),又称弹性模量,可以反映在某些应变或应力下凝胶的能量存储能力[29]。由图4可知,TG诱导凝胶储存模量明显高于热诱导凝胶,这是由于热凝胶和酶凝胶形成机理不同,机械性能存在较大差异,而EGCG的添加均增加这两种SPI凝胶的储存模量,因为EGCG使凝胶结构更加稳固,凝胶表现出更强的弹性和对抗应力的能力。EGCG添加量为0.01 g/g时,两种SPI凝胶的储存模量最大,更高的EGCG添加量反而使储存模量下降,可能由于高浓度的多酚使聚集蛋白质之间的相互作用减弱,削弱凝胶网络结构。Ai等[30]在碱诱导的鸭蛋蛋清凝胶中添加茶多酚,同样发现较高的茶多酚浓度会使凝胶的储存模量降低。
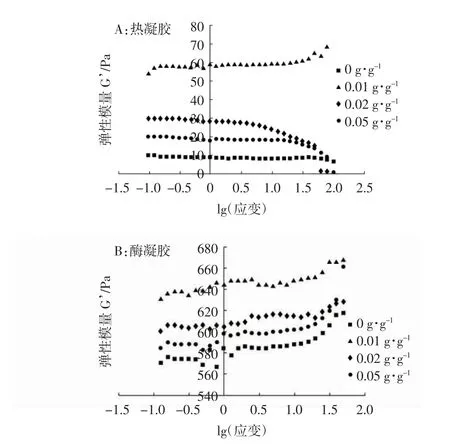
图4 不同EGCG 添加量对SPI凝胶弹性模量的影响Fig.4 Effects of EGCG additionsonelastic modulus of SPIgels
由图5可知,加入EGCG,凝胶强度增大,TG诱导的SPI凝胶强度均高于热诱导的SPI凝胶,说明酶诱导的凝胶具有更牢固紧密的结构,所能承受的最大压力更大。另外,随着EGCG添加量的增加,SPI凝胶的凝胶强度先升高后降低,与储存模量的变化趋势一致。这同样可以说明当EGCG添加量过高时会减弱蛋白之间的分子相互作用,使得凝胶强度下降。

图5 EGCG 添加量对SPI凝胶强度的影响Fig.5 Effects of EGCG additions on the gel strength of SPIgels
2.6 SPI凝胶微观结构
在热诱导凝胶化过程中,分子会逐渐舒展并随后发生聚集,进而形成不可逆的凝胶结构[31]。未添加EGCG的热凝胶表面粗糙,凝胶网络稀疏(图6A)。随着EGCG的加入,凝胶网络变得更加规则和均匀,孔径减小,表明凝胶形成了更多的三维结构。与热凝胶相比,酶凝胶具有更致密和均匀的结构。并且添加0.01、0.02 g/g EGCG同样使蛋白质凝胶表现出更为精细且多孔的结构(图6F、G),说明EGCG的添加可以在一定程度上改善蛋白质凝胶网络结构的稳定性。而当EGCG添加量增加到0.05 g/g时,SPI热凝胶与酶凝胶的孔径又变大,凝胶网络结构的松散也使得其弹性模量与凝胶强度下降。与该结果相似,Zhu等[32]发现,谷酰胺转氨酶诱导的凝胶具有更均匀致密的凝胶网络以及更小的孔分布,其凝胶强度更强,持水力更好。

图6 SPI凝胶扫描电镜图Fig.6 Scanning electron micrographs of SPIgels
2.7 SPI凝胶持水力
对于热诱导和酶诱导形成的SPI凝胶,添加EGCG均能提高凝胶的持水力(表2)。这可能由于添加EGCG造成蛋白质结构改变,形成高密度的孔结构和稳定的凝胶,从而有效固定水分。相比于热诱导SPI凝胶,酶诱导SPI凝胶具有更高的持水力,这得益于其更稳定和致密的结构。热诱导SPI凝胶持水力随EGCG添加量的增加而持续增强,说明蛋白凝胶网络更牢固,可以较好地保留其中的水,并且更为复杂的网络也阻止了水分子的渗出。Dai等[33]研究发现,在热诱导形成肌球蛋白凝胶过程中加入咖啡酸可以增强其凝胶强度和持水力,因为咖啡酸可以增强肌球蛋白的疏水作用和氢键,加速肌球蛋白的凝胶形成。
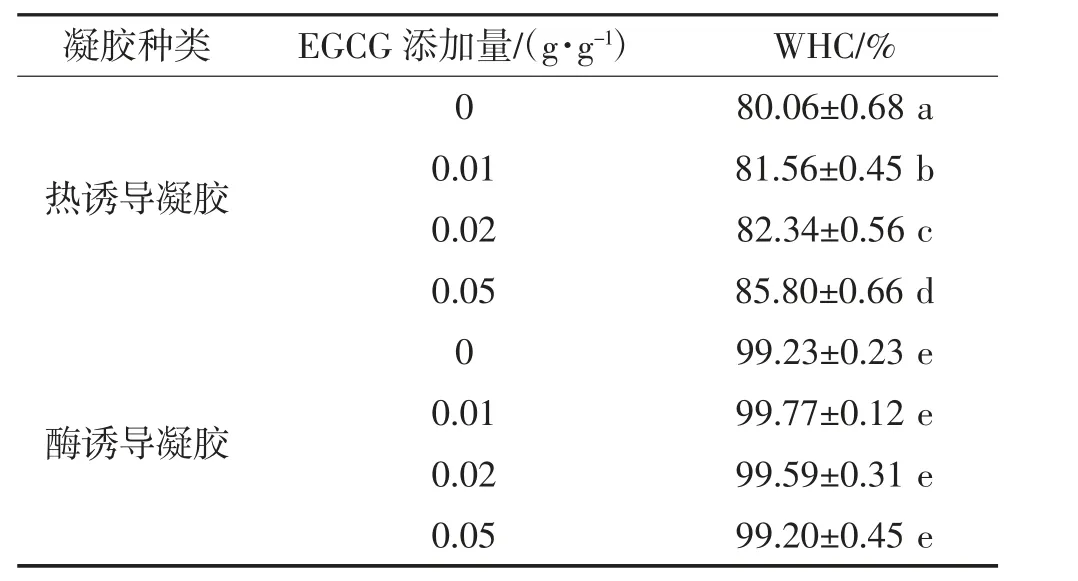
表2 EGCG添加量对SPI凝胶持水力的影响Table 2 Effects of EGCGadditionson thewater holding capacity of SPIgels
3 结论
EGCG与SPI间的非共价结合可以引起SPI构象的变化,使其表面疏水性、自由巯基含量增加,蛋白链舒展。在SPI热诱导和酶诱导凝胶形成过程中加入EGCG可以使SPI发生更多交联和相互作用,增强了热凝胶的氢键、疏水相互作用和二硫键作用力,提高热凝胶和酶凝胶的机械性能和持水力,特别是在酶凝胶中。0.01 g/g的EGCG添加量下,两种凝胶具有最高的储存模量和凝胶强度,凝胶结构最为稳定。因此,在蛋白凝胶形成过程中加入多酚可以改善凝胶结构,促进更大强度凝胶的形成。在后续研究中,可以结合核磁共振波谱等手段测定结合位点与数目,进一步探究EGCG和SPI的相互作用机理,阐明其在凝胶形成过程中的变化。
