蟾蜍二烯酸内酯类成分的生物转化和生物合成研究进展
2021-08-05陈文杰胡耀廷王如锋赵淑娟王峥涛
陈文杰,胡耀廷,王如锋,3,4*,赵淑娟,3,4*,王峥涛,3,4
1.上海中医药大学中药研究所,上海 201203
2.中药新资源与品质评价国家中医药管理局重点研究室,上海 201203
3.中药标准化教育部重点实验室,上海 201203
4.上海市中药复方重点实验室,上海 201203
以蟾酥为代表的蟾蜍类药材是一类传统动物药[1-5],药用历史悠久,市场需求量大。随着国内外学者对蟾蜍类药材研究的深入,发现其所含蟾蜍二烯酸内酯类成分在强心、抗肿瘤、镇痛、抗炎、抗病毒、抗辐射、镇咳、利尿、调节免疫等多方面具有显著的药理活性[1,6-8],临床上广泛应用于冠心病、心脏病等相关疾病的治疗[1]。例如,在麝香保心丸中,臣药蟾酥在治疗心肌缺血引起的心绞痛、胸闷、心肌梗死以及冠心病中发挥了重要的作用[9-12]。
目前,蟾蜍二烯酸内酯类成分的获取主要从蟾酥等蟾蜍类药材中直接提取[1,13],该方法成本高、收益低。随着医药及研发需求的日益增长,蟾蜍类药材的开发与应用,需要充足的药用资源作为支撑,仅仅依靠现有的天然蟾蜍资源,必然会导致蟾蜍野生物种衰退甚至灭绝,严重破坏生态环境平衡。通过人工规模化养殖蟾蜍,不仅需要一定的生长周期,而且还要面临产品纯化难、品种退化及重金属污染等诸多问题[14-16]。一直以来,国内外对蟾酥的研究主要集中在化学成分和药理作用[1,17],而解决其药用资源短缺难题的研究相对较少。近年来,中药活性成分的生物合成在保护中药资源方面发挥起越来越要的作用[18]。基于合成生物学原理,设计和改造微生物菌株生产天然产物的方法已被广泛认可,该方法的应用需要建立在目标产物生物合成途径完全解析的基础之上[19-22]。本文全面总结了蟾酥中主要蟾蜍二烯酸内酯类成分及其相互间的生物转化关系,系统回顾了蟾蜍二烯酸内酯类成分生物合成途径解析进展及其生物转化应用,并进一步讨论了蟾蜍二烯酸内酯类成分生物合成的发展前景。
1 蟾蜍二烯酸内酯类成分结构分类
蟾蜍内酯类是珍稀中药蟾酥的主要活性成分,为中华大蟾蜍Bufo gararizansCantor 或黑眶蟾蜍B.melanostictusSchneider 的次生代谢产物。蟾蜍内酯类成分主要分为两类,即蟾蜍二烯酸内酯类(bufadienolides)和20,21-环氧蟾蜍内酯类[1]。
在新鲜采集的蟾酥中,蟾蜍二烯酸内酯类成分主要为蟾蜍毒素类化合物,而蟾蜍毒素类化合物又分为蟾毒、蟾毒配基硫酸酯和蟾毒配基脂肪酸酯。而中药制剂和临床上使用的是加工炮制过后的蟾酥制品。鲜蟾酥经高温炮制后,主要成分蟾蜍毒素类化合物会分解为蟾毒配基类化合物。蟾蜍二烯酸内酯类成分是一类甾体强心苷,在C-17 位与六元不饱和内酯环(α-吡喃酮环)相连。根据配体母核上的取代基的不同,蟾蜍二烯酸内酯类成分按照其配基上母核取代基的不同分为5 类,分别为蟾毒灵类(I)、脂蟾毒配基类(II)、沙蟾毒精类(III)、假蟾毒精类(IV)、环氧酯蟾毒配基类(V),母核结构见图1[1,13,17]。蟾蜍二烯酸内酯类成分的结构特征是A/B 环顺式结构、B/C 环反式结构和C/D 环反式结构,同时还具有诸如3-OH、14β-OH 或14,15-环氧环的特征取代基基团[17]。

图1 蟾蜍二烯酸内酯类成分的结构母核Fig.1 Skeletons of bufadienolides
2 蟾蜍二烯酸内酯类成分的生物转化
目前,已分离出142 种蟾蜍内酯类化合物,如蟾毒灵(bufalin,1)、酯蟾毒配基(resibufagenin,2)、华蟾毒精(cinobufagin,3)、华蟾毒它灵(cinobufotalin,4)、远华蟾毒精(telocinobufagin,5)等。其中蟾毒灵、酯蟾毒配基和华蟾酥毒基作为蟾酥质量标准中含量测定的指标成分被收录于《中国药典》2020年版。
蟾蜍二烯酸内酯类成分具有良好的强心、镇痛、抗肿瘤、消炎等药理活性[23-24]。游离性蟾蜍二烯酸内酯类成分水溶性较差,对人体具有一定毒性[25]。因此,许多研究者尝试通过生物转化改变蟾蜍二烯酸内酯类成分相关化学结构,以寻找具有良好生理活性且毒性低的结构新颖的化合物。生物转化(biotransformation)是利用生物体系(细菌、真菌或植物组织等)或酶为催化剂对外源性化合物进行结构修饰以实现化学转化的生物化学过程,具有选择性强、反应条件温和、催化效率高、反应类型多、产物成分较为单一、易于分离纯化等优点,往往可用于有机合成难以完成的化学反应,易于得到结构新颖的化合物[26]。本文总结了利用微生物及植物悬浮培养体系对蟾蜍二烯酸内酯类成分进行生物转化的研究进展,生物转化产物见图2。

图2 蟾蜍二烯酸内酯类成分生物转化反应的产物Fig.2 Biotransformation products of bufadienolides
2.1 微生物转化
叶敏等[26-28]利用链格孢Alternaria alternateAS 3.457 8 对华蟾毒精(3)进行生物转化实验,分离并鉴定了6 个转化产物,其中12β-羟基-去乙酰华蟾毒精(12β-hydroxy-desacetylcinobufagin,6)、3-氧代-12β-羟基-华蟾毒精( 3-oxo-12β-hydroxy- cinobufagin,7)、3-氧代-12β-羟基-去乙酰华蟾毒精(3-oxo-12β-hydroxy-desacetylcinobufagin,8)、12-氧代-华蟾毒精(12-oxo-cinobufagin,9)和3-氧代- 12α-羟基华蟾毒精(3-oxo-12α-hydroxycinobufagin,10)为新化合物,主要的生物转化反应为12β-羟基化、3-OH 脱氢和16-位脱乙酰基。该转化过程的动态考察结果显示,华蟾毒精的转化顺序为华蟾毒精先全部转化为12β-羟基-华蟾毒精,然后发生了3-OH 脱氢反应,最后是16-位脱乙酰基反应[26]。铜绿假单孢菌Pseudomonas aeruginosaAS 1.860 对华蟾毒精(3)表现出特异性的3-OH 脱氢作用[26,29]。刺囊毛霉Mucor spinosusAS 3.3450 对蟾毒灵(1)的生物转化反应,分离并鉴定了12 个产物,其中7β-羟基-蟾毒灵(7β-hydroxy-bufalin,11)、11β-羟基蟾毒灵(11β-hydroxybufalin,12)、16α-羟基-蟾毒灵(16α-hydroxy-bufalin,13)、7β,16α-二羟基-蟾毒灵(7β,16α-dihydroxy-bufalin,14)、1β,7β-二羟基-蟾毒灵(1β,7β-dihydroxy-bufalin,15)、1β,12β-二羟基-蟾毒灵(1β,12β-dihydroxy-bufalin,16)和3-表-7β-羟基-蟾毒灵(3-epi-7β-hydroxy-bufalin,17)为新化合物,主要的生物转化反应为7β-、12β- 和16α-位羟基化[26,30-31]。细孢毛霉Mucor subtilissimusAS 3.2454 对酯蟾毒配基(2)的生物转化反应,分离并鉴定了7 个转化产物,主要的转化反应是1β-、11β-、12β- 和16α-位羟基化,产物中包括了单羟基化、双羟基化和糖苷化化合物[26]。丝状真菌Mucor polymorphosporus生物转化酯蟾毒配基(2)共获得22 种产物,其中3-表-7β-羟基-酯蟾毒配基(3-epi- 7β-hydroxy-resibufogenin,18)、5β,7β-二羟基-酯蟾毒配基(5β,7β-dihydroxy-resibufogenin,19)、7α-羟基- 酯蟾毒配基(7α-hydroxy-resibufogenin,20)、3-表- 12β- 羟基-酯蟾毒配基( 3-epi-12β-hydroxy- resibufogenin,21)、5β,12β-二羟基-酯蟾毒配基(5β,12β-dihydroxy-resibufogenin,22)、3-表-12α-羟基-酯蟾毒配基(3-epi-12α-hydroxy-resibufogenin,23)、5β,12α-二羟基-酯蟾毒配基(5β,12α-dihydroxy- resibufogenin,24)、1β,12α-二羟基-酯蟾毒配基(1β,12α-dihydroxy-resibufogenin,25)、3-氧代-12α-羟基-酯蟾毒配基(3-oxo-12α-hydroxy-resibufogenin,26)、12-氧代-酯蟾毒配基(12-oxo-resibufogenin,27)、3-表-16β-羟基-酯蟾毒配基(3-epi-16β-hydroxy- resibufogenin,28)、7β,16α-二羟基-酯蟾毒配基(7β, 16α-dihydroxy-resibufogenin,29)、12β,16α-二羟基-酯蟾毒配基(12β,16α-dihydroxy-resibufogenin,30)、1β,16α-二 羟 基-酯蟾毒配基(1β,16α-dihydroxy- resibufogenin,31)及12α,16α-二羟基-酯蟾毒配基(12α,16α-dihydroxy-resibufogenin,32)为新化合物[32]。转化反应涉及1β-、C-5、7α-、7β-、12α-、12β- 和16α-位的羟基化以及3-OH 的差向异构化和脱氢化,其中12α-、12β- 和16α-位的羟基化是主要生物转化反应[32]。铜绿假单孢菌对酯蟾毒配基(2)和12β-羟基-酯蟾毒配基(12β-hydroxy-resibufogenin,33)表现出特异性的3-OH 脱氢作用[26,29]。Fusarium solaniAS 3.1829 菌株对酯蟾毒配基(2)的生物转化反应,分离鉴定了5 个转化产物,其中3-(1,2-二甲基-1,2-乙二醇缩醛)-酯蟾毒配基[3-one-cyclic 3-(1,2-dimethyl-1,2-ethanediylacetal)-resibufogenin,34]、3-二甲氧基-酯蟾毒配基(3-dimethoxyl- resibufogenin,35)和3-表-15α-羟基-7βH-蟾毒灵(3-epi-15α-hydroxy-7βH-bufalin,36)为新化合物[33]。Curvularia lunataAS 3.4381 对酯蟾毒配基(2)的生物转化反应,分离并鉴定了4 个转化产物,其中12-氧代-3-表-16β-羟基-酯蟾毒配基(12-oxo-3-epi-16β- hydroxy-resibufogenin,37)和12β,15-环氧-3-表-蟾毒 灵-14,15-烯(12β,15-epoxy-3-epi-bufalin-14,15- ene,38)为新化合物,观察到在生物转化反应过程中存在异构化、羟基化和氧化反应[34]。由Actinomucor elegansAS 3.277 8 对酯蟾毒配基(2)进行生物转化反应,分离并鉴定了5 种产物,反应中观察到了高度立体和区域特异性异构化、羟基化和酯化反应,产物中3-表-12-氧代-羟基酯蟾毒配基(3-epi-12-oxo-hydroxy-resibufogenin,39)和3α-乙酰氧基-15α-羟基蟾毒灵(3α-acetyloxy-15α-hydroxy- bufalin,40)未见报道[35]。链格孢对蟾毒它灵(bufotalin,41)的生物转化反应,分离并鉴定了3种转化产物,其中12β-羟基-蟾毒它灵(12β-hydroxy- bufotalin,42)和 3-氧代-12β-羟基-蟾毒它灵(3-oxo-12β-hydroxy-bufotalin,43)为新化合物[36]。链格孢对沙蟾毒精(arenobufagin,44)转化得到3个转化产物,其中 3-氧代-沙蟾毒精(3-oxo- arenobufagin,45)、3-氧代-异沙蟾毒精(3-oxo- bufarenogin,46)为新化合物[37]。链格孢对华蟾毒它灵(4)的生物转化反应得到了4 个转化产物,其中12β-羟基-华蟾毒它灵(12β-hydroxy-cinobufotalin,47)新化合物[37]。革兰阳性菌芽孢杆菌Bacillussp.CMB-TD29 能特异性羟基化南美蟾毒精(marinobufagenin,66),生物转化反应产生了11α-、12β-、17-α 3 种新的羟基化衍生物[38]。
2.2 植物悬浮培养细胞生物转化
长春花Catharanthus roseus(L.) G.Don.细胞培养体系对华蟾毒精(3)的生物转化反应获得了8个转化产物,其中5 个为新化合物,分别为1β-羟基- 去乙酰华蟾毒精( 1β-hydroxy-desacetyl- cinobufagin,48)、华蟾毒精 3-O-β-D-葡萄糖苷(cinobufagin-3-O-β-D-glucoside,49)、3-氧代-去乙酰华蟾毒精-16-O-β-D-葡萄糖苷(3-oxo-desacetyl- cinobufagin-16-O-β-D- glucoside,50)、去乙酰华蟾毒精-16-O-β-D-葡萄糖苷(desacetyl-cinobufagin- 16-O-β-D-glucoside,51)和3-表-去乙酰华蟾毒精- 16-O-β-D-葡萄糖苷(3-epi-hydroxy-desacetylcinobufagin- 16-O-β-D-glucoside,52)[26,39-40]。长春花细胞培养体系能使华蟾毒精(3)的3-OH 和16-OH 发生糖基化反应,证明长春花细胞培养体系能特异性糖苷化华蟾毒精,其他转化反应还包括C-5、C-1β位羟基化,3-OH 脱氢反应及C-16 位脱乙酰基反应等[26,39-40]。桔梗Platycodon grandiflorum(Jacq.) A.DC.细胞悬浮培养体系对华蟾毒精(3)的生物转化反应得到了3 个产物,其中去乙酰华蟾毒它灵(desacetylcinobufotalin,53)为主产物[26,39]。长春花和桔梗体系对华蟾毒精(3)的生物转化具有一定的相似性,转化反应以C-5 位羟基化和C-16 位脱乙酰基为主[26,39-40]。桔梗悬浮培养体系对蟾毒灵(1)的生物转化反应得到2 个产物,分别为3-表-远华蟾毒精(3-epi-telocinobufagin,54)和3-表-蟾蜍灵-3-O-β-D-葡萄糖苷(3-epi-bufalin-3-O-β-D-glucoside,55)[41]。银杏Ginkgo bilobaL.叶细胞悬浮培养体系生物转化酯蟾毒配基(2),转化产物为3-表-酯蟾毒配基(3-epi-resibufogenin,56)[42]。李莉欣[43]研究结果显示,桔梗悬浮培养体系对酯蟾毒配基(2)的生物转化反应得到了4 个产物,其中1β-羟基-酯蟾毒配基(1β-hydroxy-resibufogenin,57)和3-表-南美蟾毒精(3-epi-marinobufagenin,58)为新化合物。雪莲Saussurea involucrate(Kar.et Kir.) Sch.-Bip.悬浮细胞对蟾毒它灵(41)有较好的生物转化能力,从中分离并鉴定了5 个转化产物,其中3-表-蟾毒它灵(3-epi-bufotalin,59)、3-表-去乙酰蟾毒它灵(3-epi-desacetylbufotalin,60)、3-表-蟾毒它灵-3-O-β-D-葡萄糖苷(3-epi-bufotalin-3-O-β-D-glucoside,61)和1β-羟基蟾毒它灵(1β-hydroxy-bufotalin,62)为新化合物[37]。雪莲悬浮细胞体系对远华蟾毒精(5)的生物转化反应,分离并鉴定了4 个转化产物,但是转化率较低,可能远华蟾毒精水溶性较差以致反应不完全[37]。雪莲悬浮细胞对日蟾毒它灵(gamabufotalin,63)的生物转化反应,分离并鉴定了 4 个转化产物,其中 3-表-日蟾毒它灵(3-epi-gamabufotalin,64)和3-氧代-Δ1-日蟾毒它灵(3-oxo-Δ1-gamabufotalin,65)为新化合物[37]。
3 蟾蜍二烯酸内酯类成分的生物合成
3.1 蟾蜍二烯酸内酯类成分的生物合成途径解析进展
蟾蜍二烯酸内酯类成分为乙型强心苷,强心甾类成分为甲型强心苷,它们的区别为强心苷元C-17位上的不饱和内酯环。蟾蜍二烯酸内酯类成分为六元不饱和内酯环,强心甾类成分为五元不饱和内酯环。蟾蜍二烯酸内酯类化合物在植物和动物体内均有,动物中主要存在于蟾蜍毒腺内。植物体内的蟾蜍二烯酸内酯类化合物生物合成途径与蟾蜍体内的并不一致,前者更接近与强心甾的生物合成途径。与蟾蜍二烯酸内酯类不同,强心甾类成分大多存在于在植物体内,如洋地黄类植物。
在洋地黄植物中,强心甾类成分的生物合成途径:甲羟戊酸→胆固醇→孕烯醇酮→孕酮→强心甾类[44-48](图3)。可以为动植物中蟾蜍二烯酸内酯类成分的生物合成途径解析提供一些借鉴。类似的,胆固醇也是植物来源蟾蜍二烯酸内酯类成分的生物合成前体[49]。后续其反应过程大致如下:首先是胆固醇的侧链发生断裂,依次在C-22 位和C-20 位发生羟基化反应,随后C-20/22 键断裂生成孕烯醇酮,孕烯醇酮氧化生成孕酮,孕酮还原得到3β-羟基- 5β-20-孕酮,最后发生14β-羟基化反应[50-52]。对于六元不饱和内酯环的形成过程,首先侧链C-21 位发生羟基化反应,形成草二酰酯中间体,通过如图3所示的羟醛加成过程和脱羧反应,生成含有六元不饱和内酯环的蟾蜍二烯酸内酯类成分[50-52]。
在蟾蜍中,Siperstein 等[53]利用同位素示踪法揭示marinobufotxin 和南美蟾毒精的生物合成前体为胆固醇。胆固醇在动物中被代谢成孕烯醇酮和羟基胆汁酸盐,这可能是蟾蜍二烯酸内酯类成分生物合成的重要中间体。Chen 等[54]通过给予蟾蜍14C或氘标记的类固醇,发现5α-和3β,5β-羟基胆酸盐衍生物是比胆固醇更有效的前体;但是给予标记的孕烯醇酮时不能检测到放射性。这与已报道的植物中强心甾类生物合成前体是孕烯醇酮的结果正好相反[54]。
为了找到动植物来源蟾蜍二烯酸内酯类成分生物合成途径之间的相关性,Porto 等[49]同时给蟾蜍和红海葱Scilla marilima(L.) Stearn 接种孕烯醇酮- 20-14C,结果发现孕烯醇酮是scilliroside 的良好前体,但是它没有被合成到南美蟾毒精。该实验表明Chen 等[54]实验结果可能是正确的,即在蟾蜍体内,胆固醇被代谢为孕烯醇酮的情况下,后者不能用来合成蟾蜍二烯内酯类成分。进一步,Porto 等[55]和Dmitrieva 等[56]研究结果证实了蟾蜍二烯酸内酯类的生物合成不依赖于胆固醇侧链的切割。胆固醇可能先转化为胆汁酸盐中间体,后者可以通过其他步骤转化为蟾蜍二烯内酯类成分。从蟾蜍毒液中分离出来的7α-羟基胆固醇和7β-羟基胆固醇(胆汁酸生物合成中的关键中间体)将支持这一假设[49]。另外,Fedorova等[57-58]发现哺乳动物的marinobufagenin是由胆固醇通过新型酸性胆汁酸途径合成的,而marinobufageni 与南美蟾毒精具有相似的化学结构。在新型酸性胆汁酸途径中,胆固醇侧链的切割由细胞色素P450(CYP)27A1 酶启动,该酶在肝外组织中表达,包括肾上腺[58-62]。因此,蟾蜍可能通过 一种类似于哺乳动物中marinobufagenin 的肝外酸性胆汁酸途径合成蟾蜍二烯酸内酯类成分。
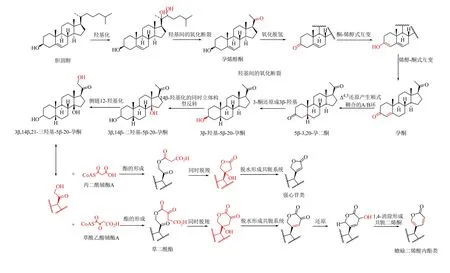
图3 蟾蜍二烯酸内酯类成分的下游生物合成途径 (植物)[50-52]Fig.3 Downstream biosynthetic pathways of bufadienolides (plant)[50-52]
孕烯醇酮在强心甾类及其相关化合物的生物合成中起着非常重要的作用[49]。Garraffo 等[63]研究结果显示,具有完整的胆固醇型侧链的胆固醇及其类固醇能够穿透到蟾蜍二烯内酯类成分生物合成的位点并且通过未知机制转化为蟾蜍二烯酸内酯类成分。孕烯醇酮在蟾蜍中作为蟾蜍烯二烯内酯类成分前体的失败原因可能是由于其不能渗透到蟾蜍烯二烯内酯类成分的生物合成位点[63]。Santa Coloma 等[64]将乙酸钠-1-14C和甲羟戊酸-5-3H接种到蟾蜍的耳后腺和肝脏,发现肝脏产生的胆固醇中含有这样2 种标记,而耳后腺产生的胆固醇不含任何标记。推测蟾蜍中用于合成的胆固醇前体主要在肝脏或肠道产生,并通过转运蛋白转移到皮肤腺和耳后腺从而发挥前体的作用。
3.2 蟾蜍二烯酸内酯类成分的生物合成途径总结与推测
如图4 所示,推测蟾蜍中蟾蜍二烯酸内酯类成分的生物合成可能分为3 个阶段。第1 阶段是类异戊二烯前体和胆固醇中间体的形成。无论是在植物中还是在蟾蜍中,蟾蜍二烯酸内酯类成分的生物合成起点都是类异戊二烯前体[56]。类异戊二烯前体经过甲羟戊酸(mevalonate,MVA)途径和2-C-甲基-D-赤藓糖醇-4-磷酸(2-C-methyl-D-erythritol-4- phosphate,MEP/DOXP)途径生成异戊焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸(dimenthylallylpyrophosphate,DMAPP)[65]。IPP 和DMAPP 经过一系列酶的作用下,生成香叶草基焦磷酸(geranyl pyrophosphate,GPP)和焦磷酸法尼酯(farnesyl pyrophosphate,FPP)[65]。两分子FPP 在鲨烯合酶(squalene synthase,SQS)的作用下合成角鲨烯(squalene)。角鲨烯为甾体化合物的前体。下一步,角鲨烯在鲨烯环氧酶(squalene epoxidase,SQE)的作用下,生成中间体2,3-氧化角鲨烯(2,3-oxiaosqualene)[65]。该中间体可启动角鲨烯的环化反应,即在2,3-氧化角鲨烯在羊毛甾醇合酶(lanosterol synthase,LS)的作用下环化成羊毛甾醇(lanosterol),其主要作用是合成甾体骨架[65-66]。最后,羊毛甾醇经过一系列酶的作用下合成酵母甾醇(zymosterol)和胆固醇[65]。
蟾蜍二烯酸内酯类成分的生物合成第2 阶段涉及胆固醇甾体母核A/B 环的脱氢异构化、母核14β-OH 或14,15-环氧化以及胆固醇侧链的修饰环合。对于这一阶段的反应机制、反应顺序以及相关酶基因的研究报道很少(图3)。第2 阶段中,蟾蜍二烯酸内酯类成分的母核A/B 环发生一系列氧化、脱氢、异构化和还原过程,并且3-羟基-5-烯结构转化为3-羟基-5-βH结构形成顺式配置的A/B 环[67]。3β-HSD 属于短链脱氢酶/还原酶超家族[68]。其催化甾体的Δ5-3-羟基构型氧化转化为Δ4-3-羰基构型。该转化反应是在2 个独立的顺序反应中进行的,在需要烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的第1 个反应中,该酶催化3β-羟基类固醇脱氢为3-氧代类固醇中间体;在第2 个反应中,还原的辅酶(仍保持附着在酶上)激活还原反应,使Δ5构型异构化为Δ4构型[67-68]。这些结果表明3β-HSD 可能在蟾蜍二烯酸内酯类成分A/B 环顺式构型的形成中发挥重要作用。相关研究表明[69-70],3β-HSD 可以催化胆固醇转化为4-cholesten-3-one,后者可以先后7α-羟基化为4-cholesten-7α-ol-3-one,这是重要的胆汁酸生物合成中间体。而胆汁酸可能是蟾蜍二烯酸内酯类成分生物合成的最重要的中间体之一[56,71]。Xu 等[67]从中华大蟾蜍中克隆了一个Bbg-3βHSD 脱氢酶,发现其能氧化孕烯醇酮和脱氢表雄酮,但却对胆固醇和谷固醇没有脱氢活性;原因可能是Bbg-3βHSD 脱氢酶的催化口袋无法容纳C27类固醇的长侧链。3β-HSD7 脱氢酶对具有Δ5-双键的3β,7β-二羟基-C27-类固醇具有高度特异性[72-73]。所以,胆固醇可能先经过CYP27A1 启动的酸性胆汁酸途径形成27-羟基胆固醇和3β-羟基-5-胆甾烯酸酯,然后胆汁酸盐被3β-HSD7 催化形成顺式配置的A/B 环[71]。
蟾蜍二烯酸内酯类成分生物合成的第3 阶段是相关基因家族对母核上多种取代基的修饰(图4)。这也是蟾蜍二烯酸内酯类成分化学结构多样性的原因。由于绝大多数的蟾蜍二烯酸内酯类成分母核结构为蟾毒灵类(I)和酯蟾毒配基类(II)。所以本文总结了这2 类母核结构的蟾蜍二烯酸内酯类成分,并根据母核上取代基的类型、数量和位置,推断它们相互间结构的生物转化关系和绘制了可能转化路线图(图5)。总结发现,蟾蜍二烯酸内酯类成分化学结构差异的原因主要是取代基的类型、数量、位置和立体异构。蟾蜍二烯酸内酯类成分的甾体母核上具有多种取代基,如羟基、环氧基、乙酰基、糖基、酮基等。因此,参与蟾蜍二烯酸内酯类成分生物合成有关的基因家族可能包括CYP450s、糖基转移酶[74](glycosyltransferases,UGTs)、酰基转移酶(acyltransferases,ATs)和脱氢酶(dehydrogenases,DHs)等。涉及的羟基化反应主要位于C-1β、3β、5β、11α、12α/β、14β、16β 和19 位;乙酰化和糖基化反应主要位于C-3β、16β 位;氧代反应主要位于在C-3、11、12 和19 位。
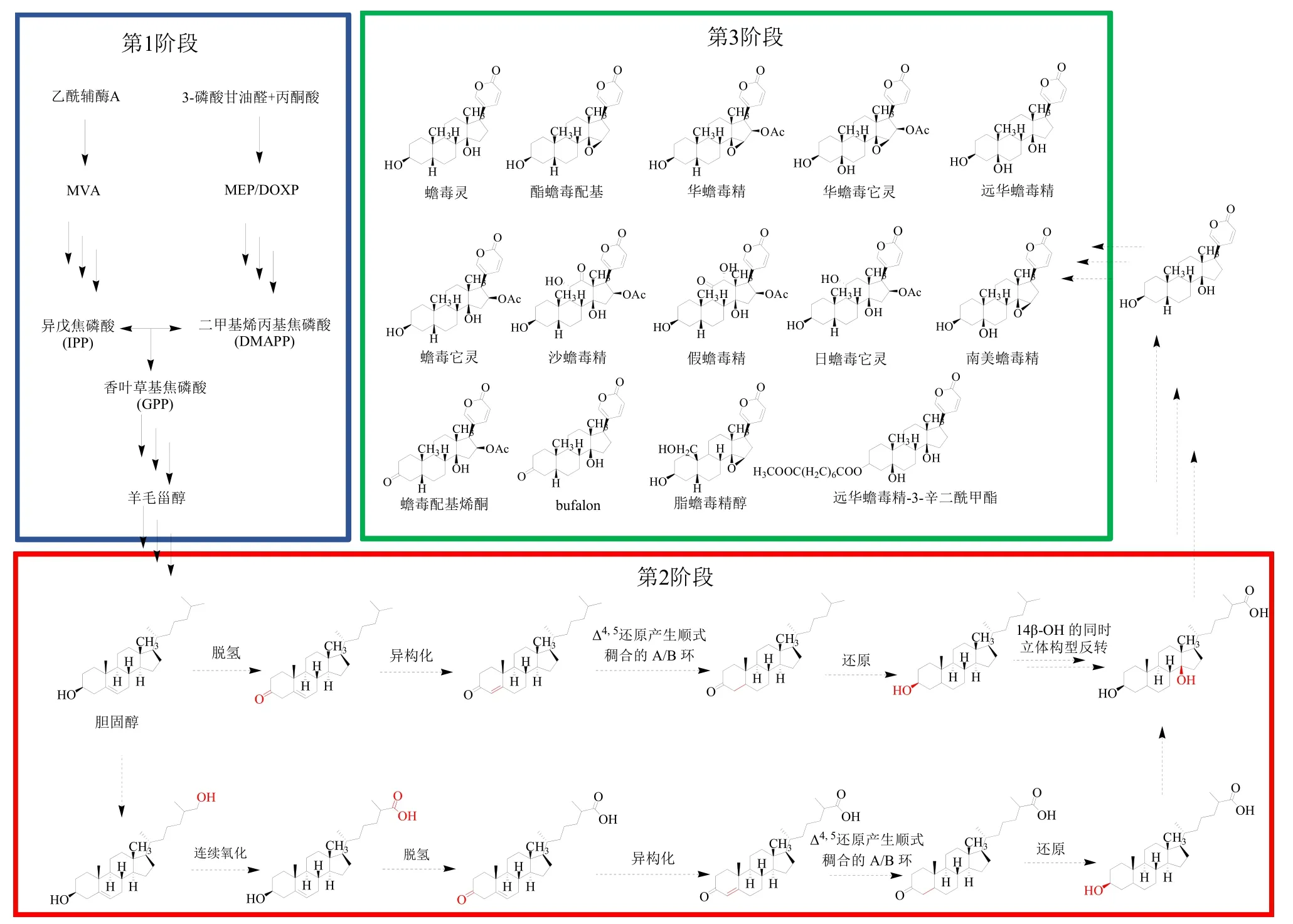
图4 蟾蜍二烯酸内酯类成分可能的生物合成途径 (蟾蜍)Fig.4 Possible biosynthetic pathways of bufadienolides (B.gararizans)

图5 蟾蜍二烯内酯类成分的生物转化路线图Fig.5 Roadmap of bufadienolides biotransformation
5β-OH、14β-OH 和14,15-环氧化的先后顺序:首先,14β-OH 和14,15-环氧化是蟾蜍二烯酸内酯类成分的特征基团,目前从自然界分离并鉴定的蟾蜍二烯酸内酯类成分都含有14β-OH 或者14,15-环氧化。其次,由于在C-5 没有羟基的蟾蜍二烯酸内酯类已经存在,所以14β-OH 或14,15-环氧化应该在5β-OH 之前[54]。而对于蟾蜍二烯内酯类成分中α- 吡喃酮环的生物合成,Porto 等[75]结果显示,蟾蜍中蟾蜍二烯酸内酯类成分的α-吡喃酮环可能直接来源于胆固醇的侧链。另外,内酯环应该是在内核氧化之后产生的[54]。最后,Chen 等[54]讨论了不同蟾蜍二烯酸内酯类成分之间生物合成的可能顺序,其推测酯蟾毒配基首先通过还原为蟾毒灵或进一步羟基化成为南美蟾毒精,接着通过相似的还原或羟基化反应,南美蟾毒精和蟾毒灵分别被代谢为远华蟾毒精。
4 总结与展望
目前,蟾酥药用资源需求量与日俱增,使得蟾蜍二烯酸内酯类成分成为研究热点。除了人工养殖蟾蜍以外,获取蟾蜍二烯酸内酯类成分的途径还包括生物转化和生物合成等。生物转化在获取天然蟾蜍类药材中不存在的蟾蜍二烯酸内酯类成分方面具有较为突出的优势。基于合成生物学原理,设计和改造微生物菌株来发酵生产天然产物,是一种极具潜力的稀有天然活性成分获取办法。迄今为止,蟾蜍二烯酸内酯类成分生物合成途径的解析已获得较大的进展。本文总结蟾蜍体内可能的蟾蜍二烯酸内酯类成分生物合成途径。推测蟾蜍中蟾蜍二烯酸内酯类成分的生物合成可能分为3 个阶段,首先是类异戊二烯前体和胆固醇中间体的形成;然后是胆固醇或胆汁酸盐甾体母核A/B 环的脱氢异构化、母核14β-OH 或14,15-环氧化以及胆固醇侧链修饰环合;最后是蟾蜍二烯酸内酯类母核上取代基的修饰,其涉及的基因家族可能包括CYP450s、UGTs、ATs 等。现阶段,蟾蜍二烯酸内酯类生物合成第2、3 阶段的反应机制、反应顺序以及相关酶基因发现的研究报道很少。随着高通量测序及组学技术发展,未来应该多学科联系攻关以推进蟾蜍二烯酸内酯类成分的合成生物学发展,革新传统的生产方式,使蟾蜍二烯酸内酯类成分的生物合成成为蟾酥药用资源可持续利用的重要途径之一。
利益冲突所有作者均声明不存在利益冲突
