接枝聚合物配基的蛋白质吸附层析
2016-03-19余林玲孙彦
余林玲,孙彦
(天津大学化工学院生物化工系,天津 300072)
接枝聚合物配基的蛋白质吸附层析
余林玲,孙彦
(天津大学化工学院生物化工系,天津 300072)
摘要:以离子交换、亲和结合和疏水性吸附为主的蛋白质吸附层析是药用蛋白质生产过程的核心技术,开发新技术和提高蛋白质吸附层析操作的分离效率(如选择性和动态吸附容量等)是该领域的主要研究目标。近年来聚合物配基接枝的层析介质由于同时具有较高的吸附容量和传质速率,得到产学界的广泛关注。本文针对聚合物配基接枝修饰的蛋白质吸附层析介质的配基化学特征、吸附和传质特性、层析分离应用和设计等方面进行评述。首先介绍不同种类的聚合物接枝介质,然后系统阐述聚合物配基化学特性对介质吸附和传质性能的影响机制,并分析上述性质对聚合物配基接枝层析介质分离特性的影响机理和应用,最后讨论和展望了高效聚合物配基接枝介质设计、开发和应用的前景。
关键词:蛋白质;吸附;层析;聚合物接枝;配基
2015-07-13收到初稿,2015-08-26收到修改稿。
联系人:孙彦。第一作者:余林玲(1987—),女,博士,讲师。
Received date: 2015-07-13.
引 言
随着基因工程等生物技术的不断发展,蛋白质的表达水平大幅提升,使得胰岛素、干扰素、生长因子、抗体等蛋白质类生物药物的广泛使用成为可能。然而蛋白质具有易失活变性、分离纯化工艺流程单元操作多等特点,医药产品又对纯度要求高,对药用蛋白质的分离纯化技术提出了极高的要求。以离子交换、亲和结合和疏水性吸附为主的蛋白质制备层析由于具有分离精度高、分离条件温和、操作简单且重复性高等特点,已成为大规模生产药用蛋白质过程中最常用和使用频率最高的一项分离纯化手段[1-2]。
为了提高蛋白质制备层析的分离性能、实现高效化生产,研究者们对蛋白质吸附层析技术中的核心——层析介质(吸附剂)不断地探索研究,开发了表面薄壳层析介质(pellicular particles)[3]、触须型层析介质(tentacle-type resins)[4-6]、流通层析介质[flow-through media[7],又称灌注层析介质(perfusion media)[8-9],包括双孔层析介质(bidisperse porous media)[10-12]和凝胶壳层层析介质(“gel in a shell”particles)[13-16]等]等层析介质。触须型层析介质等是通过改造介质基质表面的功能性配基的物理化学性质,从而提高蛋白质在介质中的平衡吸附容量[17];表面薄壳层析介质、流通层析介质等则是通过改造介质基质的基本结构,改善流动相在介质内部的流动行为以及介质的耐压性,从而提高蛋白质在介质内部的传质性能[7, 9, 14]。然而,对于层析技术而言,只有在上柱操作中的高流速下具有的较高动态吸附容量(dynamic binding capacity, DBC)才对蛋白质的分离纯化具有实际使用意义,而这则需要同时具有较高的平衡吸附容量和较快的传质速率才能实现。
近年来,以葡聚糖接枝的琼脂糖离子交换层析介质为代表的聚合物配基修饰的层析介质得到了产学界的广泛关注。相较于传统的短链配基修饰的层析介质[功能性基团通过间隔臂直接修饰在介质基质表面,图1(a)]而言,聚合物链配基修饰的层析介质[部分或全部的功能性基团位于聚合物链上,功能化的聚合物链接枝于介质基质表面,图1(b)~(e)]通常同时具有较高的平衡吸附容量和传质速率[18-23],因而也具有较高水平的DBC[24-26],极大地提升了层析操作的分离性能。由此,聚合物配基修饰的层析介质的设计和高效吸附传质机理的解析和应用也成为了蛋白质层析中的研究热点。
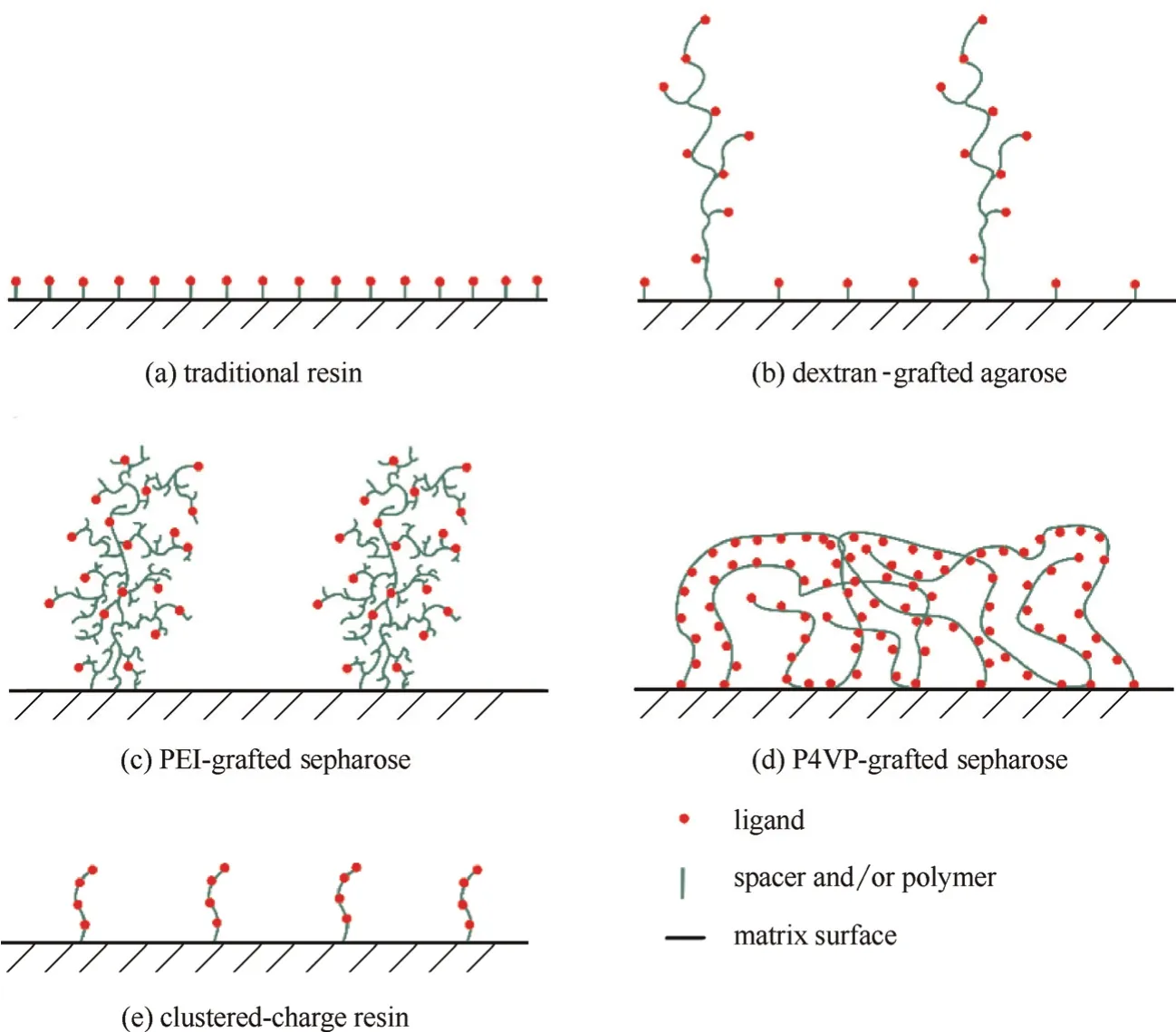
图1 蛋白质层析介质的基本结构Fig. 1 Schematic diagram of surface structures of resins for protein chromatography
本文针对蛋白质层析中聚合物配基修饰介质在近年来的研究进展进行评述,首先介绍了不同种类的聚合物配基接枝介质,然后系统阐述聚合物配基化学特征对介质的吸附和传质性能的作用机制,并分析上述性质对聚合物配基介质分离特性的影响机理,以及基于该分离特性对介质的应用进行举例说明,最后讨论聚合物配基的理性设计思路和方向,推动高效蛋白质制备层析的理论和技术发展。
1 聚合物配基化学
1.1 葡聚糖接枝介质
葡聚糖是由D-葡萄糖通过a-1,6-糖苷键形成的高分子聚合物,基本结构见图2(a)。葡聚糖通常为分支很少(<5%)的线性直链状分子[27],相对分子质量通常从4×103到600×103不等。葡聚糖具有良好的亲水性、高生物相容性和极低的非特异性吸附性能,是一种优良的蛋白质层析材料。葡聚糖可直接通过交联作为层析基质(例如Sephadex系列),1997年起GE healthcare公司将它作为层析基质表面的修饰材料,接枝到琼脂糖基质表面,从而形成了葡聚糖接枝的琼脂糖介质(Sepharose XL、Streamline XL和Capto等系列)这类商品化的聚合物配基修饰介质。
葡聚糖分子[图2(a)]内部虽然有很多羟基,但是葡聚糖链自身分子尺寸较大、在溶液中呈无规则线团状[28],使得葡聚糖链内部的羟基由于空间位阻较大,难以与介质基质表面反应。因此在接枝反应中,通常只有葡聚糖链两端的羟基与介质基质表面发生化学反应,多形成单端较少位点固定的接枝链[见图1(b)][18]。同时,由于相对分子质量较大的葡聚糖链几乎呈线状,所以接枝后在介质孔道内伸展,可形成较厚的接枝层,同时葡聚糖链灵活性较强,可在孔道内自由摆动。但由于葡聚糖链自身没有功能性基团,呈电中性,因此它在接枝到介质基质上后,还需要偶联上功能性基团(例如离子交换基团磺酸基[29],混合模式基团苯胺咪唑[20]、巯基甲基咪唑[30-31]等),才能吸附蛋白质。这种修饰方法会使得功能性基团随机分布于介质基质表面和葡聚糖链上,如图1(b) 所示,从而蛋白质可吸附于介质孔道基质表面和灵活的葡聚糖链上。这种特殊的结构使得葡聚糖接枝介质表现出了对蛋白质优良的吸附和传质性能[25, 32-39],这将在之后的章节中详细讨论。
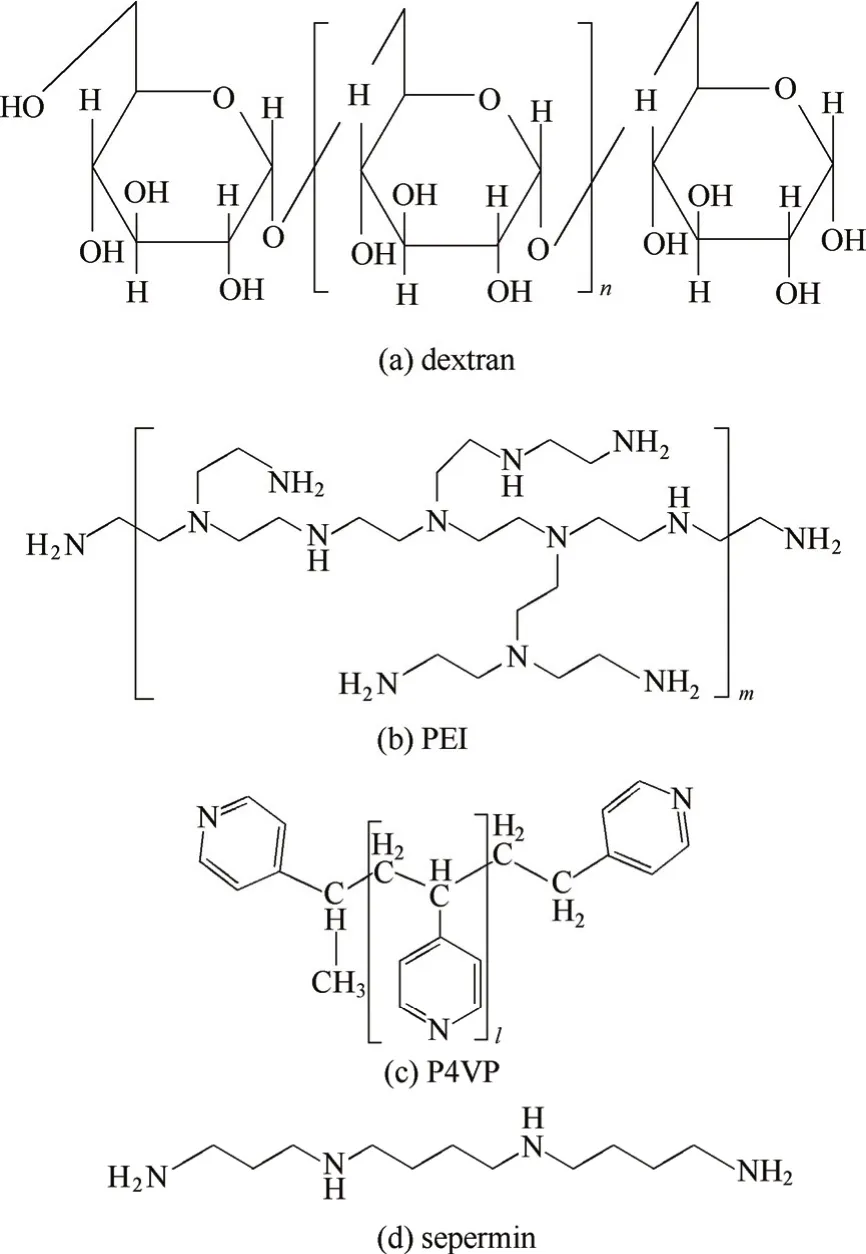
图2 聚合物链的化学结构Fig. 2 Chemical structures of grafted polymers
1.2 聚乙烯亚胺接枝介质
聚乙烯亚胺[poly(ethylenimine), PEI]是一种高分子阳离子聚电解质,通常为具有众多分支结构的长链,其基本结构见图2(b)。PEI相对分子质量通常从400到750×103不等,分子中伯、仲、叔胺的理论比例为1:2:1[40],在较宽的pH范围内都能解离带正电(在水溶液中所有氨基完全质子化后的电荷密度为23.3 mequiv.·g-1[41])。PEI由于可以可逆性吸附带负电的物质,同时又具有良好的生物相容性,因此被广泛应用于基因转移(例如PEI-DNA复合物转染等[42-43])和生物制品的分离纯化(例如提取肝素[44]、移除细菌内毒素[45]等)。近年来,研究者发现PEI有利于保持酶的活性和增加酶的稳定性,因此PEI也常被用作离子交换配基偶联于多种基质表面,应用于多种酶的固定化[46-47]和蛋白质(包括酶蛋白)的离子交换层析[23, 48-50][图1(c)]。此外,近期本课题组将PEI接枝的琼脂糖介质二次修饰(在PEI接枝链上修饰疏水基团苯甲酰基[51]、正丁基[52]等),将其应用拓展于蛋白质的混合模式层析分离中。
PEI的结构与1.1节中介绍的葡聚糖具有相似之处:两者均为相对分子质量较大的长链聚合物,具有良好的生物相容性,均在溶液中呈现无规则线团状。然而,两者又具有不同之处:PEI分子分支较多且较长、呈树枝状长链[40, 53],通常以多位点连接于介质基质表面[49][图1(c)];而葡聚糖分子分支较少且较短、呈直线性长链,通常由链末端的单位点连接于介质基质表面[18]。所以,接枝于介质基质表面的PEI链的灵活性(在孔道内的可摆动程度)低于葡聚糖[23],而且PEI接枝层的伸展性(接枝层厚度的变化程度)也低于葡聚糖接枝层(PEI接枝层不易塌缩)[21]。同时,由于PEI在溶液中的伸展状态与PEI浓度直接相关(浓度越低,结构越伸展),因此也影响了PEI接枝时的反应位点数(结构越伸展,反应位点数越多)[41, 49, 54];而葡聚糖接枝时的反应位点数与浓度基本无关(只与链末端单位点反应)。此外,由于PEI自身带正电,PEI接枝介质的离子交换基团只分布于PEI接枝层,如图1(c)所示,蛋白质只吸附于PEI接枝链上,不同于葡聚糖接枝介质中蛋白质可同时存在于介质基质表面和葡聚糖链上。因此,PEI接枝介质中,PEI接枝密度(离子交换容量)对蛋白质吸附和传质行为的影响,直接体现了介质中接枝层的作用,排除了葡聚糖接枝介质中配基分布的影响。
上述相似与不同之处也使得PEI接枝介质不但具有接枝介质的一般吸附性质(高吸附容量和高传质速率)[23],也具有自身的吸附特性(存在临界离子交换容量或临界接枝密度[23, 55]和高耐盐性[21, 51]等)。PEI接枝介质对蛋白质的吸附特性也将在之后的章节中详细讨论。
1.3 聚(4-乙烯吡啶)接枝介质
聚(4-乙烯吡啶)[poly(4-vinylpyridine), P4VP]是一种线性长链高分子聚合物,其基本结构如图2(c)所示,相对分子质量通常从4×103到160×103不等。由于吡啶基团可与蛋白质通过多种作用模式发生相互作用[56-57],且易修饰于多种基质表面,P4VP又具有生物相容性好、价格低廉等特点,所以P4VP被广泛应用于蛋白质分离领域[58-59]。近期,本课题组考虑P4VP的主链为疏水性的烷基链、短侧链为可解离带正电的吡啶基团,且其单体结构与商品化混合模式层析介质MEP-HyperCel相似,也将P4VP作为聚合物链配基接枝于琼脂糖基质上,开发了一系列混合模式层析介质[60]。
P4VP和1.2节中介绍的PEI有相似之处:两者均为相对分子质量较大的长链聚合物,具有良好的生物相容性,均在溶液中呈现无规则线团状,可与介质基质表面多位点反应,且自身带功能性基团,均可解离带正电、接枝后介质的离子交换基团只分布于接枝链上。两者的不同之处也很多:P4VP为无分支的线性长链,相对分子质量相同时其链长度远大于PEI链,分子内同时存在静电作用和疏水作用,多位点修饰后会形成相互缠绕的接枝链和结构较紧实的、较不伸展的接枝层,而固定于基质表面的吡啶基团上的胺基季胺化[58, 61],带上较多正电荷,排斥P4VP长链,使接枝层保持了一定的伸展性,不至于完全塌缩[60][图1(d)];而PEI呈树枝状长链,各个分支均带正电相互排斥,修饰于介质基质表面后形成伸展的、不易塌缩的接枝层。此外,P4VP长链中各个自由吡啶基团的可解离程度相似,离子交换基团(带电基团)均匀分布于P4VP长链中;而PEI中各个伯、仲、叔胺的解离性质差别较大、分布不均,因此离子交换基团在PEI链中分布不均 [40, 62-63]。
P4VP接枝介质的独特的接枝层形态[图1(d)]、接枝链的疏水和静电性能以及功能性基团分布[图2(c)]使其具有不同于葡聚糖接枝介质和PEI接枝介质的吸附与传质特性,例如可在500 mmol·L-1NaCl条件下对γ-球蛋白的高效吸附和对γ-球蛋白和牛血清白蛋白(bovine serum albumin,BSA)的温和洗脱等[60],这也将在之后的章节中详细讨论。
1.4 团簇型电荷修饰介质
团簇型电荷修饰介质(clustered-charge resin)是一类以寡聚氨基酸及其衍生物为功能性配基的介质,结构如图1(e)所示,可用于多种蛋白质和核酸的分离纯化[22, 64-67]。在团簇型电荷修饰介质中,通常由赖氨酸和精氨酸等碱性氨基酸五聚体的酰胺衍生物[64, 67]以及精胺[66][1,12-二氨基-4,9-二氮十二烷,结构如图2(d)所示]作为介质的离子交换配基。此类团簇型电荷配基的电荷密度较高、相对分子质量较低,呈现一种纳米级别的短链聚电荷团簇。
该聚电荷团簇短链与前文介绍的PEI链、P4VP链也有一些相同之处:均具有良好的生物相容性,均可解离带正电、接枝后介质的离子交换基团只分布于接枝链上。它们的不同之处在于:聚电荷团簇短链中各个氨基的可解离程度相似且均较高[66],因此离子交换基团均匀分布于该聚电荷团簇短链中且密度较高[64];P4VP链中离子交换基团虽分布均一但密度相对较低,而PEI链中的离子交换基团分布不均且密度相对较低[40, 62-63]。而且,聚电荷团簇短链相对分子质量较低(仅3~5个重复单元),电荷密度较高,修饰于介质基质表面后形成的接枝层很薄,短链也几乎不能在孔道内自由摆动,这与葡聚糖和PEI接枝后的自由长链和较厚接枝层有着较大区别。
这种局部电荷密度较高的团簇结构使得团簇型电荷修饰介质具有不同于传统短链配基介质和葡聚糖、PEI接枝介质、P4VP接枝介质等长链配基接枝介质的吸附与传质特性[67],例如,对蛋白质局部电荷密度变化的高敏感性[64],这也将在之后的章节中详细阐述。
2 吸附性能
2.1 吸附平衡
正如在前文中提到的,当离子交换容量相近或略高时,葡聚糖接枝介质、PEI接枝介质这两类长链聚合物配基修饰介质以及团簇型电荷修饰介质这类短链聚合物配基对蛋白质的平衡吸附容量均高于传统短链配基介质[18, 21, 23, 29, 39, 55, 64, 66, 68-70]。例如,
商品化传统短链配基修饰的琼脂糖介质SP Sepharose FF(介质基质为6%的交联琼脂糖Sepharose FF,其表面修饰磺酸基,配基密度200 mmol·L-1)在10 mmol·L-1的磷酸-磷酸氢二钠溶液中(pH 6.5)对溶菌酶的平衡吸附容量仅为230 mg·ml-1,而同样条件下的商品化葡聚糖接枝的琼脂糖介质SP Sepharose XL(介质基质为Sepharose FF,其表面接枝葡聚糖后再修饰磺酸基,配基密度220 mmol·L-1)高达 400 mg·ml-1[19]。类似的,PEI接枝的琼脂糖介质FF-PEI-L260也比其相对应的商品化传统短链配基修饰琼脂糖介质Q Sepharose FF对BSA的平衡吸附容量高20%以上[21];P4VP接枝的琼脂糖介质FF-P4VP-190,比其对应的商品化传统短链配基修饰琼脂糖介质MEP-HyperCel对γ-球蛋白和BSA的平衡吸附容量高20%以上[60];五聚赖氨酸接枝的琼脂糖介质(pentalysinamide aldehyde agarose)对Ca2+缺失α-乳清蛋白的吸附平衡容量可由传统分散型赖氨酸配基修饰琼脂糖介质(lysinamide aldehyde agarose)的0.24 μmol·ml-1提升至0.48 μmol·ml-1[64]。
2.1.1 长链聚合物配基修饰介质的高吸附容量原理目前普遍认为葡聚糖、PEI、P4VP等长链聚合物配基修饰介质对多种蛋白质表现出的高水平的平衡吸附容量是源于接枝于介质基质表面的长链聚合物可在介质孔道内自由摆动,并形成了伸展的接枝层[29, 36, 68]。因此,蛋白质更易接近聚合物长链上的功能性基团(例如带电基团),可灵活地与其发生相互作用,使蛋白质的吸附位点从传统短链配基修饰介质的吸附平面[图1(a)]拓展到整个接枝层的三维吸附空间[20, 23, 39][图1(b)、(c)],提高了功能性基团的利用率,从而有利于蛋白质吸附,提升平衡吸附容量。P4VP这种线性长链聚合物配基,在修饰密度较高时,由于分子极长,即使链间和链内缠结后,形成的接枝层还是较伸展,可以提供一定的三维吸附空间[图1(d)],同时功能性基团数量多、作用方式多样,因此也十分有利于蛋白质吸附,接枝介质具有较高的平衡吸附容量[60]。
(1)葡聚糖接枝介质
由于葡聚糖接枝的离子交换层析介质中的葡聚糖接枝链分支少、接枝层较伸展、接枝层的电荷密度较低,因此在加盐屏蔽电荷后,接枝层极易塌缩,并屏蔽吸附位点,不利于蛋白质吸附,导致介质吸附容量随盐浓度提升而急剧降低,即对盐浓度的敏感程度极高(高于传统短链配基介质)[21, 29, 39]。同时,由于葡聚糖接枝链相对分子质量较大、分支少、易塌缩,在修饰疏水性基团[20]后,接枝链通过疏水相互作用缠绕结合,接枝层快速塌缩,无法提供三维吸附空间,会丧失聚合物配基接枝介质的吸附优势。因此,葡聚糖接枝介质不适宜拓展到疏水相互作用层析和混合模式层析中。
(2)PEI接枝介质
由于PEI接枝链不但分支众多、接枝层不如葡聚糖层伸展,而且PEI接枝层的电荷密度较高,在加盐屏蔽电荷后,接枝层不易塌缩,因此PEI接枝介质对盐浓度的敏感程度较低(低于传统短链配基介质和葡聚糖接枝介质,在200~300 mmol·L-1NaCl时还能保持较高的吸附容量)[21]。同时,由于PEI链较葡聚糖链不易塌缩,在PEI接枝链上修饰疏水基团苯甲酰基[51]、正丁基[52]等形成的PEI接枝的混合模式层析介质,也可形成一定厚度的接枝层,以提供一定的三维吸附空间,有利于蛋白质吸附,在较宽的盐浓度范围(0~2 mol·L-1NaCl)具有较高的吸附容量[51-52]。
(3)P4VP接枝介质
P4VP接枝介质则正如之前提到的,在修饰密度较高时,由于介质中的功能性基团数量多、与蛋白质的作用方式多种,因此可在不同条件下以不同作用模式吸附蛋白质;同时较厚的接枝层结构较紧实,在高盐下也不易塌缩,可以提供一定的三维吸附空间,有利于较宽盐浓度范围(0~500 mmol·L-1NaCl)的蛋白质吸附[60]。另外,P4VP接枝介质和PEI接枝的混合模式层析介质类似,其接枝层厚度与pH密切相关(pH越低,基团解离程度越高,链越伸展,接枝层越厚),对蛋白质可进入的孔道和三维吸附空间影响极大,也造成了不同pH条件下蛋白质的吸附差异性较大[51-52, 60],为混合模式层析分离提供良好基础,这将在下一节中详细讨论。
2.1.2 团簇型电荷修饰介质的高吸附容量原理 然而,对于团簇型电荷修饰介质而言,由于其聚合物配基链较短,无法形成伸展的接枝层,因此几乎不存在有利于蛋白质吸附的三维吸附空间。但团簇型电荷修饰介质中具有多个纳米级聚电荷团簇[图1(e)],该团簇局部电荷密度高,内部电荷分布均一,易于与多种蛋白质中的用以蛋白-蛋白或者蛋白-核酸识别的保守区域(该区域通常也具有高电荷密度[71],例如α-乳清蛋白的两个亚基交界处是特异性结合Ca2+离子域的保守区域,富含天冬氨酸,局部带大量负电荷)的多位点发生相互作用,蛋白质与吸附位点间的结合部位更多,具有更高的初始结合亲和性[64, 67],从而强化了蛋白质吸附行为,提高平衡吸附容量。但是,当蛋白质的保守区域发生改变(例如α-乳清蛋白的保守区域被Ca2+饱和、细胞色素b5保守区域被突变但净电荷不变)时,团簇型电荷修饰介质的平衡吸附容量急剧下降,表现出了对蛋白质局部结构变化的高度敏感性[64]。由于研究者们主要关注团簇型电荷修饰介质的吸附平衡容量及其对蛋白质结构的敏感性[22, 64-67],而对蛋白质的传质速率研究较少,所以对团簇型电荷接枝介质就不再讨论其吸附动力学。
2.2 吸附动力学
2.2.1 离子交换层析介质 在具有较高平衡吸附容量的同时,蛋白质在葡聚糖接枝介质和PEI接枝介质这两类长链聚合物配基修饰的离子交换层析介质中传质速率也远高于传统短链配基介质[18-21, 23, 29, 37-38, 55, 68, 70, 72-74]。在相同条件下,溶菌酶在商品化葡聚糖接枝介质SP Sepharose XL中的有效孔扩散速率(De)可达其在商品化传统介质SP Sepharose FF中的4.7倍[19]。溶菌酶在葡聚糖接枝的琼脂糖介质SP-T40-X-S6B中甚至高达自由溶液扩散速率(D0)的10倍[18, 29],而蛋白质在多孔介质中的De值通常应低于D0值。BSA在PEI接枝的琼脂糖介质FF-PEI-L740中的De值也达到了其在自由溶液中D0值的1.6倍[21]。
研究者们对造成蛋白质在上述两类长链聚合物配基修饰的离子交换层析介质中的De/D0>1现象的原理进行了深入探究,目前较为广泛接受的有如下几种机理[75]。一类是,在上述长链聚合物配基修饰介质中存在表面扩散[包括“活性跳跃(activated jump)”[19, 32, 76]和“链传递(chain delivery effect)”[21, 23, 55]等机理],表面扩散对传质的贡献使得通过孔扩散模型拟合得到的De值(集总的动力学参数)偏大。另一类是,在上述介质中存在电动效应等非扩散机理(包括电泳[20, 77]、电渗[77]、静电耦合[29]等)促进孔内传质,也使得拟合得到的De值偏大。总的来说,研究者们均认为在上述介质中存在孔扩散之外的传质机理对介质内部的蛋白质传递过程做出较大贡献。由于这些机理已在近期的综述文章[75]中进行了详细的评述,所以在此不再赘述,只简要地阐述其中的链传递机理。
(1)链传递机理

图3 链传递机理[75]Fig. 3 Schematic drawing for mechanism of chain delivery effect[75](The blue circles represent adsorbed protein, and the dashed dark green lines as well as the faded circles represent the grafted polymers chains with adsorbed proteins after swing. The dashed pink boxes highlight the sites for the “relay”/delivery of protein. Other symbols in this figure are the same as in Fig.1)
链传递机理可通俗地用“救火列队作用(bucket brigade effect)”[35]描述,是一种特殊的表面扩散,只存在于具有可自由摆动的聚合物链配基修饰介质中[21, 23, 55, 70, 75],机理如图3所示。本课题组在研究蛋白质PEI接枝介质中传质速率在临界接枝密度(临界离子交换容量)处快速增加[23, 55][图4(a)]时,对这个机理进行了详细阐述。简而言之,灵活的长链聚合物配基可在孔道内自由摆动,当入口处的聚合物长链上吸附蛋白质后,聚合物长链会在朝向介质中心的化学势和由被吸附蛋白质为媒介的链间作用驱动下,向孔道内部摆动,将该蛋白质运送并转移到邻近的聚合物长链上(图3),类似于在火灾时救火人员列队传递接力水桶。由此,吸附相蛋白质通过自身为媒介,通过聚合物长链的摆动,被动地在介质表面的吸附位点上移动。

图4 蛋白质在接枝介质中的传质速率(De/D0值)随聚合物链密度的变化Fig. 4 Effective diffusivities of BSA and γ-globulin on polymer-grafted resins with different grafting densities (a) PEI-grafted resins[23, 55]; (b) dextran-grafted resins[20]
(2)链密度对链传递作用的影响
由于PEI接枝介质中吸附位点只存在于PEI接枝链上,所以当接枝密度较低(低于临界接枝密度)时,相邻两条链之间的距离太远,无法发生链传递作用,蛋白质在介质中的传质以孔扩散为主,传质较慢;而当接枝密度较高(高于临界接枝密度)时,相邻两条链之间的距离较近,链传递作用极大地促进了吸附相蛋白质传质,蛋白质在介质中的传质速率大幅提升。因此,PEI接枝介质中存在的临界接枝密度,即为保证蛋白质能在相邻两条链能发生链传递作用的距离。上述机理也是造成图4(a)中PEI接枝介质的De/D0值在临界离子交换容量处快速增加的原因[23]。然而,由于葡聚糖接枝介质中吸附位点既存在于聚合物接枝链上,又存在于介质基质表面的短链配基上,所以接枝链密度和配基密度(接枝链配基和短链配基总密度)都对链传递作用有影响。而在离子交换层析介质的常用配基密度范围(140~150 mmol·L-1),由于两类配基间距离较近,聚合物接枝链与基质表面的短链配基(或聚合物接枝链)间始终能发生链传递作用、促进传质,从而葡聚糖接枝介质的De/D0值几乎随着接枝量线性增加[20][图4(b)]。
(3)盐浓度对链传递作用的影响
由于链传递作用是一种特殊的表面扩散,因此增加盐浓度减弱蛋白质与吸附位点间的静电相互作用,有利于链传递作用发生。同时,表面扩散通量与吸附相蛋白质密度正相关,链传递作用对总传质速率的贡献也与介质对蛋白质的吸附容量正相关。这两方面的影响很好地解释了葡聚糖接枝介质和PEI接枝介质的传质速率随盐浓度变化趋势不同的现象(图5)。葡聚糖接枝介质的吸附容量对盐浓度十分敏感,随盐浓度增加急剧下降[36, 39],因此,链传递作用的传质通量急剧下降,导致了总传质速率随盐浓度增加而下降的趋势[19, 29]。PEI接枝介质的吸附容量对盐浓度变化不敏感,上述两方面影响共同作用于链传递作用,所以总传质速率呈现随盐浓度增加先上升后下降的趋势[21]。

图5 蛋白质在接枝介质中的传质速率(De/D0值)随盐浓度的变化(数据源于文献[19, 21, 29])Fig. 5 Effective diffusivities of proteins on polymer-grafted resins at different salt concentrations (data from references[19, 21, 29])
2.2.2 混合模式层析介质 对于P4VP和疏水基二次修饰的PEI这两类具有疏水性的长链聚合物配基修饰的混合模式层析介质而言,其接枝链形态(灵活性和伸展性等)与接枝量、疏水基修饰密度、缓冲液盐浓度和pH等密切相关,这也使得其传质速率呈现更加复杂的趋势[60]。其传质速率对缓冲液条件的依赖性也为这两类介质在层析柱上的操作灵活性和适用范围广泛性提供了良好的基础,这也将在下一节中详细讨论。
3 蛋白质层析
由于上述几种聚合物配基修饰的介质均具有较高的吸附容量和传质速率,因此它们都常具有较高的DBC[24-25, 36, 60, 69-70, 72-74],被用于多种蛋白质的分离纯化工艺流程中[78-81]。例如,葡聚糖接枝的离子交换层析介质Q Sepharose XL由于对BSA和单克隆抗体均具有较高的DBC,而这两种蛋白质的单体和聚集体又可以通过梯度洗脱分离,因此Q Sepharose XL可用于批量化分离BSA和单克隆抗体的单体和聚集体[82];类似的,Capto Q对12×103聚乙二醇修饰的BSA的DBC高达50 mg·ml-1(流速50 cm·h-1)和37 mg·ml-1(流速250 cm·h-1),实现了乙二醇化的BSA的高效分离[83];另外,Tugcu 等[79]利用市面上的多种商品化层析介质设计了多种单克隆抗体纯化方案,通过对比纯化方案和优化纯化流程发现,Q Sepharose XL由于DBC较高,其层析操作是单克隆抗体纯化的最优流程中不可或缺的重要环节。此外,这些聚合物配基修饰介质的特殊的吸附性能造成其具有各自的层析分离特性,见表1。
3.1 葡聚糖接枝的离子交换层析介质
如前所述,葡聚糖接枝的离子交换层析介质的吸附容量和传质速率均随着盐浓度增加而急剧下降,这导致DBC具有极高的盐浓度敏感性(在约150 mmol·L-1NaCl条件下就几乎不吸附蛋白质)[29, 36-37, 84]。因此,该类介质适宜于在低盐条件下(0~100 mmol·L-1NaCl)的蛋白质吸附;同样,约150 mmol·L-1NaCl可作为洗脱条件,赋予了它较传统短链配基介质的低盐高效洗脱优势[72]。所以,葡聚糖接枝的离子交换层析介质通常用于0~150 mmol·L-1NaCl缓冲液条件下的蛋白质高容量吸附与低盐高效洗脱[85-86](表1)。
3.2 PEI接枝的离子交换层析介质
相比之下,PEI接枝的离子交换层析介质的DBC对盐浓度的敏感程度则较低[24](远低于传统短链配基介质和葡聚糖接枝介质,这是由于其链内静电作用不易被屏蔽、接枝层不易塌缩所致,例如FF-PEI-L740在200 mmol·L-1NaCl时还能同时具有较高的吸附容量和传质速率[21]因而具有超过60 mg·ml-1的DBC[24])。所以,PEI接枝的离子交换层析介质适用于较宽盐浓度范围(0~300 mmol·L-1NaCl)内的蛋白质吸附,其洗脱条件为约400 mmol·L-1NaCl[21, 24](表1)。同时,PEI接枝的离子交换层析介质对流动相反离子种类也有较高的偏好性(不同的亲和能力),例如FF-PEI-L680对反离子的偏好性随SCN- 3.3 PEI接枝的混合模式层析介质 表1 蛋白质层析介质的分离特性Table 1 Separation characteristics of resins for protein chromatography 在接枝密度较低的PEI接枝的离子交换层析介质的PEI链上,修饰疏水基团苯甲酰基[51]、正丁基[52]等,形成了PEI接枝的混合模式层析介质,也显示了很好的蛋白质层析分离应用前景。例如,苯甲酰基修饰的PEI接枝的混合模式层析介质B160-PEI330在0.5~2 mol·L-1NaCl条件下可保持恒定的吸附容量和传质速率,因此可提供较高的DBC,并表现了极好的耐盐性;该介质在pH 3条件下可以对BSA和γ-球蛋白完全洗脱,而在pH 4时BSA和γ-球蛋白的洗脱收率差异极大(8% v.s. 71%)[51]。上述耐盐性和洗脱差异性可应用于从含有白蛋白的混合物(例如血清)中分离抗体(表1)。但接枝密度较高的PEI接枝的混合模式层析介质,则由于其在低pH洗脱时的链内静电排斥作用太强,形成接近刚性的接枝链,将孔道堵塞,阻碍蛋白质从介质内部扩散出来,造成洗脱回收率较低,因而不适用于混合模式层析分离[51]。 3.4 P4VP接枝的混合模式层析介质 P4VP接枝的混合模式层析介质则由于具有特殊的接枝链形态以及接枝链形态(厚度和带电性等)对pH的高度敏感性,可在pH 4~4.5实现对蛋白质的完全洗脱[60],比现今报道过的大多数混合模式层析的洗脱条件都温和[57, 88-89],这也显示了P4VP接枝介质在结构敏感型蛋白质的层析分离中的应用前景(表1)。 3.5 团簇型电荷修饰介质 如2.1节中所述,团簇型电荷接枝介质对具有保守的高电荷密度区域的蛋白质的吸附具有较高的吸附容量和选择性,且吸附容量对蛋白质结构具有极高的敏感性[64, 87],对盐浓度也极敏感[66],因此团簇型电荷接枝介质可用于此类蛋白质的高分辨率分离(表1)。 通过上述对不同种类的聚合物配基的化学特征、吸附和传质特性、层析分离特性和应用的系统阐述,总结了聚合物配基影响介质的蛋白质层析行为的作用机理。这些讨论也为今后的聚合物配基的理性设计提供了研究思路和方向。例如,对于长链聚合物配基而言,灵活、伸展的聚合物长链配基更有利于蛋白质的三维吸附和链传递作用,所以新型层析配基的理性设计应重点开发相对分子质量较大、分支较少、电荷密度较低的长链聚合物配基以提升吸附容量和传质速率。电荷密度较高的长链聚合物配基,虽不灵活,但耐盐性高,所以适用于高盐条件下的分离纯化。具有疏水性的长链聚合物配基则需谨慎考虑其疏水性和带电性的比例以及疏水性和伸展性的关系(聚合物链上疏水基团增加一方面会增加蛋白质吸附位点总数,另一方面会造成链缠绕、接枝层塌缩、掩蔽吸附位点、减少可被蛋白质利用的吸附位点),使这类聚合物配基适用于蛋白质混合模式吸附层析。而对于团簇型短链配基而言,电荷密度越高、电荷分布越均一的团簇型电荷配基更有利于对具有保守的高电荷密度区域的蛋白质的高分辨率吸附。此外,蛋白质层析的聚合物链配基研究还有很多不足,例如葡聚糖接枝介质中功能性基团的分布(葡聚糖接枝链配基和基质表面短链配基的分布)对吸附和传质的影响仍不清楚;团簇型短链配基的相对分子质量和带电基团在短链中的分布(团簇短链自身的电荷密度)对吸附和传质的影响,团簇型短链配基能否拓展到混合模式吸附层析,团簇型短链配基能否应用于更广泛的蛋白质高分辨率分离等问题仍需研究。最后,利用分子模拟方法研究和解析表面聚合物配基结合蛋白质的分子传递(链传递行为),将为聚合物配基设计提供理论基础,进一步推动蛋白质吸附层析技术的发展。 References [1] KARLSSON E, HIRSH I. Ion exchange chromatography[M]// JANSON J C. Protein Purification: Principles, High Resolution Methods, and Applications. 3rd ed. New Jersey: John Wiley & Sons Inc., 2011: 93-94. [2] BONNERJEA J, OH S, HOARE M, et al. Protein purification: the right step at the right time [J]. Nature Biotechnology, 1986, 4(11): 954-958. [3] SUN Y, PACEK A, NIENOW A, et al. Fabrication and characterisation of a novel pellicular adsorbent customised for the effective fluidised bed adsorption of protein products [J]. Biotechnology and Bioprocess Engineering, 2001, 6(6): 419-425. [4] MÜLLER W. New ion exchangers for the chromatography of biopolymers [J]. Journal of Chromatography A, 1990, 510(1): 133-140. [5] JANZEN R, UNGER K K, MÜLLER W, et al. Adsorption of proteins on porous and non-porous poly(ethyleneimine) and tentacle-type anion exchangers [J]. Journal of Chromatography A, 1990, 522(1): 77-93. [6] CORBETT R, CARTA G, ISKRA T, et al. Structure and protein adsorption mechanisms of clean and fouled tentacle-type anion exchangers used in a monoclonal antibody polishing step [J]. Journal of Chromatography A, 2013, 1278: 116-125. [7] AFEYAN N B, GORDON N F, MAZSAROFF I, et al. Flow-through particles for the high-performance liquid chromatographic separation of biomolecules: perfusion chromatography [J]. Journal of Chromatography, 1990, 519(1): 1-29. [8] REGNIER F E. Perfusion chromatography [J]. Nature, 1991, 350(6319): 634-635. [9] AFEYAN N B, FULTON S P, GORDON N F, et al. Perfusion chromatography: an approach to purifying biomolecules [J]. Nature Biotechnology, 1990, 8(3): 203-206. [10] ZHANG M, SUN Y. Cooperation of solid granule and solvent as porogenic agents novel porogenic mode of biporous media for protein chromatography [J]. Journal of Chromatography A, 2001, 922(1/2):77-86. [11] SHI Y, SUN Y. Fabrication and characterization of a novel biporous spherical adsorbent for protein chromatography [J]. Chromatographia, 2003, 57(1/2): 29-35. [12] WU L, BAI S, SUN Y. Development of rigid bidisperse porous microspheres for high-speed protein chromatography [J]. Biotechnology Progress, 2003, 19(4): 1300-1306. [13] BOSCHETTI E, GUERRIER L, GIROT P, et al. Preparative highperformance liquid chromatographic separation of proteins with HyperD ion-exchange supports [J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1995, 664(1): 225-231. [14] LAWRENCE E, WEAVER J, CARTA G. Protein adsorption on cation exchangers: comparison of macroporous and gel-composite media [J]. Biotechnology Progress, 1996, 12(3): 342-355. [15] HUNTER A K, CARTA G. Protein adsorption on novel acrylamidobased polymeric ion-exchangers (Ⅳ): Effects of protein size on adsorption capacity and rate [J]. Journal of Chromatography A, 2002, 971(1/2): 105-116. [16] WANG M, XU J, ZHOU X, et al. Modification with DEAE-dextran, an alternative way to prepare anion-exchange monolithic column with lower pressure drop [J]. Biochemical Engineering Journal, 2007, 34(1): 76-81. [17] MÜLLER E. Properties and characterization of high capacity resins for biochromatography [J]. Chemical Engineering & Technology, 2005, 28(11): 1295-1305. [18] STONE M C, CARTA G. Protein adsorption and transport in agarose and dextran-grafted agarose media for ion exchange chromatography [J]. Journal of Chromatography A, 2007, 1146(2): 202-215. [19] UBIERA A R, CARTA G. Radiotracer measurements of protein mass transfer: kinetics in ion exchange media [J]. Biotechnology Journal, 2006, 1(6): 665-674. [20] YU L L, SHI Q H, SUN Y. Effect of dextran layer on protein uptake to dextran-grafted adsorbents for ion-exchange and mixed-mode chromatography [J]. Journal of Separation Science, 2011, 34(21): 2950-2959. [21] YU L L, SUN Y. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅱ): Effect of ionic strength [J]. Journal of Chromatography A, 2013, 1305: 85-93. [22] DANIELS C R, KISLEY L, KIM H, et al. Fluorescence correlation spectroscopy study of protein transport and dynamic interactions with clustered-charge peptide adsorbents [J]. Journal of Molecular Recognition, 2012, 25(8): 435-442. [23] YU L L, TAO S P, DONG X Y, et al. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅰ): A critical ionic capacity for drastically enhanced capacity and uptake kinetics [J]. Journal of Chromatography A, 2013, 1305: 76-84. [24] LIU N, YU L L, SUN Y. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅳ): Dynamic adsorption and elution behaviors [J]. Journal of Chromatography A, 2014, 1362: 218-224. [25] HART D S, HARINARAYAN C, MALMQUIST G, et al. Surface extenders and an optimal pore size promote high dynamic binding capacities of antibodies on cation exchange resins [J]. Journal of Chromatography A, 2009, 1216(20): 4372-4376. [26] HARINARAYAN C, MUELLER J, LJUNGLÖF A, et al. An exclusion mechanism in ion exchange chromatography [J]. Biotechnology and Bioengineering, 2006, 95(5): 775-787. [27] ZHANG X, WANG J C, LACKI K M, et al. Construction by molecular dynamics modeling and simulations of the porous structures formed by dextran polymer chains attached on the surface of the pores of a base matrix: characterization of porous structures [J]. The Journal of Physical Chemistry B, 2005, 109(44): 21028-21039. [28] GÜNER A. Unperturbed dimensions and the theta temperature of dextran in aqueous solutions [J]. Journal of Applied Polymer Science, 1999, 72(7): 871-876. [29] STONE M C, TAO Y, CARTA G. Protein adsorption and transport in agarose and dextran-grafted agarose media for ion exchange chromatography: effect of ionic strength and protein characteristics [J]. Journal of Chromatography A, 2009, 1216(20): 4465-4474. [30] LIU T, LIN D Q, LU H L, et al. Preparation and evaluation of dextran-grafted agarose resin for hydrophobic charge-induction chromatography [J]. Journal of Chromatography A, 2014, 1369: 116-124. [31] LIU T, LIN D Q, ZHANG Q L, et al. Characterization of immunoglobulin adsorption on dextran-grafted hydrophobic charge-induction resins: cross-effects of ligand density and pH/salt concentration [J]. Journal of Chromatography A, 2015, 1396: 45-53. [32] THÖMMES J. Investigations on protein adsorption to agarosedextran composite media [J]. Biotechnology and Bioengineering, 1999, 62(3): 358-362. [33] TAO Y, ALMODOVAR E X P, CARTA G, et al. Adsorption kinetics of deamidated antibody variants on macroporous and dextran-grafted cation exchangers (Ⅲ): Microscopic studies [J]. Journal of Chromatography A, 2011, 1218(44): 8027-8035. [34] TAO Y, CARTA G, FERREIRA G, et al. Adsorption of deamidated antibody variants on macroporous and dextran-grafted cation exchangers (Ⅰ): Adsorption equilibrium [J]. Journal of Chromatography A, 2011, 1218(11): 1519-1529. [35] TAO Y, CARTA G, FERREIRA G, et al. Adsorption of deamidated antibody variants on macroporous and dextran-grafted cation exchangers (Ⅱ): Adsorption kinetics [J]. Journal of Chromatography A, 2011, 1218(11): 1530-1537. [36] LENHOFF A M. Protein adsorption and transport in polymerfunctionalized ion-exchangers [J]. Journal of Chromatography A, 2011, 1218(49): 8748-8759. [37] BOWES B D, LENHOFF A M. Protein adsorption and transport in dextran-modified ion-exchange media (Ⅱ): Intraparticle uptake and column breakthrough [J]. Journal of Chromatography A, 2011, 1218(29): 4698-4708. [38] BOWES B D, LENHOFF A M. Protein adsorption and transport in dextran-modified ion-exchange media (Ⅲ): Effects of resin charge density and dextran content on adsorption and intraparticle uptake [J]. Journal of Chromatography A, 2011, 1218(40): 7180-7188. [39] BOWES B D, KOKU H, CZYMMEK K J, et al. Protein adsorption and transport in dextran-modified ion-exchange media (Ⅰ): Adsorption [J]. Journal of Chromatography A, 2009, 1216(45): 7774-7784. [40] DICK C R, HAM G E. Characterization of polyethylenimine [J]. Journal of Macromolecular Science: Part A—Chemistry, 1970, 4(6): 1301-1314. [41] THEODOSSIOU I, THOMAS O R T. DNA-induced inter-particle cross-linking during expanded bed adsorption chromatography: impact on future support design [J]. Journal of Chromatography A, 2002, 971(1/2): 73-86. [42] ZHENG M, ZHONG Z, ZHOU L, et al. Poly(ethylene oxide) grafted with short polyethylenimine gives DNA polyplexes with superior colloidal stability, low cytotoxicity, and potent in vitro gene transfection under serum conditions [J]. Biomacromolecules, 2012, 13(3): 881-888. [43] UNSAL E, BAHAR T, TUNCEL M, et al. DNA adsorption onto polyethylenimine-attached poly(p-chloromethylstyrene) beads [J]. Journal of Chromatography A, 2000, 898(2): 167-177. [44] YANG T, HUSSAIN A, BAI S, et al. Positively charged polyethylenimines enhance nasal absorption of the negatively charged drug, low molecular weight heparin [J]. Journal of Controlled Release, 2006, 115(3): 289-297. [45] HANORA A, PLIEVA F M, HEDSTRÖM M, et al. Capture of bacterial endotoxins using a supermacroporous monolithic matrix with immobilized polyethyleneimine, lysozyme or polymyxin B [J]. Journal of Biotechnology, 2005, 118(4): 421-433. [46] BOLIVAR J M, ROCHA-MARTÍN J, MATEO C, et al. Stabilization of a highly active but unstable alcohol dehydrogenase from yeast using immobilization and post-immobilization techniques [J]. Process Biochemistry, 2012, 47(5): 679-686. [47] TORRES R, PESSELA B C C, MATEO C, et al. Reversible immobilization of glucoamylase by ionic adsorption on sepabeads coated with polyethyleneimine [J]. Biotechnology Progress, 2004, 20(4): 1297-1300. [48] MURAKAMI Y, RIKIMRA S, SUGO K, et al. Preparation of polyethylenimine-hydroxyapatite and its chromatographic use [J]. Journal of Liquid Chromatography & Related Technologies, 2009, 32(3): 407-417. [49] GONZÁLEZ N P, STRUMIA M C, ALVAREZ I C I. Macroporous bead modification with polyethylenimines of different molecular weights as polycationic ligands [J]. Journal of Applied Polymer Science, 2010, 116(5): 2857-2865. [50] ZHANG R, LI Q, GAO Y, et al. Hydrophilic modification gigaporous resins with poly(ethylenimine) for high-throughput proteins ion-exchange chromatography [J]. Journal of Chromatography A, 2014, 1343: 109-118. [51] LIU N, WANG Z, LIU X, et al. Characterization of novel mixed-mode protein adsorbents fabricated from benzoyl-modified polyethyleneimine-grafted sepharose [J]. Journal of Chromatography A, 2014, 1372: 157-165. [52] YU L, LIU N, HONG Y, et al. Protein adsorption and chromatography on novel mixed-mode resins fabricated from butyl-modified poly(ethylenimine)-grafted sepharose [J]. Chemical Engineering Science, 2015, 135: 223-231. [53] GE J, MIN S H, KIM D, et al. Selective gene delivery to cancer cells secreting matrix metalloproteinases using a gelatin/polyethylenimine/ DNA complex [J]. Biotechnology and Bioprocess Engineering, 2012, 17(1): 160-167. [54] TAO Y, CHEN N, CARTA G, et al. Modeling multicomponent adsorption of monoclonal antibody charge variants in cation exchange columns [J]. AIChE Journal, 2012, 58(8): 2503-2511. [55] HONG Y, LIU N, WEI W, et al. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅲ): Comparison between different proteins [J]. Journal of Chromatography A, 2014, 1342: 30-36. [56] BURTON S C, HARDING D R K. High-density ligand attachment to brominated allyl matrices and application to mixed mode chromatography of chymosin [J]. Journal of Chromatography A, 1997, 775(1/2): 39-50. [57] ZHAO G, DONG X Y, SUN Y. Ligands for mixed-mode protein chromatography: principles, characteristics and design [J]. Journal of Biotechnology, 2009, 144(1): 3-11. [58] CAO J, PAN X, HUANG W, et al. Synthesis of cationic poly(4-vinylpyridine)-functionalized colloidal particles by emulsion polymerization with reactive block copolymer for protein adsorption [J]. Journal of Colloid and Interface Science, 2012, 381(1): 137-142. [59] YANG R, LIU Y, WANG Y. Hydroxyethylcellulose-graft-poly (4-vinylpyridine) as a novel, adsorbed coating for protein separation by CE [J]. Electrophoresis, 2009, 30(13): 2321-2327. [60] LI Y, SUN Y. Poly(4-vinylpyridine): a polymeric ligand for mixed-mode protein chromatography [J]. Journal of Chromatography A, 2014, 1373: 97-105. [61] JERMAKOWICZ-BARTKOWIAK D, KOLARZ B N. Poly(4-vinylpyridine) resins towards perrhenate sorption and desorption [J]. Reactive and Functional Polymers, 2011, 71(2): 95-103. [62] NAGAYA J, HOMMA M, TANIOKA A, et al. Relationship between protonation and ion condensation for branched poly(ethylenimine) [J]. Biophysical Chemistry, 1996, 60(1/2): 45-51. [63] KOKUFUTA E. Colloid titration behavior of poly(ethyleneimine) [J]. Macromolecules, 1979, 12(2): 350-351. [64] FU J Y, BALAN S, POTTY A, et al. Enhanced protein affinity and selectivity of clustered-charge anion-exchange adsorbents [J]. Analytical Chemistry, 2007, 79(23): 9060-9065. [65] CHEN W H, FU J Y, KOURENTZI K, et al. Nucleic acid affinity of clustered-charge anion exchange adsorbents: effects of ionic strength and ligand density [J]. Journal of Chromatography A, 2011, 1218(2): 258-262. [66] DHAMANE S, RUIZ-RUIZ F, CHEN W H, et al. Spermine Sepharose as a clustered-charge anion exchange adsorbent [J]. Journal of Chromatography A, 2014, 1324: 135-140. [67] KISLEY L, CHEN J, MANSUR A P, et al. Unified superresolution experiments and stochastic theory provide mechanistic insight into protein ion-exchange adsorptive separations [J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(6): 2075-2080. [68] TAO Y, CARTA G. Rapid monoclonal antibody adsorption on dextran-grafted agarose media for ion-exchange chromatography [J]. Journal of Chromatography A, 2008, 1211(1-2): 70-79. [69] ALMODOVAR E X P, GLATZ B, CARTA G. Counterion effects on protein adsorption equilibrium and kinetics in polymer-grafted cation exchangers [J]. Journal of Chromatography A, 2012, 1253: 83-93. [70] LIU N, YU L, SUN Y. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅴ): Complicated effects of counterions [J]. Journal of Chromatography A, 2015, 1404: 44-50. [71] GILL D S, ROUSH D J, WILLSON R C. Presence of a preferred anion-exchange binding site on cytochrome b5: structural and thermodynamic considerations [J]. Journal of Chromatography A, 1994, 684(1): 55-63. [72] BOWES B D, TRAYLOR S J, TIMMICK S M, et al. Insights into protein sorption and desorption on dextran-modified ion-exchangemedia [J]. Chemical Engineering & Technology, 2012, 35(1): 91-101. [73] SHI Q H, JIA G D, SUN Y. Dextran-grafted cation exchanger based on superporous agarose gel: adsorption isotherms, uptake kinetics and dynamic protein adsorption performance [J]. Journal of Chromatography A, 2010, 1217(31): 5084-5091. [74] PEREZ-ALMODOVAR E X, WU Y, CARTA G. Multicomponent adsorption of monoclonal antibodies on macroporous and polymer grafted cation exchangers [J]. Journal of Chromatography A, 2012, 1264: 48-56. [75] YU L, ZHANG L, SUN Y. Protein behavior at surfaces: orientation, conformational transitions and transport [J]. Journal of Chromatography A, 2015, 1382: 118-134. [76] HUBBUCH J, LINDEN T, KNIEPS E, et al. Mechanism and kinetics of protein transport in chromatographic media studied by confocal laser scanning microscopy (Ⅰ): The interplay of sorbent structure and fluid phase conditions [J]. Journal of Chromatography A, 2003, 1021(1/2): 93-104. [77] DZIENNIK S R, BELCHER E B, BARKER G A, et al. Nondiffusive mechanisms enhance protein uptake rates in ion exchange particles [J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(2): 420-425. [78] JONES M, HEAD M W, CONNOLLY J G, et al. Purification of normal cellular prion protein from human platelets and the formation of a high molecular weight prion protein complex following platelet activation [J]. Biochemical and Biophysical Research Communications, 2005, 335(1): 48-56. [79] TUGCU N, ROUSH D J, GÖKLEN K E. Maximizing productivity of chromatography steps for purification of monoclonal antibodies [J]. Biotechnology and Bioengineering, 2008, 99(3): 599-613. [80] SUN G, PALMER A F. Preparation of ultrapure bovine and human hemoglobin by anion exchange chromatography [J]. Journal of Chromatography B, 2008, 867(1): 1-7. [81] PEDERSEN L, MOLLERUP J, HANSEN E, et al. Whey proteins as a model system for chromatographic separation of proteins [J]. Journal of Chromatography B, 2003, 790(1/2): 161-173. [82] SUDA E J, THOMAS K E, PABST T M, et al. Comparison of agarose and dextran-grafted agarose strong ion exchangers for the separation of protein aggregates [J]. Journal of Chromatography A, 2009, 1216(27): 5256-5264. [83] PABST T M, BUCKLEY J J, RAMASUBRAMANYAN N, et al. Comparison of strong anion-exchangers for the purification of a PEGylated protein [J]. Journal of Chromatography A, 2007, 1147(2): 172-182. [84] YAO Y, LENHOFF A M. Pore size distributions of ion exchangers and relation to protein binding capacity [J]. Journal of Chromatography A, 2006, 1126(1/2): 107-119. [85] STABY A, JENSEN I H. Comparison of chromatographic ionexchange resins (Ⅱ): More strong anion-exchange resins [J]. Journal of Chromatography A, 2001, 908(1/2): 149-161. [86] STABY A, SAND M B, HANSEN R G, et al. Comparison of chromatographic ion-exchange resins (Ⅲ): Strong cation-exchange resins [J]. Journal of Chromatography A, 2004, 1034(1/2): 85-97. [87] KISLEY L, CHEN J, MANSUR A P, et al. High ionic strength narrows the population of sites participating in protein ion-exchange adsorption: a single-molecule study [J]. Journal of Chromatography A, 2014, 1343: 135-142. [88] XIA H F, LIN D Q, WANG L P, et al. Preparation and evaluation of cellulose adsorbents for hydrophobic charge induction chromatography [J]. Industrial & Engineering Chemistry Research, 2008, 47(23): 9566-9572. [89] GAO D, LIN D Q, YAO S J. Mechanistic analysis on the effects of salt concentration and pH on protein adsorption onto a mixed-mode adsorbent with cation ligand [J]. Journal of Chromatography B, 2007, 859(1): 16-23. Foundation item: supported by the National Natural Science Foundation of China (21236005). Adsorptive protein chromatography with grafted polymeric ligands YU Linling, SUN Yan Abstract:Adsorptive protein chromatography, mostly based on ion exchange, affinity binding and hydrophobic interactions, is the key technology in the large-scale production of therapeutic proteins. The development of novel technology as well as improvement of chromatographic separation efficiency, such as dynamic binding capacity and selectivity, is generally the main objective of fundamental studies on protein chromatography. Recently, polymeric ligand-modified matrices have been developed and widely studied due to the findings that some of them not only possess high equilibrium adsorption capacity but also high uptake rate. This review is devoted to an overview of the polymeric ligands for protein chromatography. Different kinds of polymeric ligands are first introduced. This is followed by the effects and functional mechanisms of the polymeric ligand chemistry on protein adsorption equilibria, uptake kinetics as well as separation performance of the ligand-modified matrices. Applications of the matrices based on the mechanisms are then illustrated to offer insight into the design of new polymeric ligands. Finally, a perspective for further development and fundamental studies on polymeric ligand-based protein chromatography is discussed. Key words:protein; adsorption; chromatography; polymer grafting; ligand Corresponding author:Prof. SUN Yan, ysun@tju.edu.cn 基金项目:国家自然科学基金项目(21236005)。 中图分类号:TQ 033 文献标志码:A 文章编号:0438—1157(2016)01—0140—12 DOI:10.11949/j.issn.0438-1157.20151120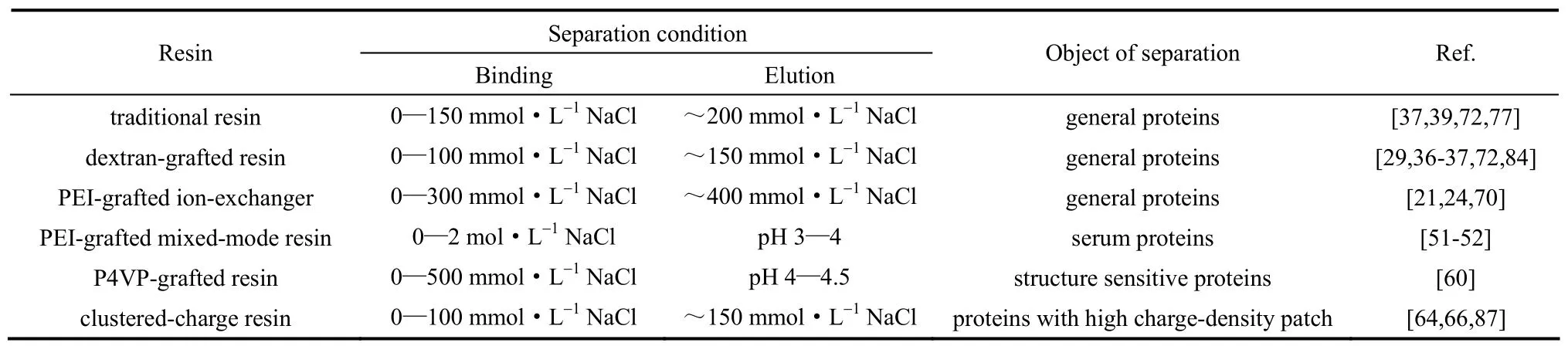
4 展 望
(Department of Biochemical Engineering and Key Laboratory of Systems Bioengineering of the Ministry of Education, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China)
