2种藜芦属植物化学成分及其抗真菌活性研究
2021-08-05温鼎声
余 茜,温鼎声,慧
广东药科大学临床药学院,广东 广州 510006
Veratrum viridAlt.和藜芦Veratrum nigrumL.均为百合科(Liliaceae)藜芦属VeratrumL.植物。V.virid主要分布在北美,通过文献检索发现,目前尚无相关文献报道;藜芦别名为黑藜芦、山葱,多年生的草本植物,环境适应性强,在我国各地均有分布[1-2];味苦、辛,性寒,有毒,归肝、肺、胃经。藜芦入药的历史可上溯到《神农本草经》列“下品”,通常认为其有涌吐风痰、清热解毒、杀虫疗疮的功效,用于治疗中风痰壅、喉痹、不通、癫痫等,外用治疥廯、秃疮。《全国中草药汇编》中记载其具有祛痰、催吐、杀虫功能。甾体生物碱的基本骨架类型主要包括4 类:西藜芦碱型(cevine type)、介藜芦胺型(jervine type)、茄次碱型(solanidine type)和维藜芦碱类(verazine type)[3-5]。这类生物碱具体光学活性和显著的生理效应,如抗肿瘤、免疫调节、抗病毒、增强心肌收缩力、降血压等[6-9]。藜芦属植物的主要成分为甾体生物碱,总称藜芦碱[10-12]。本研究拟发现不同地理位置分布的2 种藜芦属植物化学成分的异同,为这2 种藜芦属植物的进一步开发利用提供科学依据。
在抗真菌活性指导下,对藜芦属植物V.virid甲醇提取部位进行了化学成分的研究,分离得到了5个甾体生物碱类化合物和5 个二苯乙烯苷类化合物,分别鉴定为 rubivirine-3-O-β-glucopyranoside(1)、veratrosine(2)、veratramine(3)、pseudojervine( 4 )、 rubivirine ( 5 )、 resveratrol 3,4′-O,O′- di-β-D-glucopyranoside(6)、mulberroside A(7)、resveratrol 4′-O-β-D-glucopyranoside(8)、resveratrol 3-O-β-D-glucopyranoside(9)、oxyresveratrol-2-O- β-D-glucopyranoside(10)。其中化合物1 为新化合物,命名为virinidine;化合物5~10 为首次从该属植物中分离得到。抗真菌试验结果表明,这10 个化合物对真菌均不具有抑制活性,其半数抑制浓度(IC50)值均大于20 μg/mL。
同时,本课题采用“酸溶碱沉”的方法富集藜芦甲醇提取物中的生物碱。对各个分离层进行抗真菌活性筛选,其中氯仿层对新生隐球菌Canidia neoformansATCC 90113 和克柔念珠菌C.krusei ATCC6258 都具有较强的抑制活性,IC50值均小于8 μg/mL。本课题选择氯仿层为研究目标,对氯仿层进行系统的化学成分研究。从中分离得到了9 个甾体生物碱类化合物,分别鉴定为2、3、4、5、verussurinine(11)、veralosidine(12)、jervine(13)、γ-chaconine(14)、germidine(15)。其中化合物5和14 为首次从该属植物中得到。采用纸片扩散法评价化合物的抑真菌活性,结果显示化合物14 对新生隐球菌和克柔念珠菌都具有较好的抑制活性,IC50分别为4.1、19.8 μg/mL。并且在100 μmol/L 浓度下对4 株人肿瘤细胞都不具有抑制活性。
1 仪器与材料
Bruker Advance DPX-400 型超导核磁共振仪(德国Bruker 公司);Perkin Elmer spectrum 100 FT-IR 红外光谱仪(美国Perkin Elmer 公司);Hewlett-Packard HP-8453 型紫外可见光光谱仪测定(美国Hewlett-Packard 公司);柱色谱填料:正相硅胶(230~400 目,美国Baker 公司);反相填充材料(RP18,40 μm,美国Baker 公司);薄层色谱正相硅胶为铝板F254(230~400 目,美国Baker 公司);RP18F254S 反相薄层硅胶为玻璃片(德国Merck 公司);显色剂为碘化铋钾;MH 琼脂平板(青岛海博生物);药敏纸片(北京天坛生物制品所);MEM培养基、胎牛血清(美国Gibco 公司);二氧化碳培养箱(日本Sanyo 公司);多功能酶标仪(美国Thermo 公司);倒置荧光显微镜(日本Olympus 公司);MTT(上海翌圣生物科技公司);两性霉素B(10 mg,批号1397-89-3)、阿霉素(10 mg,批号246-818-3),美国Sigma 公司。
藜芦属植物V.viridAlt.于美国加利福尼亚,药材经美国密西西比大学李兴从教授鉴定,凭证标本(NP No.81927)存放在美国密西西比大学国家天然产物研究中心。藜芦样品于2017年4月购于安徽普仁中药饮片有限公司,生产批号140422。药材经安徽中医药大学刘守金教授鉴定分别为百合科藜芦属植物藜芦V.nigrumL.,凭证标本(131579)存放在广东药科大学。
真菌菌株:白色念珠菌C.albicansATCC 90028)、光滑念珠菌C.glabrataATCC 90030、克柔念珠菌C.kruseiATCC 6258、烟曲霉菌Aspergillus fumigatusATCC 90906 和新生隐球菌C.neoformansATCC 90113,美国密西西比大学提供。
肿瘤细胞:人黑色素瘤SK-MEL 细胞、人口腔表皮样癌KB 细胞、人乳腺癌BT-549 细胞、人卵巢癌SK-OV-3 细胞由美国密西西比大学提供。
2 提取与分离
藜芦属植物V.virid(500 g)用甲醇在室温下浸渍提取3 次,每次使用5 L 甲醇提取12 h,合并提取液,在40 ℃的温度下减压浓缩成浸膏,得到甲醇提取部位。甲醇提取部位抑制新生隐球菌的IC50为1.5 μg/mL。将甲醇提取部位(4.0 g)通过HP-20 柱色谱分离,用甲醇-水(10∶0→0∶10)梯度洗脱,经薄层检测合并为6 个流分(Fr.A~F)。其中Fr.B(704 mg)经反相硅胶柱色谱分离,甲醇-水(2∶8→10∶0)梯度洗脱,经薄层色谱检测合并为6 个流分(Fr.2A~2F)。Fr.2C(175.9 mg)再经反相硅胶柱色谱分离,用乙腈-水(1∶9→2∶8)梯度洗脱,得到化合物6(37.6 mg)和7(8.5 mg)。Fr.2D(56.5 mg)经硅胶柱色谱分离,用氯仿-甲醇(5∶1→3∶1)梯度洗脱,得到化合物8(5 mg)。Fr.D(1.7 g)经硅胶柱色谱分离,氯仿-甲醇(6∶1→4∶1)梯度洗脱,经薄层色谱检测合并为4 个流分(Fr.3A~3D)。Fr.3B(432.7 mg)经硅胶柱色谱分离,氯仿-甲醇梯度洗脱(5∶1→3∶1),得到化合物1(6.1 mg)、3(6.7 mg)、4(2.5 mg)、5(23.3 mg)。Fr.3C(332.6 mg)经反相硅胶柱色谱分离,用甲醇-水(6∶4→10∶0)梯度洗脱,得到化合物2(20.8 mg)和9(29 mg)。Fr.3D(138.8 mg)经反相硅胶柱色谱分离,用甲醇-水(6∶4→10∶0)梯度洗脱,得到化合物10(67.3 mg)。
藜芦的干燥根茎465.8 g,粉碎,用甲醇在室温下浸渍提取2 次,每次使用4.6 L 甲醇提取12 h,合并提取液,在40 ℃的温度下减压浓缩成浸膏,得到甲醇提取物45 g。甲醇的提取物加入5%的酒石酸溶解(酒石酸的用量112.5 g),滤过,滤液(酒石酸层)用乙醚脱脂3 次(乙醚、滤液比例为0.5∶1),合并乙醚,减压回收,得乙醚层(3.1 g)。用50%的氨水调pH 10,用氯仿萃取3 次[氯仿-滤液(1∶1)],合并氯仿层,减压回收,得氯仿层(1.5 g)。滤渣用正丁醇萃取3 次[正丁醇-滤液(1∶1)],合并正丁醇层,减压回收,得正丁醇层(2.4 g)。甲醇提取物、乙醚层、氯仿层、正丁醇层分别测试抗真菌活性,结果显示,氯仿层具有抑制新型隐球菌、克柔念珠菌和白色念珠菌的活性,IC50值分别小于8 μg/mL。本课题选择氯仿层为研究目标,对氯仿层进行系统的化学成分分离,从中发现天然的抗菌活性化合物。将氯仿部位(1.5 g)通过反相柱色谱分离,乙腈-水(0∶100→100∶0)洗脱溶剂,经薄层检测合并为12 个流分(Fr.A′~L′)。其中流分Fr.B′和 Fr.C′抑制新生隐球菌的 IC50值均小于0.8 μg/mL。Fr.B′(30.4 mg)和Fr.C′(75.2 mg)合并经硅胶柱色谱分离,氯仿-甲醇(98∶2→70∶30)梯度洗脱,经薄层检测合并为11 个流分(Fr.2A′~2K′),其中Fr.2J′为化合物3(7.4 mg)。Fr.2K′(200.5 mg)通过硅胶柱色谱分离,氯仿-甲醇(9∶1→8∶2)梯度洗脱,经薄层检测合并为7 个流分(Fr.3A′~3G′),其中流分Fr.3E′经重结晶得到化合物5(5.2 mg)。Fr.I′(450.8 mg)与Fr.J′(447.7 mg)合并通过硅胶柱色谱分离,氯仿-甲醇(98∶2→7∶3)梯度洗脱,经薄层色谱检测合并为10 个流分(Fr.4A′~4J′)。合并Fr.4D′(11.1 mg)、Fr.4E′(25.7 mg)、Fr.4F′(14.3 mg)、和Fr.4G′(24.4 mg)通过硅胶柱色谱分离(50 cm×1.5 cm,25.0 g),用氯仿-甲醇梯度洗脱(9∶1→6∶4),得到化合物12(2.8 mg)和13(3.4 mg)。Fr.2K′(548.3)通过硅胶柱色谱分离(60 cm×3 cm,50.0 g),用氯仿-甲醇(9∶1→6∶4)梯度洗脱,经薄层色谱检测合并为7 个流分(Fr.5A′~5G′),合并Fr.5F′(21.2)、Fr.5G′(22.8)和Fr.5H′(137.0)通过硅胶柱色谱分离,氯仿-甲醇(98∶2→8∶2)梯度洗脱,经薄层色谱检测合并为9 个流分(Fr.6A′~6N′)。其中流分Fr.6B′为化合物2(4 mg),Fr.6F′经重结晶得到化合物11(7.5 mg)和15(5.6 mg)。合并Fr.6K′(16.4 mg)和Fr.6L′(40.7 mg),通过硅胶柱色谱分离,氯仿-甲醇(9∶1→8∶2)梯度洗脱,得到化合物4(5.8 mg)和14(3.1 mg)。
3 结构鉴定
化合物1:白色粉末,碘化铋钾反应呈阳性,ESI-MS 显示其准分子离子峰为m/z592 [M+H]+,表明该化合物的相对分子质量为591;结合其HR-ESI-MS 给出的 [M+H]+峰m/z592.391 1(计算值 592.384 4),可以确定该化合物的分子式为C33H53NO8,不饱和度为8。250 (3.50);3360, 1630, 1060 吸收显示结构中有羟基和双健的存在。
化合物1 在1H-NMR(400 MHz, CD3OD)谱中显示化合物有3 个甲基峰信号δH0.88 (d,J= 6.6 Hz), 0.98 (s) 和1.05 (d,J= 6.6 Hz);4 个连氧质子信号δH3.49 (dd,J= 4.3, 7.7 Hz), 3.51 (m), 3.67 (d,J= 10.0 Hz), 3.70 (d,J= 10.0 Hz);1 个环内双键质子信号δH5.31 (brs)。13C-NMR (100 MHz, CD3OD) 和DEPT 谱中显示化合物1 共含有33 个碳,分别归属为3 个甲基碳、11 个亚甲基碳、16 个次甲基碳和3个季碳(表1)。在低磁场区域可以观察到1 个双键碳信号δC122.5 (C), 142.1 (CH);1 个葡萄糖的碳信号δC102.4 (CH), 75.1 (CH), 78.0 (CH), 70.5 (CH), 77.8 (CH), 62.8 (CH2);3 个连氧碳信号δC79.7 (CH), 71.8 (CH), 62.7 (CH2);3 个连氮碳信号δC75.7 (CH), 61.7 (CH), 57.3 (CH2);在高场可以观察到3个甲基碳信号δC19.8 (CH3), 18.8 (CH3), 18.6 (CH3)。通过HSQC 谱观察到δH4.39 (d,J= 7.8 Hz) 与δC102.4 存在相关,确定其为葡萄糖端基质子信号。把化合物1 苷元部分1H-和13C-NMR 数据和已知化合物rubivirine 相比[13],确定其苷元的结构为rubivirine。

表1 化合物1 的1H-NMR 和13C-NMR 数据 (400/100MHz, CD3OD)Table 1 1H-NMR and 13C-NMR data of compound 1 (400/100MHz, CD3OD)
从化合物 1 的平面结构进一步通过1H-1H COSY 和HMBC 谱的解析得以确认。1H-1H COSY 谱中观察到H-1/H-2/H3,H-6/H-7/H-8,H-11/H-12, H-14/H-15/H-16,H-17/H-20/H-22,H-23/H-24/H-25存在相关(图1)。HMBC 谱中可以观察到Me-19与C-5、C-10、C-1 存在相关;Me-21 与C-17、C-18存在相关;Me-27 与C-26、C-24、C-25 存在相关,这些相关峰证实了各甲基的连接位置;同时,HMBC谱中H-12 与C-9、C-11、C-13 存在相关,H-18 与C-13 存在相关,证实了化合物1 苷元部分的2 个羟基分别位于C-12 和C-18 上;此外,H-6 与C-5、C-7、C-8、C-10 存在相关表明双键位于C-5、C-6 之间。
为了确定化合物1 糖基部分的结构,取化合物2 mg 经2 mol/L HCl 水解,糖部分与标准糖共薄层分析,确定所连接的糖为葡萄糖。对水解后的糖进行衍生化,气相分析其衍生化产物,与标准糖β-D-葡萄糖的衍生化产物的保留时间进行比对,确定其为D-葡萄糖。在HMBC 谱(图1)中,端基质子(δ4.39)和苷元的C-3(δ79.7)有远程相关,表明葡萄糖连在3 位。1H-NMR 中,糖的端基质子的偶合常数为7.8 Hz,表明其相对构型为β-葡萄糖基。
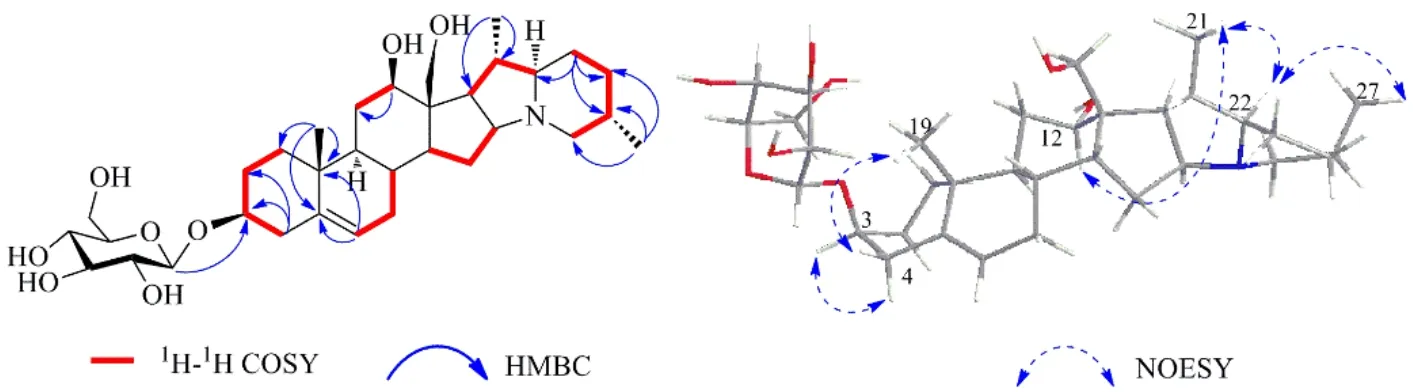
图1 化合物1 的关键1H-1H COSY、HMBC、NOESY 相关信号Fig.1 Key 1H-1H COSY, HMBC and NOESY correlations for compound 1
化合物1 的相对构型通过H-4 的自旋偶合裂分和NOESY 谱(图1)来加以确定。H-4β (2.49, t,J= 10.5 HZ) 自旋出偶合裂分为三重峰,说明J3,4β≈J4α,4β,其中J4α,4β=10.5 Hz 为同碳氢之间的偶合,因此,J3,4β=10.5 Hz 为相邻碳上的氢均处于直立键(Jax-ax)产生的偶合,可以推测出H-3 为α 构型,C-3 的羟基为β 构型。同时,在NOESY 谱中H-3 与H-4α 以及H-4β 与Me-19 相关,证实了Me-19 为β构型。H-4α 与H-9、H-12 与H-9 和Me-21、H-22 与Me-21、H-22 与Me-27 的相关,证实了H-9、H-12、H-22、Me-21 和Me-27 为α 构型,C-12 的羟基为β 构型。综合以上信息,化合物1 的结构鉴定为rubivirine- 3-O-β-glucopyranoside。结构见图2。根据SciFinder Scholar 数据库检索,确定化合物1 为新化合物。

图2 化合物1 的结构Fig.2 Structure of compound 1
化合物2:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z: 572 [M+H]+;1H-NMR (400 MHz, CD3OD)δ:7.20 (1H, d,J=7.5 Hz, H-16), 7.11 (1H, d,J=7.5 Hz, H-15), 5.51 (1H, brd,J=4.0 Hz, H-6), 2.33 (3H, s, H-18), 1.43 (3H, d,J=7.0 Hz, H-21), 1.14 (3H, s, H-19), 0.94 (3H, d,J=6.5 Hz, H-27);13C-NMR (100 MHz, CD3OD)δ: 146.0 (C-5), 145.1 (C-14), 144.1 (C-17), 138.8 (C-12), 134.4 (C-13), 126.9 (C-16), 123.5 (C-6), 122.0 (C-15), 102.9 (C-1′), 78.3 (C-3′), 77.3 (C-5′), 75.5 (C-2′), 70.2 (C-3), 69.6 (C-23), 69.4 (C-4′), 67.8 (C-22), 63.1 (C-6′), 59.0 (C-9), 53.1 (C-26), 43.6 (C-24), 42.9 (C-8), 39.7 (C-1), 39.2 (C-4), 36.4 (C-10), 31.9 (C-7, 25), 31.4 (C-20), 30.8 (C-11), 29.6 (C-2), 21.4 (C-21), 19.0 (C-19, 27), 16.6 (C-18)。以上数据与文献对照基本一致[10],故鉴定化合物2 为veratrosine。
化合物3:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z: 410 [M+H]+;1H-NMR (400 MHz, CD3OD)δ:7.09 (1H, d,J=7.5 Hz, H-16), 7.05 (1H, d,J=7.5 Hz, H-15), 5.50 (1H, brd,J=4.0 Hz, H-6), 2.35 (3H, s, H-18), 1.45 (3H, d,J=7.0 Hz, H-21), 1.15 (3H, s, H-19), 0.97 (3H, d,J=6.5 Hz, H-27);13C-NMR (100 MHz, CD3OD)δ:145.1 (C-17), 143.3 (C-14), 142.7 (C-5), 141.7 (C-12), 132.6 (C-13), 125.0 (C-16), 121.3 (C-6), 120.4 (C-15), 72.4 (C-3), 69.6 (C-23), 66.8 (C-22), 57.3 (C-9), 50.7 (C-26), 41.2 (C-24, 8), 41.1 (C-4), 37.8 (C-1, 10), 36.6 (C-20), 34.2 (C-25), 30.6 (C-7), 30.0 (C-11), 29.8 (C-2), 22.3 (C-21), 19.5 (C-19), 18.2 (C-27), 16.9 (C-18)。以上数据与文献对照基本一致[11],故鉴定化合物3 为veratramine。
化合物4:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z: 588 [M+H]+;1H-NMR (400 MHz, CD3OD)δ:5.34 (1H, brd,J=6.5 Hz, H-6), 3.57 (1H, m, H-3), 3.16 (3H, s, H-23), 1.12 (3H, d,J=6.8 Hz, H-21), 1.05 (3H, s, H-19), 0.80 (3H, d,J=6.5 Hz, H-27);13C-NMR (100 MHz, CD3OD)δ:205.5 (C-11), 146.0 (C-13), 142.1 (C-5), 132.3 (C-14), 121.2 (C-6), 100.9 (C-1′), 84.3 (C-17), 78.6 (C-5′), 76.7 (C-3′), 75.4 (C-23), 76.6 (C-2′), 72.4 (C-3), 70.2 (C-4′), 65.6 (C-22), 61.8 (C-9), 61.5 (C-6′), 53.3 (C-26), 43.2 (C-14), 41.1 (C-4), 40.0 (C-20), 38.6 (C-24), 38.2 (C-8), 37.6 (C-10), 36.0 (C-1), 31.2 (C-25), 31.0 (C-2), 30.9 (C-16), 30.2 (C-7), 30.2 (C-7), 23.6 (C-15), 18.6 (C-27), 18.2 (C-19), 12.9 (C-18), 10.2 (C-21)。以上数据与文献对照基本一致[12],故鉴定化合物4 为pseudojervine。
化合物5:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z: 430 [M+H]+;1H-NMR (400 MHz, CD3OD)δ:5.31 (1H, brs, H-6), 3.70 (1H, d,J= 10.0 Hz, H-18a), 3.57 (1H, d,J= 10.0 Hz, H-18b), 3.51 (1H, m, H-3), 3.47 (1H, dd,J=7.7, 4.5 Hz, H-12), 1.05 (3H, d,J=6.5 Hz, H-27), 0.98 (3H, s, H-19), 0.87 (3H, d,J=6.6 Hz, H-21);13C-NMR (100 MHz, CD3OD)δ:142.1 (C-5), 122.5 (C-6), 75.7 (C-22), 72.7 (C-3), 70.5 (C-12), 57.8 (C-17), 57.3 (C-4), 51.6 (C-26), 50.6 (C-9), 49.9 (C-14), 46.2 (C-13), 38.5 (C-1), 38.0 (C-10), 37.1 (C-20), 33.0 (C-24), 32.7 (C-25), 32.5 (C-11), 31.6 (C-8), 30.6 (C-7), 30.0 (C-2), 29.0 (C-23), 22.2 (C-15), 19.8 (C-19), 18.8 (C-27), 18.6 (C-21), 12.4 (C-21), 11.0 (C-18)。以上数据和文献对照基本一致[13],故鉴定化合物5 为rubivirine。
化合物6:白色粉末;ESI-MSm/z: 551 [M-H]−;1H-NMR (400 MHz, CD3OD)δ: 7.25 (2H, d,J=8.5 Hz, H-2′, 6′), 7.07 (2H, d,J=8.5 Hz, H-3′, 5′), 7.04 (1H, d,J=16.0 Hz, H-β), 6.91 (1H, d,J=16.0 Hz, H-α), 6.81 (1H, brs, H-2), 6.60 (1H, brs, H-6), 6.48 (1H, t,J=2.0 Hz, H-19);13C-NMR (100 MHz, CD3OD)δ: 159.0 (C-3), 158.1 (C-5), 157.3 (C-4′), 139.7 (C-1), 131.7 (C-1′), 127.3 (C-2′, 6′), 128.1 (C-β), 126.8 (C-α), 116.5 (C-3′, 5′), 107.2 (C-6), 105.9 (C-4), 101.0 (C-1′′′), 100.7 (C-1′′), 76.7 (C-5′′, 5′′′), 76.5 (C-3′′, 3′′′), 73.5 (C-2′′, 2′′′), 70.0 (C-4′′, 4′′′), 61.1 (C-6′′, 6′′′)。将化合物的核磁数据与文献报道的数据[14]进行对比,鉴定化合物6 为resveratrol 3,4′-O,O′-di-β-D-glucopyranoside。
化合物7:白色粉末;ESI-MSm/z: 567 [M-H]−;1H-NMR (400 MHz, CD3OD)δ: 7.43 (1H, d,J=8.5 Hz, H-6′), 7.31 (1H, d,J=16.0 Hz, H-β), 6.94 (1H, d,J= 16.0 Hz, H-α), 6.76 (1H, brs, H-2), 6.63 (1H, brs, H-6), 6.61 (1H, brs, H-3′), 6.58 (1H, dd,J=8.5, 2.4 Hz, H-5′), 6.45 (1H, t,J=2.0 Hz, H-4);13C-NMR (100 MHz, CD3OD)δ:159.0 (C-3), 158.1 (C-5, 4′), 155.8 (C-2′), 141.0 (C-1), 127.0 (C-β), 126.2 (C-α), 123.6 (C-6′), 118.8 (C-1′), 108.0 (C-6), 106.8 (C-5′), 105.8 (C-4), 103.5 (C-3′), 102.6 (C-2), 100.9 (C-1′′′), 100.7 (C-1′′), 76.7 (C-5′′, 5′′′), 76.5 (C-3′′, 3′′′), 73.4 (C-2′, 2′′′), 69.9 (C-4′′, 4′′′), 61.1 (C-6′′, 6′′′)。将化合物的核磁数据与文献报道的数据[15]进行对比,鉴定化合物7 为mulberroside A。
化合物8:白色粉末;ESI-MSm/z: 389 [M-H]−;1H-NMR (400 MHz, CD3OD)δ: 7.44 (2H, d,J= 8.5 Hz, H-2′, 6′), 7.07 (2H, d,J=8.5 Hz, H-3′, 5′), 7.04 (1H, d,J=16.0 Hz, H-β), 6.91 (1H, d,J=16.0 Hz, H-α), 6.80 (1H, brs, H-2), 6.64 (1H, brs, H-6), 6.48 (1H, t,J=2.2 Hz, H-4);13C-NMR (100 MHz, CD3OD)δ: 159.0 (C-3), 158.0 (C-5), 157.1 (C-4′), 139.5 (C-1′), 131.7 (C-1′), 128.0 (C-β), 127.4 (C-2′, 6′), 126.2 (C-α), 116.4 (C-3′, 5′), 107.2 (C-6), 106.0 (C-4), 103.0 (C-2), 100.7 (C-1′′), 76.7 (C-5′′), 76.5 (C-3′′), 73.5 (C-2′′), 70.0 (C-4′′), 61.1 (C-6′)。将化合物的核磁数据与文献报道的数据[16]进行对比,鉴定化合物8 为resveratrol 4′-O-β-D-glucopyranoside。
化合物9:白色粉末;ESI-MSm/z: 389 [M-H]−;1H-NMR (400 MHz, CD3OD)δ: 7.35 (2H, d,J=8.5 Hz, H-2′, 6′), 7.01 (1H, d,J=16.0 Hz, H-β), 6.84 (1H, d,J=16 Hz, H-α), 6.78 (2H, d,J=8.5 Hz, H-3′, 5′), 6.76 (1H, brs, H-2), 6.63 (1H, brs, H-6), 6.46 (1H, t,J=2.2 Hz, H-4);13C-NMR (100 MHz, CD3OD)δ: 160.0 (C-3), 158.1 (C-5), 157.0 (C-4′), 140.0 (C-1), 128.6 (C-1′), 127.5 (C-2′, 6′), 127.0 (C-β), 126.2 (C-α), 115.1 (C-3′, 5′), 107.0 (C-6), 105.7 (C-4), 102.7 (C-2), 100.9 (C-1′′), 76.7 (C-5′′), 76.6 (C-3′′), 73.5 (C-2′′), 69.9 (C-4′′), 61.1 (C-6′′)。将化合物的核磁数据与文献报道的数据[14]进行对比,鉴定化合物9 为resveratrol 3-O-β-D- glucopyranoside。
化合物10:白色粉末;ESI-MSm/z: 405 [MH]−;1H-NMR (400 MHz, CD3OD)δ: 7.34 (2H, d,J=8.5 Hz, H-3′ 5′), 7.30 (1H, d,J=16.0 Hz, H-β), 6.87 (1H, d,J=16 Hz, H-α), 6.76 (1H, brs, H-2), 6.63 (1H, brs, H-6), 6.45 (1H, t,J=2.2 Hz, H-4), 6.32 (1H, d,J=6.0 Hz, H-6′);13C-NMR (100 MHz, CD3OD)δ: 157.8 (C-4), 157.1 (4′), 140.9 (C-1), 127.4 (C-2′, 6′), 127.2 (C-β), 124.8 (C-6), 123.3 (C-α), 116.4 (C-3′, 5′), 107.1 (C-2, 5), 102.2 (C-4), 100.8 (C-1′′), 76.7 (C-5′′), 76.5 (C-3′′), 73.5 (C-2′′), 69.9 (C-4′′), 61.0 (C-6′′)。将化合物的核磁数据与文献报道的数据[15]进行对比,鉴定化合物10 为oxyresveratrol-2-O-β-D-glucopyranoside。
化合物11:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z594 [M+H]+;1H-NMR (400 MHz, CD3OD)δ:6.22 (1H, brs, H-4), 5.35 (1H, d,J=5.0 Hz, H-5), 4.97 (1H, brs, H-7a), 4.66 (1H, brd,J=4.0 Hz, H-3), 4.61 (1H, brd,J=5.0 Hz, H-7b), 4.50 (1H, s, H-14), 4.31 (1H, s, H-20), 4.29 (1H, dd,J=5.0, 3.0 Hz, H-3), 2.76 (1H, dd,J=10.0, 6.0 Hz, H-18), 1.72 (1H, m, H-22), 1.05 (3H, d,J=7.0 Hz, H-27), 0.97 (3H, s, H-19);13C-NMR (100 MHz, CD3OD)δ:175.5 (C-1′), 105.5 (C-4), 93.1 (C-9), 81.5 (C-14), 74.5 (C-3), 72.5 (C-20), 70.7 (C-15), 69.3 (C-15), 69.1 (C-16), 61.8 (C-18), 62.0 (C-23), 47.6 (C-12), 46.7 (C-5), 45.1 (C-10), 45.0 (C-17), 41.5 (C-2′), 34.1 (C-11), 33.9 (C-13), 32.7 (C-1), 29.4 (C-24), 27.8 (C-6), 27.2 (C-25), 26.6 (C-3′), 20.6 (C-21), 19.6 (C-19), 18.8 (C-23), 17.7 (C-27), 16.5 (C-5′), 10.8 (C-4′′)。以上数据与文献对照基本一致[17],鉴定化合物11 为verussurinine。
化合物12:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z: 472 [M+H]+;1H-NMR (400 MHz, CD3OD)δ:5.34 (1H, brd,J=6.3 Hz, H-6), 4.90 (1H, m, H-16), 3.57 (1H, m, H-15), 3.30 (1H, m, H-3), 1.12 (3H, d,J=6.8 Hz, H-21), 1.08 (3H, s, H-19), 0.90 (3H, d,J=6.5 Hz, H-27), 0.82 (3H, s, H-18);13C-NMR (100 MHz, CD3OD)δ:178.5 (C-22), 172.6 (COCH3), 143.0 (C-5), 123.5 (C-6), 81.5 (C-16), 75.4 (C-15), 72.4 (C-3), 60.6 (C-17), 58.1 (C-26), 56.3 (C-14), 50.3 (C-9), 48.2 (C-20), 44.1 (C-4), 42.0 (C-12), 38.6 (C-1), 38.2 (C-10), 33.6 (C-7), 33.0 (C-1), 32.8 (C-8), 31.0 (C-2), 30.9 (C-24), 30.2 (C-25), 30.1 (C-23), 23.6 (C-10), 22.1 (CH3CO), 20.6 (C-19), 20.4 (C-27), 18.6 (C-21), 16.2 (C-18)。以上数据和文献对照基本一致[18],鉴定化合物12 为veralosidine。
化合物13:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z: 426 [M+H]+;1H-NMR (400 MHz, CD3OD)δ:5.54 (1H, brd,J=6.5 Hz, H-6), 3.57 (1H, m, H-3), 2.56 (3H, s, H-20), 1.42 (3H, d,J=6.8 Hz, H-21), 1.18 (3H, s, H-19), 0.90 (3H, d,J=6.5 Hz, H-27);13C-NMR (100 MHz, CD3OD)δ:202.5 (C-11), 146.0 (C-13), 142.5 (C-5), 132.3 (C-14), 121.5 (C-6), 84.5 (C-17), 75.4 (C-23), 70.4 (C-3), 65.6 (C-22), 61.8 (C-9), 53.3 (C-26), 43.2 (C-14), 41.1 (C-4), 40.0 (C-20), 38.6 (C-24), 38.2 (C-8), 37.6 (C-10), 36.0 (C-1), 31.2 (C-25), 31.0 (C-2), 30.9 (C-16), 30.2 (C-7), 30.2 (C-7), 23.6 (C-15), 18.6 (C-27), 18.2 (C-19), 12.9 (C-18), 10.2 (C-21)。以上数据和文献对照基本一致[19],鉴定化合物13 为jervine。
化合物14:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z: 560 [M+H]+;1H-NMR (400 MHz, DMSO-d6)δ:5.56 (1H, brd,J=5.0 Hz, H-6), 3.84 (1H, m, H-3), 1.11 (3H, d,J=6.5 Hz, H-21), 1.02 (3H, s, H-20), 0.95 (3H, d,J=6.5 Hz, H-27), 0.75 (3H, s, H-19);13C-NMR (100 MHz, DMSO-d6)δ:140.5 (C-5), 121.5 (C-6), 101.1 (C-1′), 78.4 (C-5′), 78.1 (C-3), 77.8 (C-22), 76.4 (C-3′), 75.2 (C-2′), 73.7 (C-26), 70.4 (C-4′), 67.6 (C-16), 62.5 (C-16), 61.1 (C-6′), 60.0 (C-26) 56.4 (C-14), 55.6 (C-9), 42.5 (C-13), 39.6 (C-4), 39.5 (C-12), 37.4 (C-1), 37.0 (C-10), 36.5 (C-10), 32.1 (C-7), 31.8 (C-8), 31.8 (C-15), 31.6 (C-25), 31.4 (C-24), 29.3 (C-2), 26.9 (C-23), 21.9 (C-11), 18.6 (C-19), 18.2 (C-21), 16.9 (C-27), 16.5 (C-18)。以上数据和文献对照基本一致[20],鉴定化合物14 为γ-chaconine。
化合物15:白色粉末;碘化铋钾反应呈阳性;ESI-MSm/z: 636 [M+H]+;1H-NMR (400 MHz, CD3OD)δ:6.22 (1H, brs, H-4), 5.35 (1H, d,J= 5.0 Hz, H-5), 4.97 (1H, brs, H-7a), 4.93 (1H, brd,J= 4.0 Hz, H-3), 4.61 (1H, brd,J= 5.0 Hz, H-7b), 4.50 (1H, s, H-14), 4.31 (1H, s, H-20), 4.29 (1H, dd,J= 5.0, 3 Hz, H-3), 2.76 (1H, dd,J=10.0, 6.0 Hz, H-18), 1.72 (1H, m, H-22), 1.05 (3H, d,J=7.0 Hz, H-27), 0.97 (3H, s, H-19);13C-NMR (100 MHz, CD3OD)δ:175.5 (C-1′′), 170.9 (C-1′), 105.5 (C-4), 93.1 (C-9), 81.5 (C-14), 74.5 (C-3), 72.5 (C-20), 70.7 (C-15), 69.3 (C-15), 69.1 (C-16), 61.8 (C-18), 62.0 (C-23), 47.6 (C-12), 46.7 (C-5), 45.1 (C-10), 45.0 (C-17), 41.5 (C-2′′), 34.1 (C-11), 33.9 (C-13), 32.7 (C-1), 29.4 (C-24), 27.8 (C-6), 27.2 (C-25), 26.6 (C-3′′), 21.3 (C-2′), 20.6 (C-21), 19.6 (C-19), 18.8 (C-23), 17.7 (C-27), 16.5 (C-5′′), 10.8 (C-4′′)。以上数据和文献对照基本一致[21],鉴定化合物15 为germidine。
4 活性测试
4.1 化合物的抗真菌活性筛选
采用纸片扩散法(K-B 法)[22]评价15 个化合物的抗真菌活性。真菌菌株包括:白色念珠菌、光滑念珠菌、克柔念珠菌、烟曲霉菌和新生隐球菌。纸片扩散法操作按照真菌药敏试验指南(CLSI)方法,化合物1~15 均溶于DMSO 中,使用浸泡的方法让药敏纸片含有一定浓度的待测化合物。将含有化合物的纸片分别贴在测试菌的琼脂平板上,35 ℃孵育48 h。用游标卡尺测量药敏纸片上抑菌圈的直径,参考CLSI M60 标准判定结果。以两性霉素B为阳性对照药物,每个样品平行测试3 次。抗真菌活性结果表明,化合物14 对新生隐球菌和克柔念珠菌都具有较好的抑制活性,IC50分别为4.1、19.8 μg/mL。阳性对照两性霉素B 对新生隐球菌和克柔念珠菌的IC50分别为0.7、0.3 μg/mL。
4.2 抗真菌活性化合物的细胞毒活性测定
采用MTT 法[23]测定具有抗真菌活性化合物14的细胞毒活性。收集对数期的肿瘤细胞(SK-MEL细胞、KB 细胞、BT-549 细胞、SK-OV-3 细胞),37 ℃、5% CO2条件下培养24 h;加入不同浓度的含药培养基,100 μL/孔,37 ℃、5% CO2条件下培养48 h。每孔加入20 μL 2.5 mg/mL MTT 溶液,继续培养4 h,每孔加入100 μL DMSO。置于酶标仪检测490 nm 为检测波长的吸光值。以阿霉素为阳性对照药物,每个样品平行测试3 次。结果表明,化合物14 对这4 种肿瘤细胞在100 μmol/L 浓度下均无抑制活性。
5 讨论
本研究以抗真菌活性为导向的从2 种藜芦属植物中寻找天然的抗真菌化合物。从V.virid和藜芦的根及根茎的甲醇提取物中共分离鉴定了15 个化合物,其中有10 个甾体生物碱类化合物,5 个二苯乙烯苷类化合物。化合物1 为新化合物,化合物5~10、14 为首次从藜芦属植物中分离得到。对分离得到的15 个化合物进行抗真菌活性筛选,结果显示化合物14 对新生隐球菌和克柔念珠菌具有较好的抑制活性,IC50分别为4.1、19.8 μg/mL。并且对4 株人的肿瘤细胞在100 μmol/L浓度下都不具有抑制活性。本研究为后期藜芦属植物在抗真菌活性物质方面的研究与开发提供了一定的基础。
利益冲突所有作者均声明不存在利益冲突
