NMR联用HILIC-UPLC-MS/MS 测定TNBS诱导的结肠炎大鼠尿液和血浆代谢物变化
2021-08-04孙央雯邹宝荣刘德亮廖琼峰谢智勇
刘 雯,孙央雯,邹宝荣,肖 丹,蔡 颖,刘德亮,廖琼峰,谢智勇
(1.中山大学药学院(深圳),广东深圳 518107;2.广州中医药大学中药学院,广东广州 510006)
炎症性肠病(inflammatory bowel disease,IBD)是一类慢性、高复发性的胃肠道炎症性疾病,近年来在各国人群中发病率呈指数上升,现已成为一种全球化疾病[1]。尽管目前普遍认为炎症性肠病与环境、饮食、免疫、肠道菌群等诸多因素有关,但其发病机制迄今尚未得到明确阐述[2]。既往研究表明,炎症性肠病的动态发展常伴随着机体代谢紊乱[3]。例如,炎症性肠病会影响能量代谢与氨基酸代谢途径,导致该途径产生的内源性代谢物水平发生系统性改变,而这些改变会进一步加剧肠道炎症的发展[4]。同样,有临床研究指出[5],炎症性肠病患者尿液中氨基酸和三羧酸循环中间产物的水平较健康人群显著上升。因此,针对性地关注相应生物标志物如氨基酸类代谢物的变化规律,对于炎症性肠病发病机制的探讨有重要的意义。代谢组学作为研究生物体内代谢变化的关键手段,已被普遍应用于炎症性肠病的诊断、监测以及生物标志物的筛选等方面。当前炎症性肠病的代谢组学研究主要为基于单种分析技术如核磁共振(nuclear magnetic resonance,NMR)、气质联用(gas chromatographymass spectrometry,GC-MS)和 液 质 联 用(liquid chromatography-mass spectrometry,LC-MS)的非靶标代谢组学分析[6-8],其中NMR 和LC-MS 作为代谢组学的代表方法,各具其特点:NMR 虽拥有预处理简单、低成本的优点,但它也存在低灵敏度的局限性;而LC-MS 灵敏度虽高,但样品前处理时需要破坏样品,易导致相关代谢信息丢失。倘若同时将多种代谢组学技术联合使用,则能使有限的代谢信息相互整合,进而全面揭示生物体内的代谢变化,由此助于炎症性肠病发病机制的阐明。本研究采用1H NMR 与HILIC-UPLC-MS∕MS(hydrophilic in‐teraction ultra-high-performance liquid chromatogra‐phy-tandem mass spectrometry,HILIC-UPLC-MS∕MS)联用的多元代谢组学方法,以期在分析TNBS诱导的结肠炎对大鼠尿液代谢谱产生影响的同时,准确测定大鼠尿液和血浆中氨基酸类代谢物的水平变化,并筛选出相关差异代谢物,为炎症性肠病的机制研究与关键生物标志物的探索提供新的思路和途径。
1 材料与方法
1.1 仪器与试剂
Agilent 1240-6460 三重四极杆液质联用仪(美国Agilent公司);Bruker 600 MHz AVANCE ⅢNMR(德国Bruker 公司);BP211D 电子天平(德国Satori‐us 公司);SB25-12DTD 超声清洗机(宁波新芝生物科技股份有限公司);5425R 高速冷冻离心机(德国Eppendorf公司)等。
磷酸氢二钾(K2HPO4·3H2O)、磷酸二氢钠(NaH2PO4·2H2O)和叠氮化钠(NaN3)购于天津大茂化工试剂厂;三硝基苯磺酸(TNBS)、D2O(含有0.05% TSP,W∕V)购于美国Sigma 公司;色谱级甲酸和甲酸铵购于上海阿拉丁生化科技股份有限公司;色谱级乙腈购于德国Merck 公司;标准品均购于中国药品生物制品检定所;髓过氧化物酶(My‐eloperoxidase,MPO)试剂盒购于南京建成生物工程研究所。
1.2 实验动物和样本收集
成年SPF级雄性SD大鼠(180~200 g)由广东省医学实验动物中心提供,动物生产许可证号:SCXK(粤)2013-0002。将大鼠置于温度(20~22)℃、湿度(50%~70%)以及12 h 明暗循环的环境中常规饮食饲养,所有实验操作均符合中山大学动物实验中心动物伦理要求并按照实验动物使用原则进行。经一周适应性喂养后,16 只大鼠被随机分成两组进行造模,即对照组(Control)和模型组(Model),给予模型组大鼠结肠灌入0.25 mL TNBS 溶液(30 mg∕mL,溶于50%乙醇),对照组灌入等量乙醇溶液,造模后常规饲养。
于造模前1 d 和造模后1、3、5 和7 d 用代谢笼采集大鼠尿样,离心取上清并保存待用。于造模后第3 天(day 3),每组取2 只大鼠腹腔注射水合氯醛麻醉以收集结肠组织。于造模后第7天(day 7),对余下大鼠用水合氯醛麻醉并进行眼眶静脉丛采血,离心得到血浆样品,同时收集结肠组织。
1.3 生理生化指标测定
将结肠组织于10%福尔马林溶液中固定48 h,经脱水、石蜡包埋后制成苏木精伊红(haematoxylin and eosin,HE)组织切片,参考文献的标准对结肠损伤程度进行评估[9]。髓过氧化物酶(MPO)活性测定按说明书操作。
采用SPSS 23.0 软件进行统计学分析,数据以均值±标准差表示。若数据呈正态分布且方差齐性,则组间比较采用t检验,反之采用校正t检验,P<0.05为差异有统计学意义。
1.4 NMR代谢组学检测与数据分析
1.4.1 样品前处理 吸取550 μL 尿样于离心管,加入55μL磷酸盐缓冲液(1.5 mol∕L,K2HPO4:NaH2PO4=4:1,用含0.1%NaN3和D2O 配制)涡旋1 min 后再离心10 min(15 000 ×g,4 °C),并将550 μL上清液转移至核磁管。
1.4.2 数据采集 使用NOESY1D 脉冲序列(RDG1-90°-t1-90°-tm-G2-90°-ACQ)采集信号,参数设置:采样温度298 K,采样点数32 K,采样时间2 s,累加次数64 次,混合时间80 ms,90°脉冲宽度11 μs,谱宽12 kHz[10]。
1.4.3 数据处理 采用TOPSPIN 软件(V3.2,Bruk‐er Biospin,Germany)对1H NMR 图谱进行相位和基线校正,以TSP 信号(δ 0.00)定标,利用AMIX 软件(V3.2,Bruker Biospin,Germany)对图谱δ 0.50~9.50 区间分段积分,积分间隔0.004 ppm,同时去除水峰(δ 4.72~4.88)和尿素峰(δ 5.50~6.00)。
1.4.4 多变量统计分析 基于SIMCA-P 软件(V12.0,Umetrics,Sweden)对归一化的数据进行多元统计分析,包括主成分分析(Principal component analysis,PCA)、偏最小二乘法判别分析(partial least-squares discriminant analysis,PLS-DA)、正交偏最小二乘法判别分析(orthogonal partial leastsquares discriminant analysis,OPLS-DA),并根据R2X、R2Y、Q2Y 和交叉验证结果评估模型可信度,数据使用Pareto 规格化(Pareto variance,Par)处理[11]。基于OPLS-DA,计算变量投影重要度(variable im‐portance for the projection,VIP),结合独立样本t检验(P<0.05 为差异有统计学意义),以VIP >1 和P<0.05为条件筛选差异代谢物。
1.5 HILIC-UPLC-MS/MS代谢组学检测
1.5.1 样品前处理 参考文献[12]的方法,吸取30μL尿液或血浆样本,加入10μL内标溶液(10μg∕mL L-2-氨基丁酸,6-巯鸟嘌呤,3,4-二羟基苯甲酸,5-羟基吲哚-2-羧酸)和140 μL 乙腈,涡旋混匀5 min 后离心10 min(16 000×g),吸取2 μL上清液进样分析。
1.5.2 色谱、质谱条件 色谱条件:色谱柱为AC‐QUITY UPLC® BEH Amide 柱(50 mm × 2.1 mm,1.7 μm,Waters,USA),接有VanGuard保护柱(5 mm× 2.1 mm,1.7 μm,Waters,USA)。流动相A 相为20 mmol∕L 甲酸铵溶液(含0.25%甲酸),B相为乙腈(含20 mmol∕L 甲酸铵和0.2%甲酸),流速0.5 mL ∕min,梯度洗脱(0~2.6 min,100% B;2.7~4.0 min,100% B→90% B;4.1~6.5 min,90% B→70% B)。质谱条件:电喷雾离子源,电离电压3.5 kV,喷嘴电压500 V,毛细管温度300 °C,鞘气流速11 L∕min,干燥器温度350°C,雾化器压力40 psi。
1.6 数据处理
基于SIMCA-P 软件(V12.0,Umetrics,Swe‐den),采用OPLS-DA 分析并结合独立样本t检验筛选差异代谢物(P<0.05为差异有统计学意义)。
2 结果
2.1 大鼠生理生化指标与组织病理学检查
经TNBS 造模后,结肠炎模型组大鼠体质量增长较对照组缓慢,同时还表现出腹泻症状,但在造模3 d以后,模型组大鼠腹泻症状逐渐得到缓解,并于实验结束前消失。
模型组大鼠组织评分高于对照组(图1A),且差异有统计学意义。此外,该组大鼠结肠组织MPO 水平也显著高于对照组(图1B)。相较于对照组大鼠的结肠组织特征(图1C),造模3 d 后模型组大鼠结肠组织切片中可见明显炎症细胞浸润、杯状细胞和隐窝数量减少、黏膜层局部溃疡,且造模7 d后模型组大鼠结肠组织切片中仍可观察到黏膜轻度炎性细胞浸润。综合以上结果,提示TNBS 成功诱导大鼠结肠炎模型。
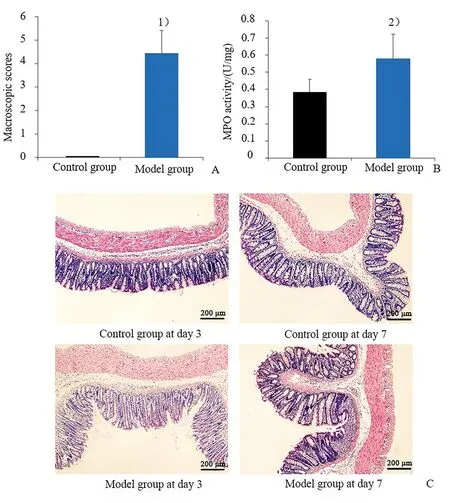
图1 TNBS诱导的结肠炎大鼠模型评估Fig.1 Evaluation of TNBS-induced colitis model in rats
2.2 NMR代谢组学分析
图2 为造模3 d 后模型组与对照组大鼠尿液代谢物的代表性1H NMR 图谱,基于该图谱与公共数据库HMDB(http:∕∕www.hmdb.ca∕)对代谢物进行比对,共归属出49 种代谢物,主要包括糖类(β-葡萄糖、糖原、乳糖和木糖),氨基酸类(甘氨酸、丙氨酸、脯氨酸、亮氨酸和异亮氨酸),有机酸类(三羧酸循环中间产物),胺类(甲胺、二甲胺)和肠道菌群-宿主共代谢物(马尿酸盐、对甲酚硫酸盐、对甲酚葡萄糖苷、苯乙尿酸)等。
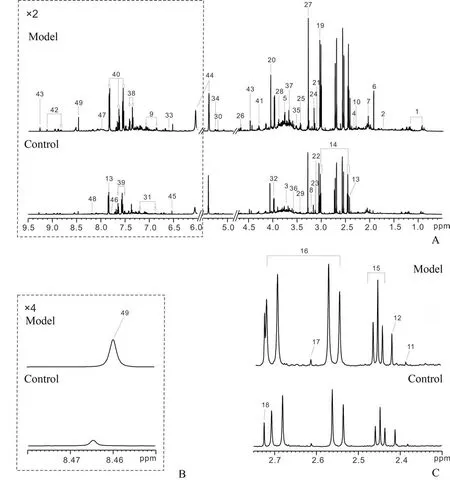
图2 造模3 d后对照组和模型组大鼠尿液的代表性1H NMR图谱Fig.2 Representative 1H NMR spectra of urine in the control and model groups at day 3
采用OPLS-DA分析结肠炎大鼠尿液代谢物的动态变化,代谢轮廓轨迹图(图3A)显示出模型组大鼠尿液代谢轮廓变化的时间依赖性,且偏离程度随时间推移逐渐增大,并于造模3 d 后偏离达到最大,此后差异逐渐缩小,但最终与造模前仍未能重合。综合OPLS-DA 轨迹图与组织病理学特征,表明模型组大鼠在造模3 d 后的疾病程度最为严重。因此,对造模3 d 后大鼠尿液代谢物的变化情况进行分析。OPLS-DA 负载图中红色标记点代表VIP >1 的潜在差异代谢物(图3B),结合VIP >1 且P<0.05 的筛选标准,最终筛选得到6 个差异代谢物(图4、表1),其中丙酮酸、甲酸、甲胺、柠檬酸水平在模型组大鼠尿液中显著升高,而氧化三甲胺(trimethylamine oxide,TMAO)和丙二酸水平则明显降低。
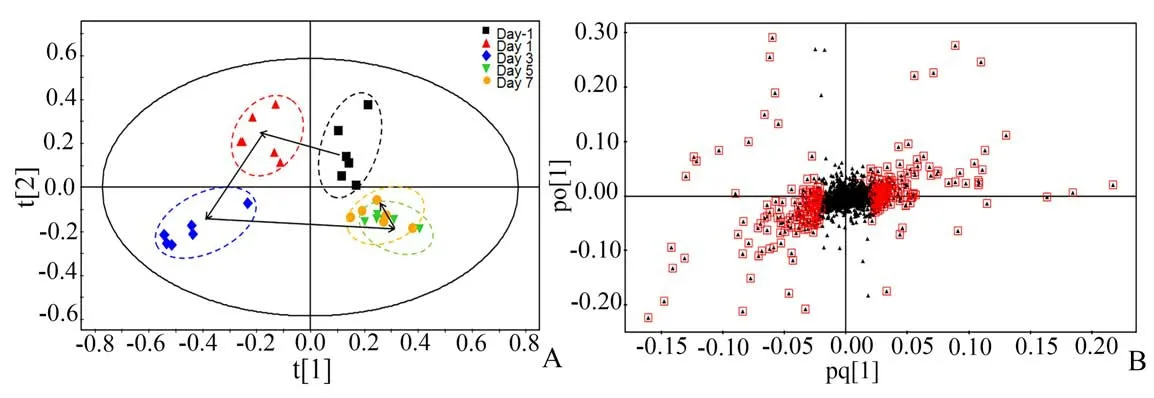
图3 模型组大鼠尿液的OPLS-DA代谢轮廓轨迹图与负载图Fig.3 Metabolic trajectory plot and loading plot of urine in the model group based on OPLS-DA
2.3 HILIC-UPLC-MS/MS代谢组学分析
为进一步探究结肠炎对大鼠氨基酸类代谢物的影响,利用HILIC-UPLC-MS∕MS 测定对照组和模型组大鼠尿液和血浆氨基酸组成。从整体上看,TNBS 诱导后,模型组与对照组大鼠尿液和血浆代谢组均呈现明显的分离趋势(图4A、B)。从差异代谢物具体变化趋势来看,模型组大鼠尿液中苯丙氨酸和组氨酸含量升高,而血浆样品中赖氨酸、精氨酸、苯丙氨酸、亮氨酸、甘氨酸、色氨酸、脯氨酸、组氨酸和酪氨酸含量显著升高,但谷氨酰胺、缬氨酸、丙氨酸和异亮氨酸含量下降(图4C、表1)。
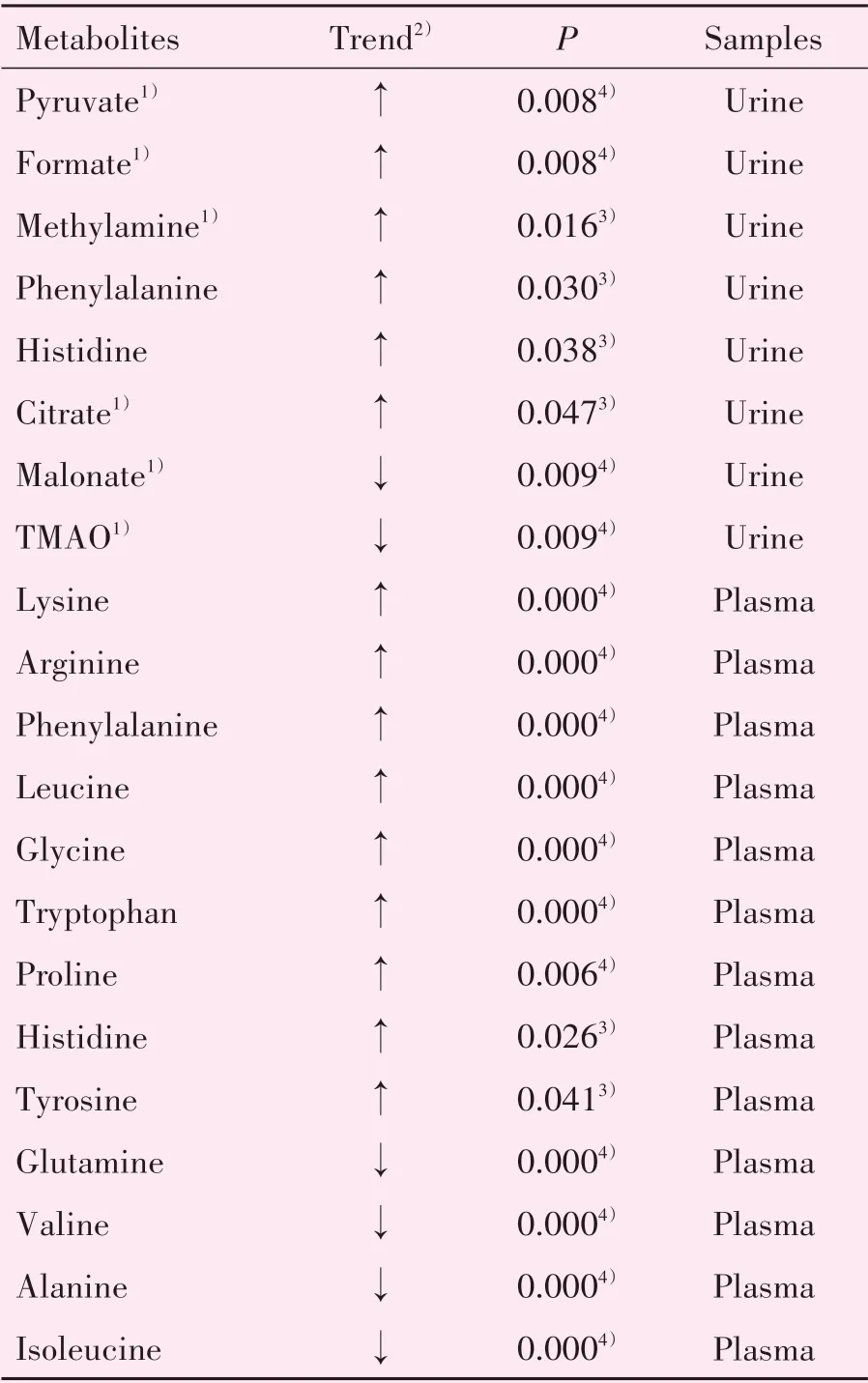
表1 模型组大鼠尿液、血浆差异代谢物及变化趋势Table 1 Differential metabolites and its variation tendency of urine and plasma in the model group
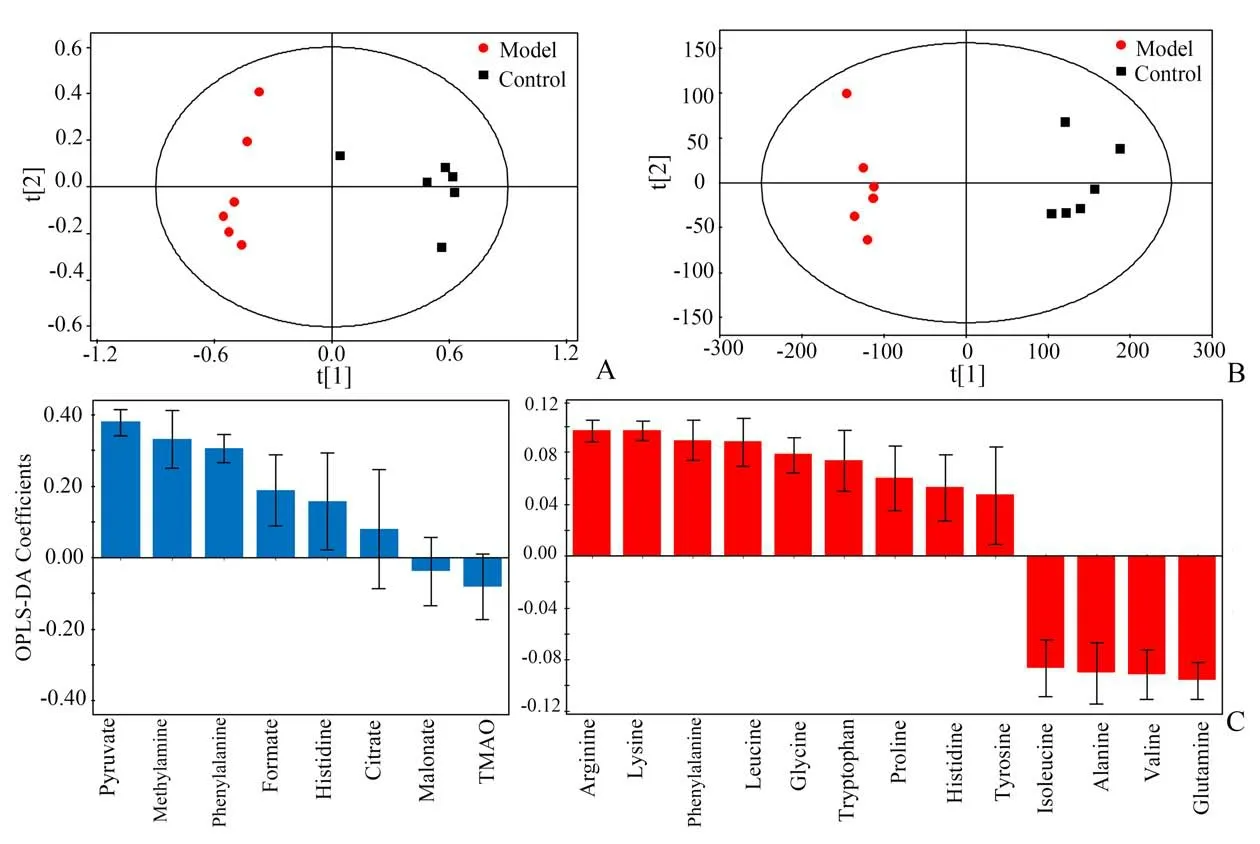
图4 对照组和模型组大鼠尿液与血浆的OPLS-DA得分图与标准化回归系数图Fig.4 Score plots and standardized coefficients plots of urine and plasma in the control and model groups based on OPLS-DA
3 讨论
炎症性肠病作为一种胃肠道慢性疾病,其主要特征之一即是对机体的体液代谢造成影响,包括粪便、尿液和血液中的代谢轮廓都会随炎症性肠病的发展而改变[13]。其中,尿液与血液样本在炎症性肠病生物标志物的筛查方面具有一定潜力,如尿液代谢物中的前列腺素E 可用于预测结肠炎的复发情况[14],而血液中的C 反应蛋白是临床用于检测肠道急性炎症的关键指标[15]。此外,当前较被认可的炎症性肠病动物造模方法主要是三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)∕乙醇灌注法[16],利用该法获得的结肠炎动物模型因肠道组织学变化与人体基本相似而被广泛运用于炎症性肠病的研究中。由此,本研究采用TNBS 诱导实验性结肠炎大鼠模型,再联用1H NMR 和HILIC-UPLCMS∕MS 对结肠炎大鼠的尿液和血浆进行代谢组学分析。基于非靶标结合靶标代谢组学的分析结果,我们发现TNBS在不同程度上影响了结肠炎大鼠的能量代谢、胺类代谢和氨基酸代谢途径(图5)。

图5 TNBS诱导对大鼠代谢通路的影响Fig.5 Metabolic pathways influenced by TNBS induction in rats
三羧酸(TCA)循环中间产物的水平能反映机体对能量的需求。TNBS 诱导后,我们发现模型组大鼠尿液丙酮酸和柠檬酸水平升高。与之相似,Dong 等[10]通过对结肠炎小鼠的尿液代谢物进行分析,发现其尿液代谢谱在造模1 d后迅速改变,且尿液中柠檬酸、酮戊二酸等与能量代谢相关的代谢物含量显著增加。鉴于TCA 循环中间产物在细胞能量代谢中的重要作用,我们推测其水平增高的原因可能是肠道炎症使结肠炎大鼠需要增强TCA 等能量代谢活动而为受损肠屏障的修复提供足够的能量,因此结肠炎大鼠尿液中柠檬酸与丙酮酸水平的增加很可能与肠道炎症密切相关。
在胺类代谢方面,氧化三甲胺(TMAO)主要有两条来源:肠道细菌的代谢以及饮食摄入。由于实验过程中各组大鼠的饮食均未改变,因此大鼠尿液中TMAO 水平改变可能是由TNBS 对肠道菌群稳态造成破坏所引起的。我们发现,模型组大鼠尿液TMAO 含量较对照组显著降低,而这一结果正与Wilson 等[17]的研究结果相符。此外,我们还观察到其他细菌代谢物如甲胺在模型大鼠尿液中含量显著升高。文献表明,甲胺的脱氨作用会引起氧化应激反应,并使甲胺毒性增强,且甲胺水平升高的同时也会使其代谢产物甲醛增多,而甲醛已被证实能对内皮造成损伤[18-19]。于此,模型组大鼠尿液中甲胺水平的改变很可能提示其肠道潜在的炎症与内皮受损。
由于肠道炎症会造成氨基酸代谢途径紊乱,因此氨基酸类代谢物被认为是与结肠炎相关的重要生物标志物[20]。在本研究中,我们发现模型组大鼠尿液和血浆中共计9 种氨基酸水平上调,究其原因,可能有:①结肠炎会对宿主肠道菌群结构造成破坏[5],而氨基酸作为肠道菌群-宿主共代谢物,其水平改变与结肠炎大鼠肠道菌群失调存在一定关联;②因为结肠炎大鼠对能量需求增加,机体需要加速蛋白质降解和氨基酸生物转化以增加能量供应,由此影响氨基酸水平;③由于炎症对肠道的刺激,会影响结肠对氨基酸的吸收利用,导致尿液和血浆中氨基酸含量增加,而这也侧面反映了结肠炎大鼠肠道屏障受损。同时,我们发现了两个有趣的差异代谢物——赖氨酸和缬氨酸。文献报道[21],当肠道存在炎症时,精氨酸能减轻炎症对肠道的损伤,但赖氨酸水平升高时会竞争性抑制CAT1 转运体对精氨酸的摄取,从而妨碍其发挥功能并加剧肠道炎症[6]。缬氨酸是免疫系统产生细胞因子等过程中的必需氨基酸,当其在体内水平不足时,会影响机体免疫应答[22]。钙卫蛋白,作为一种对黏膜炎症高度特异的生物标志物,在临床被广泛用于结肠炎的诊断和疾病程度的评估。通常情况下,钙卫蛋白含量越高,则提示肠道炎症越严重。有研究表明,结肠炎患者体内钙卫蛋白的含量与赖氨酸水平成正比、与缬氨酸水平成反比[6,22],这与我们在模型大鼠体内观察到的赖氨酸水平升高、缬氨酸水平降低的结果一致。基于此,我们认为赖氨酸和缬氨酸有潜力成为结肠炎相关的重要生物标志物,在临床研究中可以通过对这两种氨基酸的水平进行检测以辅助炎症性肠病的诊断,同时结合钙卫蛋白等指标综合分析以提高诊断与评估结果的可靠性和准确性。此外,我们还发现模型组大鼠血浆中谷氨酰胺水平显著降低。谷氨酰胺具有改善肠屏障、缓解肠道炎症等功能[23],然而受肠道炎症影响,模型组大鼠氨基酸代谢失调,导致血浆中谷氨酰胺水平降低。以上结果提示谷氨酰胺不仅能作为生物标志物指示肠道炎症,同时膳食补充谷氨酰胺或许可以作为一种预防或治疗炎症性肠病的辅助疗法。
Nong 等[2]的研究也指出,TNBS 诱导的结肠炎大鼠尿液中氨基酸代谢途径受到干扰。但与我们观察到的差异代谢物不一样的是,他们发现苯乙醛的水平在模型大鼠尿液中显著降低,并猜测苯乙醛的减少与苯丙氨酸-4-羟化酶有关,后者作为一种苯丙氨酸代谢酶,在肠道存在炎症和损伤时含量降低,进而减少其对苯丙氨酸的代谢,但他们并未检测到苯丙氨酸的变化。而在我们的研究中,我们发现模型组大鼠尿液与血浆中苯丙氨酸含量均显著上升,这一结果不仅是对前人研究结果与猜想的补充与验证,也表明了苯丙氨酸作为生物标志物的潜力。同时,Tao等[24]通过对结肠炎大鼠尿液与血浆代谢组进行研究,发现结肠炎对大鼠代谢途径的影响主要集中于磷脂与胆碱、血脂代谢等,虽然与我们观察到的代谢途径不一致,但以上代谢途径紊乱也同样提示了TNBS引起的肠道上皮受损与结肠炎症,并与我们结果所反映的结肠炎大鼠生理变化相吻合。
综上所述,本研究首先采用1H NMR 技术从整体角度分析结肠炎大鼠尿液代谢轮廓变化,同时为了弥补1H NMR 灵敏度低的缺陷,再与HILICUPLC-MS∕MS 技术结合以对结肠炎大鼠尿液和血浆中与肠道炎症密切相关的氨基酸类代谢物进行准确定量。通过对两种不同仪器平台的分析方法进行优势互补,不但从多方面获得准确的代谢组学信息,也能避免使用单一方法带来的局限性。基于1H NMR联用HILIC-UPLC-MS∕MS的多元分析技术,可以较为全面且深入地揭示结肠炎大鼠体内相关代谢物的变化规律,为炎症性肠病的机制研究、临床诊断以及关键生物标志物的筛选提供新的研究思路。
