莲不同类型地下芽的初代培养
2021-08-02靖晶李军刘凤军徐君王欢姜红卫
靖晶 李军 刘凤军 徐君 王欢 姜红卫


摘要:以莲不同类型的顶芽和腋芽为外植体,开展芽的无菌离体再生组织培养。结果显示:莲的不同类型顶芽/腋芽离体培养效果不同,随着消毒时间的延长,A类型外植体污染率最低,B类型外植体污染率次之,C类型外植体污染率最高。A类型外植体成活率最低,B类型外植体次之,C类型外植体最高。外植体的不同灭菌试验表明,添加生物消毒剂(plant preservative mixture,PPM)后,污染率降低到27.77%。不同的细胞分裂素对初代培养的试验表明,添加3.0 mg/L KT时,诱导率达到74.43%,而且芽生长健壮,是比较适合的莲外植体诱导的激素浓度。
关键词:莲花;外植体;细胞分裂素;污染率;诱导率
中图分类号:S682.320.4+3 文献标志码: A
文章编号:1002-1302(2021)12-0105-05
收稿日期:2020-09-01
基金项目:江苏省农业科技自主创新资金[编号:CX(19)3119];江苏省苏州市智库项目(编号:ZK202002)。
作者简介:靖 晶(1986—),女,山西大同人,硕士,助理研究员,主要从事观赏园艺植物育种研究。E-mail:376922925@qq.com。
通信作者:姜红卫,硕士,研究员,主要从事园林植物育种与栽培研究。E-mail:770666671@qq.com。
莲(Nelumbo nucifera)又称水芙蓉、芙蕖、莲花等,属睡莲科(Nelumbonaceae)莲属(Nelumbo)多年生草本水生花卉。莲是最为古老的栽培植物之一,素有“活化石”之称,是冰期以后幸存的孑遗植物。据考证,我国已有3 000多年的栽培历史,有着丰富的栽培品种及乡土资源[1]。莲以其优美的姿态、丰富的花色深受我国居民喜爱,属我国的十大名花之一,具有较高的观赏价值和经济价值[2]。近年来,随着我国经济的持续快速发展,人们生活水平不断提高,市场对莲新品种的需求量日益旺盛和多元化[3]。传统莲的育种方式是杂交育种,这种方式具有育种周期长、工作量大、容易发生生殖障碍而引起胚胎败育等缺点。通过分子生物学技术结合组织培养技术的育种方法,可以缩短育种年限、节约时间成本,是未来莲花育种发展的方向和趋势[4]。另外,莲的常规繁殖方式主要依赖种藕分生进行无性繁殖,这种繁殖方式带来一系列问题,从淤泥里挖藕耗时耗力,同时长期的无性繁殖导致病毒的积累和品种的退化。而茎尖组织培养的方法是尝试解决这一问题的有效途径[5]。2015年Yang等对控制荷花(学名为“莲”)的早花基因方面进行了研究,发现参与光周期、春化作用和赤霉素途径的COPI、CCAI、LHY、CO-LIKE、VIN3、GAI和FT基因的差异表达可能与荷花(学名为“莲”)开花时间有关系[6]。莲藕的组织培养始于1987年[7],1988年日本学者山本雄慈等研究报道,通过诱导莲藕茎尖的脱毒培养已获得成功[8]。我国学者李良俊等以江苏省莲藕主栽品种美人红试管苗茎尖为外植体,研究不同外植体大小及蔗糖浓度对增殖系数的影响[9]。徐君等以荷花(学名为“莲”)顶芽为外植体,研究不同外植体类型、不同消毒时间及不同激素浓度等对诱导率的影响[10]。Arunyanart等研究了不同剂量γ射线和X射线处理莲藕组培苗,诱发其突变,可导致21个形状发生改变。随着射线剂量的增加,大多数植株表现出玻璃化、黄化及叶柄变形等异常特征[11]。莲再生体系建立的方法还不成熟。除了直接利用茎尖这样的分生组织,利用愈伤组织间接诱导再生芽的体系还不成熟,仅有少数报道。在其他报道中,甚至利用愈伤组织间接诱导再生芽的报道都没有成功。孔德政等研究了影响莲藕胚萌发的因素,筛选出莲藕胚培养的最适培养基为MS+6-BA 0.5 mg/L+2,4-D 0.2 mg/L+0.1% AC+3%蔗糖和MS+6-BA 1.0 mg/L+NAA 0.5 mg/L+0.1% AC+3%蔗糖,并且总结了莲藕胚培养存在的问题[12]。Buathong等以莲藕为材料,在MS培养基的培养下,诱导胚顶芽形成胚性愈伤组织,以莲藕胚性芽团为材料,用粒子轰击装置对莲藕的反义DFR基因转化进行了研究,其结果表明莲藕的稳定转化是可能的[13]。
不同基因型对莲组织培养分化情况的影响较大[14],不同品种的外植体诱导率存在显著差异。何碧珠等研究了不同建莲品种茎尖离体再生体系,结果发现,建莲1号与太空莲19号、建莲21号相比差异显著[15]。不同的取材时期对莲茎尖分化也有影响。李良俊等研究表明,春季萌发期(2—4月)与冬季结藕期(10—12月)时取材莲茎尖分化率较高,其中4月达到最高,生育期6—8月则相对较低;从萌动期开始,随着从营养生长到生殖生长过渡,莲茎尖组培难度逐渐加大[16]。
不同消毒灭菌方式对莲茎尖诱导率也存在较大影响,Liu等在对微山红莲的种胚进行組织培养的研究中发现,单纯使用3 min 75%乙醇+10 min 5% NaClO,其污染率可达100%,而用1 min 75%乙醇+10 min 2% NaClO,后再用2%生物消毒剂(plant preservative mixture,PPM)消毒1 d的方式,其污染率可降至2.22%[17]。不同的培养基类型对莲茎尖诱导率也存在影响。莲组织培养的最适培养基为MS培养基,改良的液体培养基与固体培养基的体积比2 ∶1,这样的双层MS培养基可促使外植体顶芽分化数目增多,并且可以促进初生根与次生根的形成[18]。
莲通过组织培养的方式育苗困难,尤其以地下芽为外植体进行组织培养时,容易发生外植体褐化、污染严重、诱导率低等技术瓶颈,严重限制了莲分子育种方法的推广及应用。本试验在前人研究的基础上,主要针对莲地下芽组培污染的抑制方面进行了比较详细的研究。
1 材料与方法
1.1 试验时间及地点
本试验时间是2019年4月,地点是苏州市农业科学院望亭荷花基地(120.6°E、31.3°N)实验室。
1.2 取材和前期处理
试验所需材料均来源于苏州市农业科学院望亭荷花基地,为自育品种荷塘情深。春季4月,莲地下根状茎开始萌动,在莲翻盆后,挑选顶芽及腋芽完好无损的发育良好的藕根,在自来水下将淤泥冲洗干净,带回实验室处理。用解剖刀片沿着顶芽基部,连根部将顶芽切下,参照图1-A。
1.3 外植体的前处理和灭菌
将切取的外植体浸泡在洗洁精水里1 h,之后用小毛刷在洗洁精水里逐个刷干净,每个至少刷5遍,在细缝和小凹坑的地方重点刷洗,全部刷洗干净后,放置在流动的自来水下冲洗1 h。之后置于超净工作台下,用无菌水洗净后,依次用以下3种不同体积分数消毒剂进行浸泡消毒处理:(1)75%乙醇消毒1 min,之后在0.1% NaClO浸泡5、10、15 min;(2)75%乙醇消毒1 min,之后在0.1%氯化汞浸泡5、10、15 min;(3)75%乙醇消毒30 s,之后在0.1% NaClO浸泡10 min,再在1% PPM浸泡1 h,2% PPM浸泡1 h,2% PPM浸泡2 h;最后再用无菌水冲洗5~6次,去除表面多余水分,利用解剖刀将顶芽叶鞘剝去,外植体长度约1 cm,以直插式插入诱导培养基上。每个处理接种10瓶,每瓶接种2个顶芽,每个处理重复3次。接种后放置在光照培养箱中进行培养,设置光照度1 000~4 000 lx,光照 12 h/d,温度28 ℃。观察外植体的培养动态,详细记录消毒死亡数、污染数和褐化死亡数,培养30 d后统计不同消毒方式下外植体的成活情况。外植体的污染率=污染数/接种数×100%;死亡率=(消毒死亡率+褐化死亡率)/接种数×100%;成活率=100%-(污染率+死亡率)。
1.4 不同顶芽的分类处理
超净工作台下,将外植体分为顶芽和腋芽2个种类,并且解剖成3种类型:A型顶芽(将顶芽外面包裹的叶鞘及几层未展开叶芽全部除掉,只剩下顶芽生长锥,外植体长度约1 cm,参见图1-B)、B型顶芽(只剥去顶芽外层叶鞘,保留顶芽生长锥和未展开叶芽,长度一般1~2 cm,参见图1-C)、C型顶芽(仅仅除去顶芽外部包裹的1层叶鞘,外植体一般 1~2 cm,参见图1-D)。然后插入诱导培养基上。每个处理接种10瓶,每瓶接种2个顶芽,每个处理重复3次。培养30 d后统计不同外植体类型的萌发情况。
1.5 外植体的启动诱导
设置外植体的初代诱导培养基,其主要成分是MS培养基+3%蔗糖+0.4%琼脂,研究不同细胞分裂素对顶芽诱导培养的影响,添加不同浓度的 6-BA 和ZT,在NAA浓度不变的情况下分别设置 6-BA 浓度梯度为1.0、2.0、3.0、4.0 mg/L,ZT浓度梯度为1.0、2.0、3.0、4.0 mg/L。每个处理接种10瓶,每瓶接种3个顶芽,每个处理重复3次(图1-E)。培养30、60 d后分别统计外植体诱导率和芽高。外植体诱导率= 外植体芽萌动数/无菌活外植体接种总数×100%,通过分析萌发率和顶芽分生情况来比较不同细胞分裂素的诱导效果。
1.6 数据处理
数据处理采用办公软件Excel 2016和统计分析软件SPSS 19.0进行差异分析。
2 结果与分析
2.1 不同的细胞分裂素浓度对外植体诱导率的影响
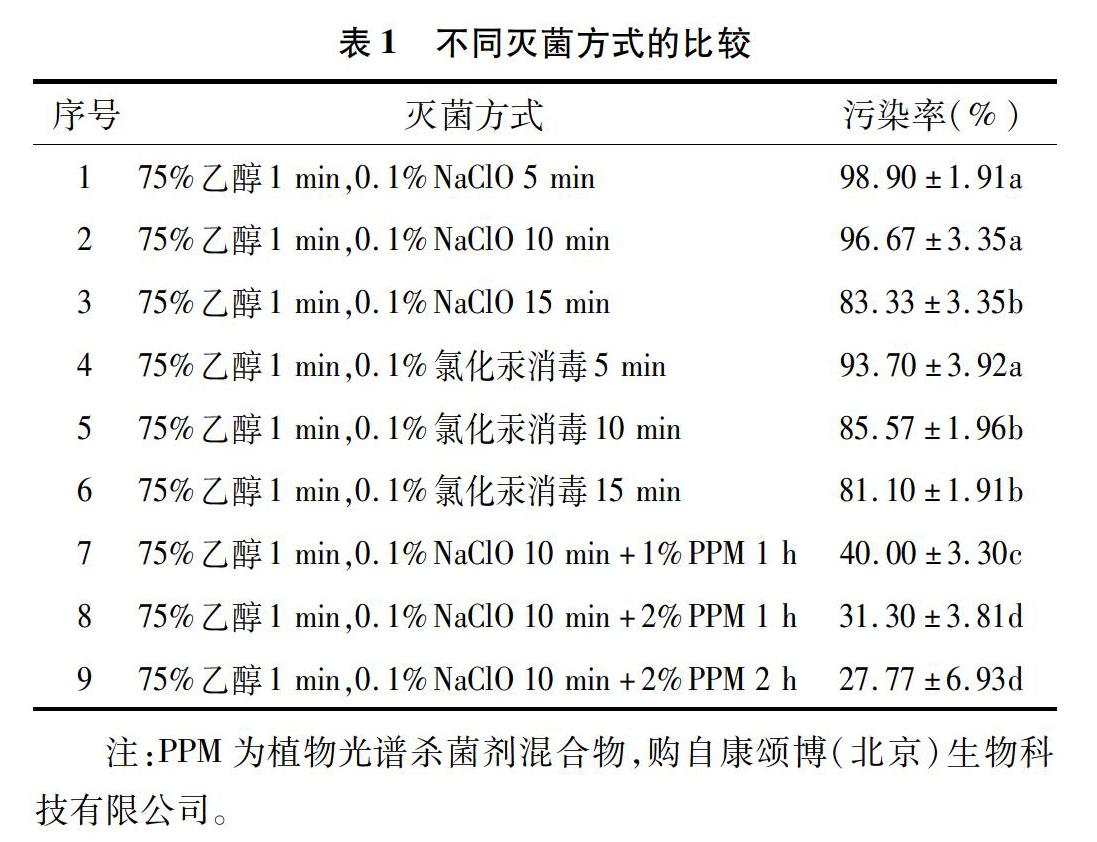
以莲顶芽为外植体材料,按照表1所设定的9种不同灭菌方法进行消毒和灭菌,培养30 d后记录外植体的消毒污染情况。从表1可以看出,不同处理方法的顶芽污染率存在显著差异。0.1% NaClO消毒5 min的污染率最高,达到98.90%。随着NaClO消毒时间的延长,消毒10 min时的污染率仅仅降低了2.23百分点,当消毒时间延长至15 min时,污染率下降15.57百分点;氯化汞消毒5 min时,污染率为93.70%,随着氯化汞消毒时间从 5 min 增加到 15 min时,污染率仅仅下降了12.60百分点;当采用传统表面消毒剂结合生物消毒剂(1%PPM)的方法(方法7)时,对比不用PPM浸泡的方式(方法2),其污染率下降了56.67%。当使用浓度更高(2%)的PPM浸泡1 h时,污染率是31.30%,2%PPM浸泡2 h,污染率下降到27.77%。因此,莲外植体消毒效果最好的方式是先用75%乙醇消毒1 min后,再用0.1% NaClO处理10 min,最后再在2% PPM中浸泡2 h。
2.2 不同外植体类型的比较
根据不同的解剖方式,将外植体分为A型、B型及C型。之后按照如表2设定的试验方法进行消毒及杀菌,定期观察外植体污染及存活情况并进行记录,培养30 d后外植体消毒试验结果如表2所示。
0.1%NaClO消毒5 min时,不同类型外植体污染率差异不显著,但是随着消毒时间的延长,不同类型的外植体污染情况差异显著,A类型外植体污染率最低,B类型外植体污染率次之,C类型外植体污染率最高。
在成活率的统计(表3)中,0.1% NaClO消毒 5 min 时,不同类型的外植体成活率均为0;消毒时间10 min时,不同类型的外植体成活率差异不显著;消毒时间15 min时,各类型外植体之间差异显著,A类型外植体成活率最低,B类型外植体次之,C类型外植体最高。
在死亡率的比较(表4)中,0.1% NaClO消毒 5 min 时, 不同类型的外植体死亡率差异不显著;消毒时间延长至10、15、20 min时,不同类型外植体差异显著,C类型外植体死亡率最低,B类型外植体次之,A类型外植体死亡率最高。
2.3 不同细胞分裂素对外植体诱导的比较
将大小一致的B型外植体芽接种至含有不同细胞分裂素的诱导培养基上进行初代培养,根据外植体生长的情况,对诱导率、外植体芽生长状况等生长指标进行统计,结果如表5所示,即添加不同浓度的6-BA和KT,外植体的诱导效果差异显著。对比CK,添加一定浓度的6-BA和KT后,均能在一定程度上缩短芽的萌发期限,提高诱导率。随着6-BA和KT浓度的增加,芽的萌发时间明显变短,诱导率提高,芽长度变短(表5、图1-F)。A1至A4诱导率存在显著差异,A4的诱导率达到84.43%,萌发时间也最短,但是后期芽苗生长势较弱,褐化严重。A3的诱导率同样可以达到83.33%,但是同时伴随有褐化问题。添加KT的培养基,B1至B4的诱导率明显提高,芽的萌发速度也变得更快。B4的诱导率最高,但是芽后期生长势弱(表5、图1-G),B3的诱导率对比B4低8.90百分点,芽萌发也较早、芽的生长很健壮。B1、B2的芽诱导率均不高、萌发速度也较慢。在6-BA和KT的对比试验中可以发现,KT相比 6-BA 不会出现褐化问题。因此,综合考虑诱导率和芽的生长情况,比较适合芽初代诱导培养的激素配方是B3。
3 讨论与结论
莲的组培再生体系建立极为困难,目前国内外有关莲通过愈伤组织实现再生培养成功的报道尚鲜少见。利用蓮顶芽或腋芽离体培养诱导再生的快繁技术,一直是各研究机构的研发热点[9]。花莲作为观赏花卉,属莲的一大类,在这方面的研究才刚刚起步。在花莲芽离体培养的前期研究中,由于莲地下茎长期在泥土中生长,芽自身多带细菌,因此消毒极其困难,容易褐化,生理活性差,花莲地下茎段芽离体组培效果不理想,最佳始芽的分化率仅为58.1%[16]。确定适宜的消毒剂类型和消毒时间对于外植体灭菌尤为重要,在植物组织培养中,氯化汞和次氯酸钠是目前比较常见的2种外植体消毒剂。大量的研究证明,氯化汞作为一种重金属强消毒剂,在杀死外植体表面细菌的同时,通常也大大降低了植株细胞的活性[19]。次氯酸钠性质温和,但是单纯使用消毒效果不佳,污染率高;消毒液的混合使用可以有效地降低外植体的污染率[20],因此本试验创新了传统的消毒方法,运用次氯酸钠搭配新型生物细菌灭菌剂PPM,有效降低了污染率,提高了成活率。试验结果表明,普通的消毒剂对莲外表面顶芽所带细菌有一定杀灭作用,但是对其内源菌的抑制效果很有限。培养过程中发现,有些外植体在培养后1周左右,并没有出现污染情况,但是随着培养时间的延长,外植体周边逐渐开始出现一些细菌污染的情况。因此,本试验设计了用0.1%次氯酸钠消毒10 min后,再用1% PPM浸泡1 h、2% PPM浸泡1 h以及2% PPM浸泡2 h的多种改良方案。结果证明,先用75%乙醇1 min,后用0.1%次氯酸钠消毒10 min,最后在2% PPM中浸泡2 h可获得较好的消毒效果,诱导率为74.43%,且芽苗生长快,活力旺盛,成活率高。
Enjalric等研究认为,植物体不同部位带菌多少是不一样的,其带菌数量从多到少依次为腋芽>茎尖>生长点[21]。本研究对莲的顶芽生长锥、顶芽及腋芽的不同灭菌效果进行了对比研究。试验结果表明,同样的消毒处理方式下,A型外植体的污染率最低,B型次之,C型最高;随着消毒时间的延长,A型外植体的死亡率最高,B型次之,C型最低;证明生长点携带的细菌更少,但是却因为切割得更加微小(0.5 cm)和幼嫩,一是容易被消毒剂杀死,二是容易褐化死亡。而B型顶芽对比A型顶芽,解剖时,并没有把外层叶芽全部去除,生长锥在外边叶芽的包裹之下,因而被消毒剂伤害较小,具有较低的死亡率,同时由于带菌较少,因此污染率较低;C型腋芽由于携带细菌较多,虽然死亡率偏低,但是污染率太高。因此综合比较污染源、死亡率和成活率等因子,B型芽属于比较理想的外植体类型。
在生理生化方面,激素是植物生长和发育的调节因子,通过优化培养基的激素组成成分可以提高外植体诱导率。有研究表明,细胞分裂素在荷花芽诱导和增殖过程中起重要作用。本试验同样发现,随着6-BA和KT浓度的增加,均能有效提高芽的诱导率。但是当添加4.0 mg/L 6-BA时,诱导率达到84.43%,但是诱导芽会出现后期生长弱和褐化的现象。添加4.0 mg/L KT时,诱导率可以达到83.33%,但是芽同样出现生长孱弱的情况。对比3.0 mg/L KT,诱导率为74.43%,诱导芽生长强健;而3.0 mg/L 6-BA,诱导率为83.33%,但是容易褐化。最后试验表明,在莲的启动培养中,适宜的激素为KT,浓度为3.0 mg/L,诱导率较高,初始芽的生长最为健壮。
参考文献:
[1]孔德政. 荷花的民族植物学及河南地区品种资源研究[D]. 郑州:河南农业大学,2011.
[2]田代科,张大生. 莲叶何田田:世界荷花研究进展[J]. 生命世界,2014(6):40-45.
[3]闵 睫,向言词,田代科. 荷花切花消费需求及市场潜力分析[J]. 安徽农业科学,2018,46(22):212-217.
[4]任莉萍,曹小汉,张金波,等. 荷花遗传育种研究进展[J]. 榆林学院学报,2019,29(6):59-62.
[5]陈丽萍,周可明,张志友. 莲藕组织培养研究进展[J]. 现代农业科技,2008(20):15-16.
[6]Yang M,Xu L M,Liu Y L,et al. RNA-seq uncovers SNPs and alternative splicing events in Asian Lotus(Nelumbo nucifera) [J]. PLoS One,2015,10(4):e0125702.
[7]He Z C,Liu S J. A study on callus introduction and regeneration of plantlet from embryo culture of lotus[J]. Acta Hydrobiologica Sinica,1987,11:278-280 .
[8]山本雄慈,松本理. ハスの组织培养(第1报):生长点カらの苗条诱导[J]. 山口农试研报,1988(40):44-48.
[9]李良俊,赵有为. 莲藕茎尖培养苗的快繁技术[J]. 南京农业大学学报,1998,21(1):113-115.
[10]徐 君,李静会,李 欣,等. 荷花顶芽初代组织培养 [J]. 江苏农业科学,2013,41(3):38-39.
[11]Arunyanart S,Soonstrony S. Mutation induction by γ- and X-ray irradiation in tissue cultured lotus[J]. Plant Cell Tissue and Organ Culture,2002,70:119-122.
[12]孔德政,李艳妮,杨秋生,等. 荷花胚组织培养的初步研究[J]. 河南科学,2007,25(4):593-595.
[13]Buathong R,Saetiew K,Phansiri S,et al. Tissue culture and transformation of the antisense DFR gene into lotus (Nelumbo nucifera Gaertn.) through particle bombardment[J]. Scientia Horticulturae,2013,161:216-222.
[14]Liu Y L,Chaturvedi P,Fu J L,et al. Induction and quantitative proteomic analysis of cell dedifferentiation during callus formation of lotus (Nelumbo nucifera Gaertn. spp. baijianlian) [J]. Journal Proteomics,2016,131:61-70.
[15]何碧珠,曾明星,赵时端,等. 建莲茎尖离体培养研究初报[J]. 福建农林大学学报(自然科学版),2002,31(1):59-61.
[16]李良俊,何小娣,趙有为,等. 莲藕茎尖培养技术的初步研究[J]. 江苏农学院学报,1995,16(3):31-34.
[17]Liu Q Q,Zhang D S,Liu F L,et al. Micropropagation of Nelumbo nucifera ‘Weishan Hong through germfree mature embryos[J]. In Vitro Cellular Developmental Biology-Plant,2019,55:305-312.
[18]Taha R M,Othman R. Effects of NAA and BAP,double-layered media,and light distance on in vitro regeneration of Nelumbo nucifera Gaertn.(lotus),an aquatic edible plant[J]. The Scientific World Journal,2014(12):74518.
[19]李国树,徐成东,王 波,等. 植物组织培养节能降耗研究进展[J]. 植物学研究,2014,3:105-110.
[20]周俊辉,周厚高,刘花全. 植物组织培养中的内生细菌污染问题[J]. 广西植物,2003,23(1):41-47.
[21]Enjalric F,Carron M P,Lardet L,et al. Contamination of primary cultures in tropical areas:The case of Hevea brasiliensis[J]. Acta Horticulturae,1988,225:57-65.
