孕酮对缺氧缺血性新生大鼠海马神经元凋亡和自噬的影响
2021-07-31朱惠芳钟小明赖珊莹陈章宇廖红群罗开源
朱惠芳,钟小明,赖珊莹,陈章宇,廖红群,罗开源,3
(1. 赣南医学院第一附属医院儿童医学中心新生儿科;2. 赣南医学院2018级硕士研究生;3. 赣南医学院第一附属医院儿童医学中心儿内科,江西 赣州 341000)
新生儿缺氧缺血性脑病(Hypoxic ischemic encephalopathy,HIE)是常见的一种新生儿疾病,主要由围产期窒息引起的脑组织部分或完全缺氧、脑供血流减少或中断导致胎儿或新生儿的脑损害,严重情况下可直接造成患儿死亡,重度HIE 死亡率高达35%[1-2]。存活的新生儿中,严重缺氧的占0.2%~1%,常伴有不同程度的神经系统损害,后遗神经缺陷达20%~30%[3]。其发病原因比较复杂,致病机制尚未完全明确,可能与缺氧缺血后继发神经细胞代谢障碍、线粒体损伤和氧化应激反应导致大量氧自由基产生、炎症反应、神经细胞死亡等相关[4-5]。目前对HIE 尚无成熟有效的治疗方法。因此,明确其致病机制,是寻找治疗HIE策略的有效途径。
HIE 最主要的病理生理机制是大脑组织缺氧,而氧气是保证细胞进行新陈代谢,包括能量代谢和物质代谢的基本要素,它们是机体维持生命活动的基础。因此,大脑组织细胞经历缺氧合并缺血,使新陈代谢中断,最终影响神经细胞的活性,导致死亡,神经细胞死亡是脑损伤的最直接后果[6-8]。细胞死亡方式主要包括坏死、自噬和凋亡。通常情况下,凋亡引起的细胞死亡,称为Ⅰ型死亡;自噬可通过加快细胞的代谢并协助细胞适应环境,以达到促进细胞存活的目的,但“吃”了细胞内大部分细胞器和细胞质的自噬也会导致细胞死亡,称为Ⅱ型死亡。在缺氧缺血条件下,早期细胞凋亡信号通路可通过Caspase 依赖和不依赖的途径被激活,主要发生在线粒体上[9]。Caspase 是半胱氨酸蛋白水解酶,既可作为细胞凋亡途径的起始因子,如Caspases-8和Caspases-9;又可作为细胞凋亡的执行者,如Caspase-3。此外,抗凋亡蛋白和促凋亡蛋白,如B淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)和Bcl-2相关X 蛋白(Bcl-2-Associated X,Bax)表达水平的改变,也参与细胞凋亡的调控。自噬主要发生在内质网上,与细胞凋亡通路之间存在部分交叉调控,两者之间存在相互制约的关系[10]。但由于自噬的最终结局既可能介导细胞的存活,也可能导致细胞的死亡[11-12],因此,明确细胞自噬在神经损害过程中的作用,是阐明HIE过程中神经元死亡的关键。
磷脂酰肌醇3-激酶(Phosphoinositide 3-kinase,PI3K)是一条保守的信号通路,可参与细胞的增殖、分化和凋亡等多种细胞功能的调节。此外,PI3K 信号通路同样参与某些中枢神经系统的疾病,比如,脑缺氧缺血再灌注导致的脑损伤[13]。在接受细胞内外的刺激以后,PI3K 信号通路被激活,丝氨酸-苏氨酸蛋白激酶B(Protein Kinase B,PKB),又被称为AKT,发生磷酸化并被激活。活化的AKT 可通过多种途径对下游的信号分子及靶蛋白进行磷酸化,进而发挥抗凋亡的作用[14]。近年来的研究表明,孕酮(Progesterone,PG)可减轻缺氧缺血性脑损伤,营养和保护神经细胞,减少神经细胞的凋亡,促进神经功能的恢复等[15-16]。缺血缺氧主要损伤大脑皮层、海马以及大脑室下区神经元。海马及海马环路作为大脑古皮质,是哺乳类动物大脑皮质中被研究得最详细的一个部位,在空间记忆力、学习能力以及情感调控中发挥重要作用。为探讨孕酮对缺氧缺血性脑损伤过程中海马神经细胞的死亡的影响,本研究采用改良的RICE 法制备新生大鼠缺氧缺血脑损伤模型[17],观察模型动物大脑损伤侧海马区神经元发生凋亡和自噬的情况,并检测AKT 信号通路在脑损伤过程中是否激活,以期为临床治疗新生儿HIE提供新的思路。
1 材料与方法
1.1 材料孕酮购买于Sigma-Aldrich。兔抗大鼠AKT多克隆抗体、兔抗大鼠磷酸化AKT-S473多克隆抗体、兔抗大鼠LC3多克隆抗体、兔抗大鼠Caspase-3多克隆抗体、兔抗大鼠Bcl-2 多克隆、兔抗大鼠Bax多克隆抗体、兔抗大鼠Beclin-1 多克隆抗体、兔抗大鼠p62 多克隆抗体和兔抗大鼠GAPDH 多克隆抗体均购买于北京Proteintech 公司。Annexin V-FITC 细胞凋亡检测试剂盒和Tunel 试剂盒均购买于碧云天公司。Neurobasal-A 培养基购买于Gibco 公司。B-27和L-谷氨酰胺购买于Invitrogen公司。
1.2 方法
1.2.1 实验动物与分组40只7日龄清洁级SD 大鼠由赣南医学院动物实验中心提供,体重为(17.2±0.5)g,雌雄不限。饲养环境温度为22 ℃~24 ℃,湿度为40%~50%。随机分为4 组,每组10 只:假手术组(Sham)、模型溶剂对照组(HIBD+Vehicle)、模型孕酮低剂量组(HIBD+PG 5 mg·kg-1)和模型孕酮高剂量组(HIBD+PG 10 mg·kg-1)。
1.2.2 动物模型建立本文根据RICE 法并结合改良方法进行缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)模型构建[17]。本动物实验所有操作获得赣南医学院动物实验伦理委员会批准。SD 新生大鼠腹腔注射溶剂对照或孕酮(5 mg·kg-1,10 mg·kg-1)1 h 后,乙醚吸入麻醉。假手术组动物仅对左侧颈总动脉做剥离处理,不做缺血和缺氧处理;模型组对左侧颈总动脉进行分离并结扎。每只动物手术时间控制在5~10 min。手术结束后,将新生大鼠放回母鼠身边休息1.5 h。然后置于37 ℃恒温培养箱中,以1.5 L·min-1的流速持续通入湿化的8%O2+92%N2的混合气体,缺氧处理1 h 后,放回母鼠身边。24 h以后,颈椎脱臼处死大鼠,取大鼠的海马组织进行下一步的实验检测。
1.2.3 原代海马神经元培养剥离未经任何处理的7 日龄SD 大鼠海马组织,置于4°C 预冷的DMEM高糖培养基中,剪刀剪碎后,加入2 mg·mL-1木瓜蛋白酶和0.1 mg·mL-1的DNA 消化酶,37 °C 消化30 min后,加入1 mL的胎牛血清终止反应。经离心并计数后,取1×106的细胞接种至经多聚赖氨酸包被的6孔板中,无血清的DMEM 高糖培养基培养4 h 后,将未贴壁的细胞吸掉,并清洗一次,加入Neurobasal-A培养基,添加2%的B-27 以及2 mmol·L-1L-谷氨酰胺,继续培养。
1.2.4 糖-氧剥夺实验原代海马神经元贴壁后,细胞密度约80%更换无糖无血清的MEM 培养基。置于经氮气稀释的8%O2培养箱中进行糖-氧剥夺处理。1 h 后,细胞培养基更换成Neurobasal-A,添加2%的B-27 以及2 mmol·L-1L-谷氨酰胺,继续置于37°C,5%CO2培养箱中。
1.2.5 免疫印迹假手术组与模型组大鼠的海马组织取材后,称重,剪刀剪碎,加入RIPA裂解液,超声裂解组织至清亮后,离心,测定蛋白浓度。SDS-PAGE胶电泳分离蛋白,转膜后孵育特异性一抗二抗,经ECL显色后在ImageQuant LAS 4000 mini仪器曝光。
1.2.6 免疫组化取假手术组与模型组大鼠的大脑组织,经10%多聚甲醛固定过夜后,脱水、石蜡包被、切片(5 μm),按免疫组化的常规操作对石蜡片进行脱蜡和复水。然后按照Tunel 凋亡检测试剂盒说明书进行操作,大脑组织经DAB 染色后在普通显微镜下(Nikon ECLIPSE Ti)观察和拍照。
1.2.7 细胞凋亡大鼠海马神经元分离培养后,取50 nmol·L-1孕酮或等量体积的溶剂预处理细胞。然后对细胞进行糖-氧剥夺1 h。12 h 后收集海马神经元,按照Annexin V-FITC/PI 凋亡试剂盒说明书进行操作,采用流式细胞仪检测凋亡的神经细胞数。
1.2.8 统计学方法采用SPSS 17.0 分析数据和GraphPad Prism Software 4.0 作图比较处理,数据均以±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 孕酮抑制HIBD 模型大鼠的AKT 活性如图1A所示,7日龄新生大鼠5 mg·kg-1或10 mg·kg-1孕酮预处理1 h 后,结扎左侧颈总动脉(图1B)制备缺血模型。将新生大鼠置于8%O2+92%N2通气的密闭培养仓中,进行缺氧处理1 h,各组大鼠的体重无显著性差异(图1C)。24 h 后,取大鼠左侧脑的海马神经组织,进行免疫印迹检测,结果显示孕酮可剂量依赖性抑制磷酸化AKT的水平(图1D,1E)。
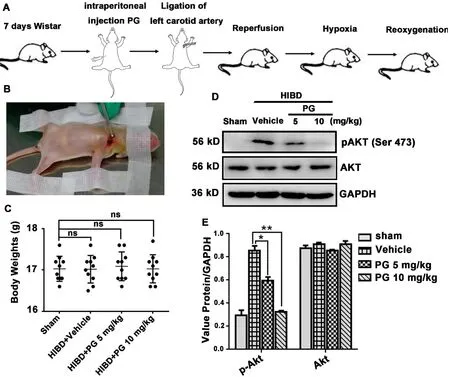
图1 孕酮抑制HIBD新生大鼠海马神经元AKT的激活
2.2 孕酮抑制神经元凋亡如图2A 所示,假手术组新生大鼠的神经元发生凋亡的数目非常少,而在模型组中,大量的神经元凋亡和死亡,孕酮的预处理可剂量依赖性抑制缺血缺氧造成的神经元死亡。免疫印迹检测结果发现,在模型组中,抗凋亡蛋白Bcl-2 的表达水平显著下降,而促凋亡蛋白Bax 的水平上升。此外,细胞凋亡的主要执行蛋白Caspase-3的活化型水平也明显升高(图2B,2C)。孕酮处理后Bcl-2、活化型Caspase-3 蛋白表达降低,Bax 蛋白表达增加。

图2 孕酮抑制海马神经元凋亡
2.3 孕酮抑制海马神经元自噬在模型组中,LC3-Ⅱ表达增加,而孕酮处理后,LC3-Ⅱ表达降低。与假手术组相比,模型组Beclin-1 的表达增加,可溶性p62 蛋白表达降低;孕酮处理后,Beclin-1 表达降低,可溶性p62蛋白表达增加(图3A,3B)。

图3 孕酮抑制海马神经元自噬
2.4 孕酮通过AKT 信号通路抑制海马神经元凋亡如图4A 所示,OGD 处理以后,神经元的形态和发生细胞凋亡的数量都发生了显著改变。而孕酮处理后,可部分抑制OGD 所诱导的细胞凋亡。孕酮的化学结构式如图4B所示。经免疫印迹检测发现,OGD处理的神经元促凋亡相关蛋白Bax以及活化型Caspase-3 的水平升高,而孕酮处理后,AKT 的活性被抑制,Bax 以及活化型Caspase-3 的水平也明显降低(图4C-4F)。流式细胞分析结果表明,孕酮可抑制OGD 诱导的早、晚期细胞凋亡的发生(图4G,4H)。

图4 孕酮通过AKT信号通路抑制海马神经元凋亡
3 讨 论
新生儿缺氧缺血性脑病主要是围生期窒息造成的脑部损害,这种损伤对中枢神经系统带来的影响可能是永久性的,甚至造成死亡。一般来说,神经元的死亡是导致神经损伤的最主要的病理原因。因此,充分认识神经元死亡的机制,是研究和开发缺氧缺血性脑病治疗策略的关键。从生理角度来看,大鼠脑部供血方式与人类相似,都是颈内动脉和椎动脉在大脑底部形成Willis 环;从发育角度看,7 日龄大鼠与人类的新生儿(≤28 天)发育水平是相当的。仅结扎一侧颈动脉不能建立理想的缺氧缺血模型,只有在结扎动脉基础上同时给予缺氧处理才能在结扎动脉侧大脑形成缺血缺氧性脑损伤(Hypoxicischemic brain damage,HIBD)的病变,使用该模型研究新生儿HIE疾病模型的价值已获得肯定。本课题通过RICE 改良法构建新生大鼠缺氧缺血模型,并在此基础上研究孕酮对缺氧缺血导致的神经元死亡的影响。流式细胞检测结果表明,模型组动物海马区的神经元发生了明显的凋亡,而孕酮的提前干预可显著降低凋亡的细胞数。通过对自噬信号通路相关蛋白的检测发现,缺氧缺血新生大鼠的结扎动脉侧大脑海马组织同样发生了自噬,而孕酮的处理可显著降低自噬的水平。由此可见,在缺氧缺血性脑病发生的早期(24 h 内),病变区域神经元同时发生了凋亡和自噬,细胞形态也发生了相应的变化。对相关机制做进一步研究发现,AKT 信号通路在凋亡和自噬过程中是被激活的。而使用AKT 抑制剂处理原代海马神经元,可逆转由糖-氧剥夺导致的凋亡和自噬,说明神经元的凋亡和自噬一定程度上依赖于AKT信号通路。
作为天然的孕激素,孕酮在临床上广泛用于缓解更年期妇女的激素水平改变导致的疾病。而在动物疾病模型中,如阿尔茨海默病或中风,孕酮可作为神经营养因子,表现出良好的神经保护作用[17-18]。而在HIBD 动物模型中,孕酮可抑制巨噬细胞从血液中渗透到大脑组织中,并减少炎症因子如肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白介素-1(Interleukin-1,IL-1)等的释放[19-20]。从机制上来看,MAPK(ERK1/2)和PI3K/AKT 是涉及到孕酮的神经保护作用的主要信号通路。我们的研究结果表明孕酮可作为治疗HIBD、抑制凋亡和自噬引起的细胞死亡的潜在药物。本研究存在不足是仅停留在动物试验上的模型研究,因此,为更好更全面地分析孕酮在临床上的治疗效果,还需要进一步开展临床研究。
