16 249例川东北地区珠蛋白生成障碍性贫血基因检测结果分析*
2021-07-29宋琪玲何勇均黄思月刘青松
宋琪玲,何勇均,黄思月,刘青松
1.川北医学院附属医院产前诊断中心,四川南充 637000;2.四川赛尔医学检验有限公司,四川南充 637131;3.四川省成都市妇女儿童中心医院产前诊断中心,四川成都 610032
珠蛋白生成障碍性贫血是目前世界范围内最常见且发病率较高的遗传学溶血性疾病,主要是由珠蛋白基因缺失或突变等原因导致的珠蛋白合成障碍的单基因遗传病。珠蛋白生成障碍性贫血具有明显的地域性,在我国呈现出南高北低的发病特点,主要以广东、广西、海南、四川等地区发病率较高,珠蛋白生成障碍性贫血基因携带率为1.92%~14.96%[1]。四川地域广阔,地形多样,兼具平原和丘陵,民族多样。近年来,有研究报道四川地区珠蛋白生成障碍性贫血发病率呈上升趋势[2],但目前对川东北地区,包括南充、遂宁等,较大数据的珠蛋白生成障碍性贫血基因结果分析较少,为更加准确地了解南充及遂宁等地区珠蛋白生成障碍性贫血的发病特点,准确预防和诊断本地区珠蛋白生成障碍性贫血,减少出生缺陷,本研究对川东北地区16 249例珠蛋白生成障碍性贫血患者进行筛查并分析其基因型,现报道如下。
1 资料与方法
1.1一般资料 选取2016年1月至2019年12月在川北医学院附属医院及四川赛尔医学检验有限公司接受珠蛋白生成障碍性贫血基因检测的患者共16 249例。其中男1 845例,女14 404例,年龄0个月至63岁。本研究经川北医学院附属医院伦理委员会审查通过。
1.2方法
1.2.1DNA分离提取 采用乙二胺四乙酸二钾无菌真空抗凝管采集研究对象外周血标本2 mL,采用全自动DNA提取仪磁珠法提取DNA,所用仪器和试剂购自中山大学达安基因股份有限公司。
1.2.2PCR扩增 将α、β-珠蛋白生成障碍性贫血PCR mix与Taq酶按要求混匀后,取45 μL分装到0.2 mL PCR管中;向已分装反应液的PCR管中加入5 μL DNA 模板,瞬时离心后,上机扩增。
1.2.3扩增产物的导流杂交 严格按照杂交试剂盒说明书(购自广东凯普生物科技股份有限公司)进行检测。
1.2.4结果判断 根据试剂盒提供的珠蛋白生成障碍性贫血基因检测结果分析图比较分析判断结果。
1.2.5室内质控和室间质控 室内质控:杂交膜条上有3个α和6个β正常对照点,每次试验所有正常对照点均应显色,突变纯合子及缺失纯合子除外,否则需重新提取DNA、PCR扩增、杂交。同时,为排除试验过程出现污染,防止假阳性结果出现,使用蒸馏水作阴性质控,全程参与提取、扩增、杂交,阴性质控结果无任何杂交显色点,视为试验过程无污染。此外,将已知珠蛋白生成障碍性贫血型别的阳性标本按照检测标本量分装保存于-70 ℃,试验时已知珠蛋白生成障碍性贫血型别的阳性标本与检测标本同步处理,全程参与提取、扩增、杂交,得到已知相同的珠蛋白生成障碍性贫血型别,视为该批珠蛋白生成障碍性贫血结果在控、可靠。室间质控:实验室每年均参加了中华人民共和国国家卫生健康委员会组织的2次珠蛋白生成障碍性贫血基因分型检测的室间质控,成绩均为100% 。
1.3统计学处理 使用 Excel2016建立数据库,采SPSS22.0统计软件对数据进行处理和分析,计数资料以例数和百分率表示。
2 结 果
2.1α-珠蛋白生成障碍性贫血患者的基因型和构成比 16 249例患者中共检出2 467例珠蛋白生成障碍性贫血患者,在2 467例珠蛋白生成障碍性贫血患者中α-珠蛋白生成障碍性贫血1 318例,构成比为53.43%(1 318/2 467),包含13种亚型。其中,靜止型α-珠蛋白生成障碍性贫血以αα/αα3.7为主,占37.10%(489/1 318);标准型α-珠蛋白生成障碍性贫血以--SEA/αα为主,占50.53%(666/1 318);血红蛋白H病以--SEA/αα3.7为主,占2.43%(32/1 318)。α-珠蛋白生成障碍性贫血的基因诊断结果及临床分型的详细情况见表1。
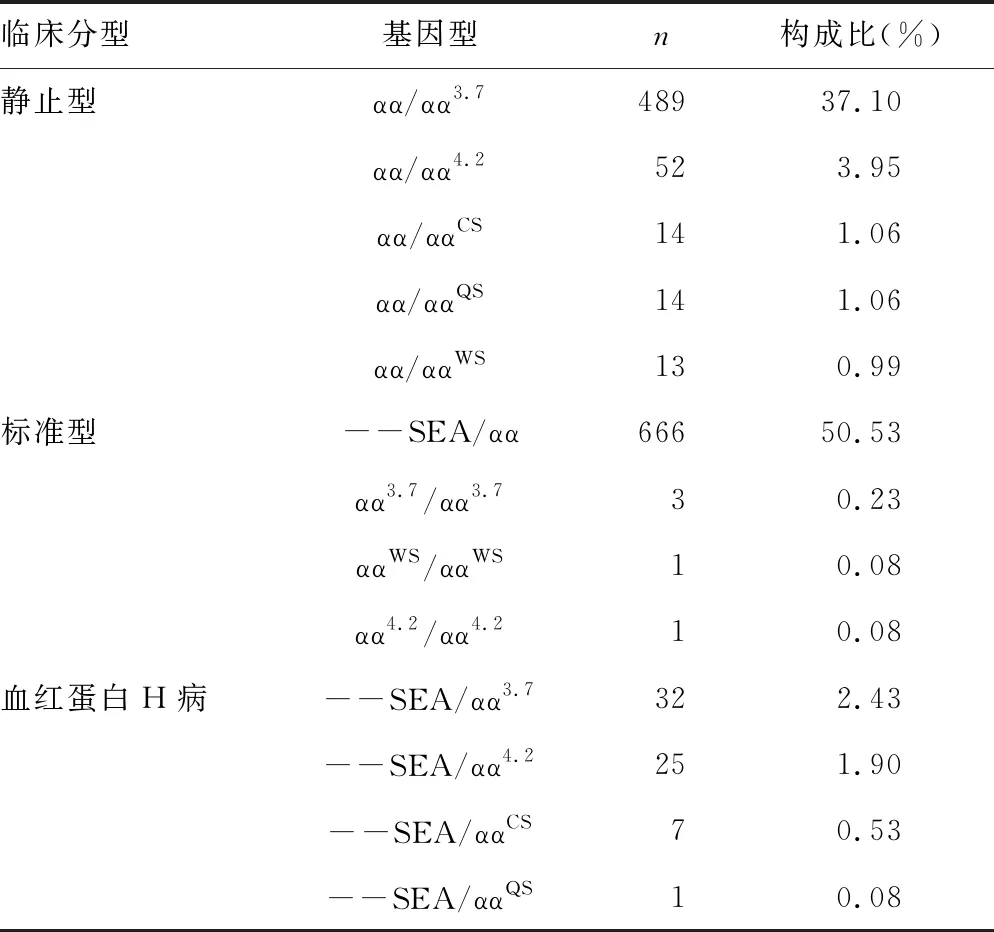
表1 α-珠蛋白生成障碍性贫血患者基因型和构成比
2.2β-珠蛋白生成障碍性贫血患者基因型和构成比 在2 467例珠蛋白生成障碍性贫血患者中β-珠蛋白生成障碍性贫血1 086例,构成比为44.02%(1 086/2 467),但全为轻型β-珠蛋白生成障碍性贫血。共检出11种突变基因型,包括CD17(A→T)、CD41/42(TCTT)、IVSII654(C→T)、NT-28(A→G)、29(A→G)、CD43(G→T)、CD14-15(+G)、CD71-72(+A)CD27-28(+C)、βE3(G→A)、CAP(A→C或-AAAC)。其中,轻型β-珠蛋白生成障碍性贫血以β17/βN为主,占37.20%(347/1 086);其次为β41-42/βN,占29.28%(318/1 086);β-珠蛋白生成障碍性贫血的基因诊断结果及临床分型的详细情况见表2。
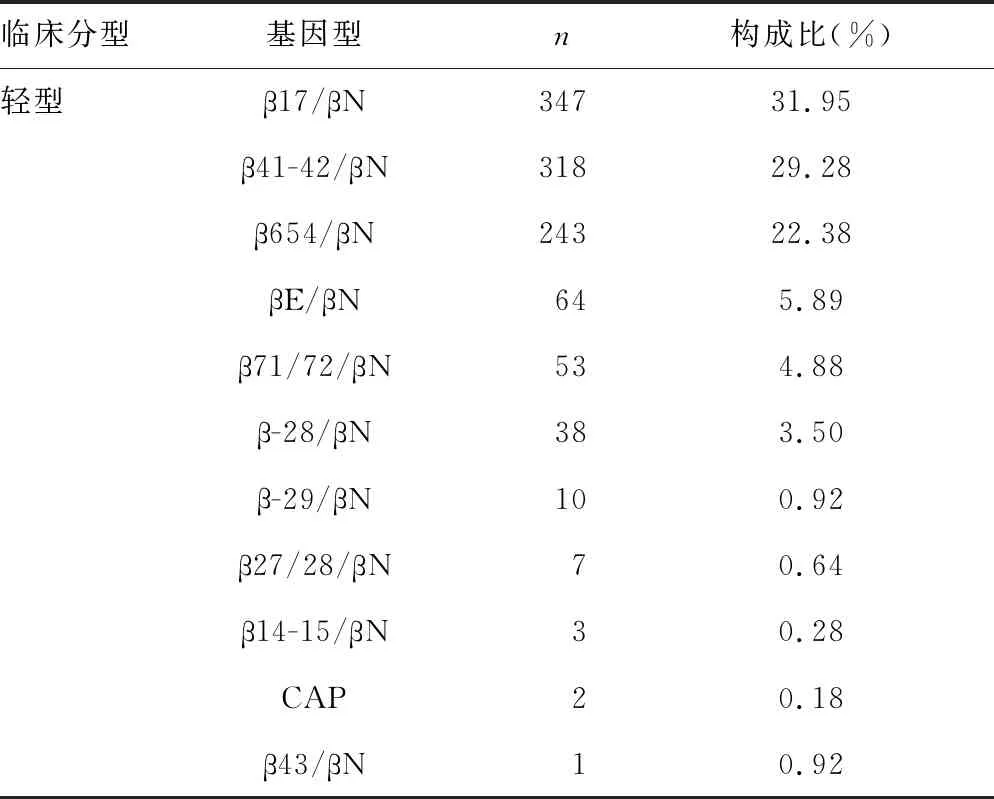
表2 β-珠蛋白生成障碍性贫血患者基因型和构成比
2.3α合并β-珠蛋白生成障碍性贫血基因型和构成比 在2 467例珠蛋白生成障碍性贫血患者中α合并β-珠蛋白生成障碍性贫血共63例,构成比为2.55%(63/2 467),包含9种亚型。其中以--SEA/β41-42占比最高,占33.33%(21/63);其次为αα3.7/β17,占15.87%(10/63);α合并β-珠蛋白生成障碍性贫血的基因诊断结果及临床分型的详细情况见表3。
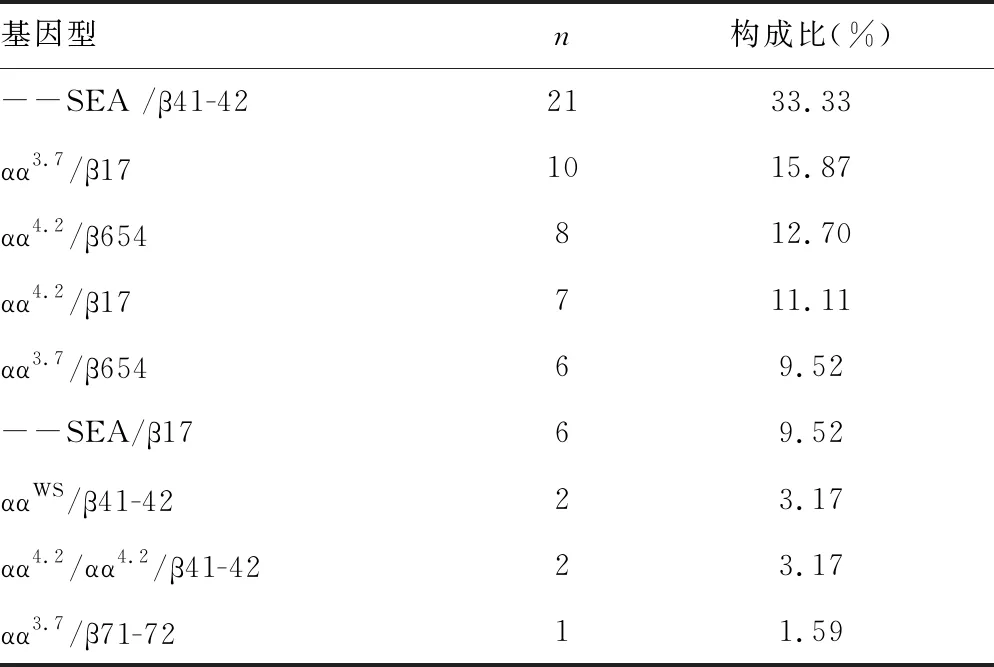
表3 α合并β-珠蛋白生成障碍性贫血基因型和构成比
3 讨 论
本研究基因诊断阳性率为15.18%(2 467/16 249),明显高于已报道的四川地区珠蛋白生成障碍性贫血基因检测平均阳性率[1]。本次研究样本较大,基本覆盖南充地区,遂宁地区部分覆盖,且均采用基因检测进行诊断,更能准确反映川东北地区人员珠蛋白生成障碍性贫血基因携带情况。在2 467例基因诊断阳性患者中,α-珠蛋白生成障碍性贫血有1 318例,占53.43%(1 318/2 467);β-珠蛋白生成障碍性贫血有1 086例,占44.02 %(1 086/2 467);α合并β-珠蛋白生成障碍性贫血63例,占2.55%(63/2 467)。总体依然是以α-珠蛋白生成障碍性贫血为主,与其他研究一致[2-4]。
在1 318例α-珠蛋白生成障碍性贫血中,最常见的是SEA杂合缺失,共666例,占50.53%(666/1 318);其次是3.7位点杂合缺失,共489例,占37.10%(489/1 318)。本研究中α-珠蛋白生成障碍性贫血以--SEA/αα、αα/αα3.7为主,该结果与部分研究报道的α-珠蛋白生成障碍性贫血基因常见基因型一致[3-6]。当SEA杂合缺失患者进行婚配时,对其配偶进行珠蛋白生成障碍性贫血基因检测,可预防血红蛋白H病患儿及重型珠蛋白生成障碍性贫血患儿的出生。本研究共检出血红蛋白H病65例,占4.93%(65/1 318)。血红蛋白H病的临床表现个体化差异较大,及早的采用珠蛋白生成障碍性贫血基因检测确诊有利于疾病治疗,尤其是儿童患者的血红蛋白H病[7]。
1 086例β-珠蛋白生成障碍性贫血中最常见的是17位点杂合突变,共347例,占31.95%(347/1 086);其次是41~41位点杂合突变,共318例,占29.28%(318/1 086)。与研究报道的珠蛋白生成障碍性贫血基因型分布基本一致[7-8]。本研究中1 086例患者全为轻型β-珠蛋白生成障碍性贫血,原因一方面是样本数有限,另一方面中间型和重型β-珠蛋白生成障碍性贫血临床表现较重,大部分可能已经前往其他医院进行治疗,无法收集资料。中间型β-珠蛋白生成障碍性贫血临床表现差异大,且很难根据其基因型预测临床表现;重型β-珠蛋白生成障碍性贫血患儿多在出生后数月患病,目前尚无理想的治疗方法[9]。
在2 467例珠蛋白生成障碍性贫血患者中α合并β-珠蛋白生成障碍性贫血共63例,构成比为2.55%(63/2 467),包含9种亚型。α合并β-珠蛋白生成障碍性贫血又称复合型珠蛋白生成障碍性贫血,与其他疾病不同,是由α-珠蛋白和β-珠蛋白同时发生生成障碍,反而一定程度上缓解了α/β链的不平衡,使血红蛋白组成趋于正常,临床表现也相对较轻[10]。尽管α合并β-珠蛋白生成障碍性贫血患者在临床表现上不一定比单纯α-珠蛋白生成障碍性贫血或β-珠蛋白生成障碍性贫血严重,但遗传给下一代的概率更高[11]。
综上所述,川东北地区珠蛋白生成障碍性贫血基因阳性率高于四川平均水平。α-珠蛋白生成障碍性贫血患者较β-珠蛋白生成障碍性贫血患者多见,α-珠蛋白生成障碍性贫血主要基因型为--SEA/αα、αα/αα3.7;β-珠蛋白生成障碍性贫血主要基因型为β17/βN、β41-42/βN。在四川东北部地区广泛开展珠蛋白生成障碍性贫血基因检测,有助于预防珠蛋白生成障碍性贫血患儿的出生。
