过量维生素D3灌胃的Wistar大鼠毒性反应及组织器官钙化观察
2021-07-24游赣花龙向淑周瑜黄晶何尤夫宋方田茂波肖燕邓世燕吴强
游赣花 ,龙向淑 ,周瑜 ,黄晶 ,何尤夫 ,宋方 ,田茂波 ,肖燕 ,邓世燕 ,吴强
1 贵州省食品药品检验所,贵阳550004;2 贵州大学医学院;3 贵州省人民医院心内科
维生素D(VitD)是一种脂溶性的维生素,主要包括VitD3和VitD2。VitD3的经典生物学作用是调节机体钙磷平衡,维持骨骼健康[1]。目前,VitD3临床应用广泛,然而随着VitD3补充剂的使用增加,不良反应时有发生。据报道,VitD3毒性多因使用不当,或在治疗佝偻病的过程中反复大剂量使用所致[2]。研究表明,外源性VitD 补充剂引起的钙磷调节异常可能导致组织器官损伤[3],如软组织中矿物质沉积引起骨外器官钙化和器官功能障碍[4]。值得注意的是,VitD 的毒性是由补充物引起的,而不是由饮食或日晒引起。为探讨VitD3的毒性反应及主要组织器官的病理改变,2020 年6~12 月,本研究以Wistar雄性大鼠为研究对象,观察短期内大剂量给予VitD3出现的毒性反应,以及心脏、肝脏、肾脏、肺、血管的钙化情况。现报告如下。
1 材料与方法
1.1 实验动物与主要材料 清洁型Wistar 雄性大鼠购自湖南天勤生物有限公司,共40 只,体质量(170±10)g,饲养于贵州医科大学实验动物中心,自由进食饮水,12 h 明/暗环境,温度20~26 ℃,相对湿度40%~70%,所有动物实验操作均符合贵州医科大学的动物福利伦理委员会的要求。VitD3注射液购自哈尔滨市华晟科技动物药品厂。二甲苯、无水乙醇购自天津富宇化工有限公司。山羊血清、二抗、DAB显色液、柠檬酸盐购自北京中杉金桥生物有限公司。骨形态发生蛋白2(BMP2)羊抗兔单克隆抗体购自武汉三鹰生物技术公司。4%多聚甲醛、苏木素、茜素红染液购自北京索莱宝科技有限公司。GZX-9246MBE 电热鼓风干燥箱购自上海博迅实业公司。DK-98-IIA 电热恒温水浴锅购自天津泰斯特仪器有限公司。倒置光学显微镜购自日本Olympus 公司。Nanodrop 分光光度仪购自美国Thermo-fisher 公司。PCR检测仪购自美国Illumina公司。逆转录试剂盒、荧光定量PCR 试剂盒购自日本TaKaRa 公司。引物合成由上海生物工程技术公司完成。
1.2 动物分组及给药方法 40 只Wistar 大鼠随机分为对照组和给药组,每组20 只。给药组给予VitD370 万U/kg 灌胃,对照组同法给予等体积蒸馏水,隔天1 次,共灌胃2 次。于灌胃结束1 周后处死大鼠,取心脏、肝脏、肾脏、肺、血管组织备检。
1.3 一般情况观察 灌胃后每天记录大鼠精神状态、进食情况、毛发、尿便性状及大鼠死亡情况。
1.4 组织器官病理变化及钙化情况观察 取大鼠心脏、肝脏、肾脏、肺、血管组织。①HE 染色观察组织器官病理变化:取适量组织经4%多聚甲醛固定48 h 后,常规石蜡包埋,5 μm 切片;依次放入二甲苯Ⅰ 10 min,二甲苯Ⅱ 10 min,100%乙醇5 min,95%乙醇5 min,95%乙醇5 min,80%乙醇5 min,75%乙醇5 min,蒸馏水洗10 min 脱蜡至水,苏木素染细胞核,伊红液染细胞质;再将切片依次放入95%乙醇5 min,95%乙醇5 min,100%乙醇5 min,100%乙醇2 min,二甲苯Ⅰ3 min,二甲苯Ⅱ5 min,脱水、透明,稍干后中性树脂封片,显微镜下观察并进行图像采集。②茜素红染色检测各组织器官钙化情况:取适量组织经4%多聚甲醛固定48 h后,常规石蜡包埋,5 μm 切片,用0.1%茜素红溶液(pH 8.3)37 ℃染色30 min,以磷酸盐缓冲液洗2~3次,置于显微镜下观察钙化灶。
1.5 组织器官中BMP2 mRNA及蛋白检测
1.5.1 qRT-PCR 法检测BMP2 mRNA 取心脏、肝脏、肾脏、肺、血管组织。使用TRIzol 提取组织总RNA,用NanoDrop2000 分光光度计检测RNA 浓度,计算A260/A280。按逆转录试剂盒说明书进行逆转录,得到cDNA 产物。根据SYBR PrimeScript 两步法进行扩增:95 ℃ 1 min 进行酶的活化,95 ℃ 15 s,60 ℃1 min 扩增 40 个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃15 s扩增熔解曲线,获得每个样品的Ct值。以GAP⁃DH 为 内参 ,以 2−ΔΔCt表 示目 的 基因 相对 表 达量 。BMP2 mRNA 上游引物序列为5'-TTCCATCAC⁃GAAGAAGCCGT-3',下游引物序列为5'-GAAACTC⁃GTCACTGGGGACA-3’。GAPDH 上游引物序列为5'-GGTGAAGGTCGGTGTGAACG-3',下游引物序列为5'-CCACTTTGTCACAAGAGAAGGC-3'。
1.5.2 免疫组化法检测BMP2 蛋白 取心脏、肝脏、肾脏、肺、血管组织。组织切片烤片,二甲苯脱蜡,梯度乙醇水化,柠檬酸盐抗原修复,3% H2O2阻断内源性过氧化物酶,山羊血清封闭。切片稍甩干,滴加一抗(BMP2 一抗稀释比为1∶100),4 ℃冰箱过夜。回收一抗,PBS 洗 3 次×10 min。滴加 HRP 标记的二抗,室温孵育1 h。DAB 显色,苏木素复染细胞核,梯度乙醇脱水,中性树胶封片,显微镜下观察并拍照保存。胞质出现棕黄色染判定为BMP2 阳性细胞。每张切片选5 个视野观察,阳性细胞百分比<5% 计 0 分,5%~25% 计 1 分,26%~50% 计 2 分,51%~75%计3 分,>75%计4 分;按染色强度计分,无着色计0分,浅黄色计1分,棕黄色计2分,黄褐色计3分;阳性细胞百分比计分与染色强度计分相乘,作为蛋白相对表达量[5]。
1.6 统计学方法 采用Graph Pad Prism7.0统计软件。计量资料以表示,两组间比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般情况变化 对照组大鼠一般情况良好;VitD3给药组大鼠死亡9只,其余大鼠存活至实验结束。给药组大鼠在给予VitD3的第2 天出现明显的精神萎靡、嗜睡、进食量减少、毛发无光泽、口角有血迹,出现咖啡色尿,解剖后发现弥漫性肺出血及肠梗阻现象。
2.2 两组大鼠组织器官病理变化 与对照组相比,给药组大鼠心肌肌纤维排列紊乱,部分心肌变性坏死、灶性钙盐沉积;部分肾小管内可见管型及钙盐沉积;肺组织内见肺泡扩张、部分肺泡融合,肺泡间隔纤维组织增生、玻璃样变性及炎细胞浸润;血管内膜欠光滑,中膜平滑肌细胞排列紊乱,并可见灶性钙盐沉积。给药组肝脏未见明显病理改变。见图1。
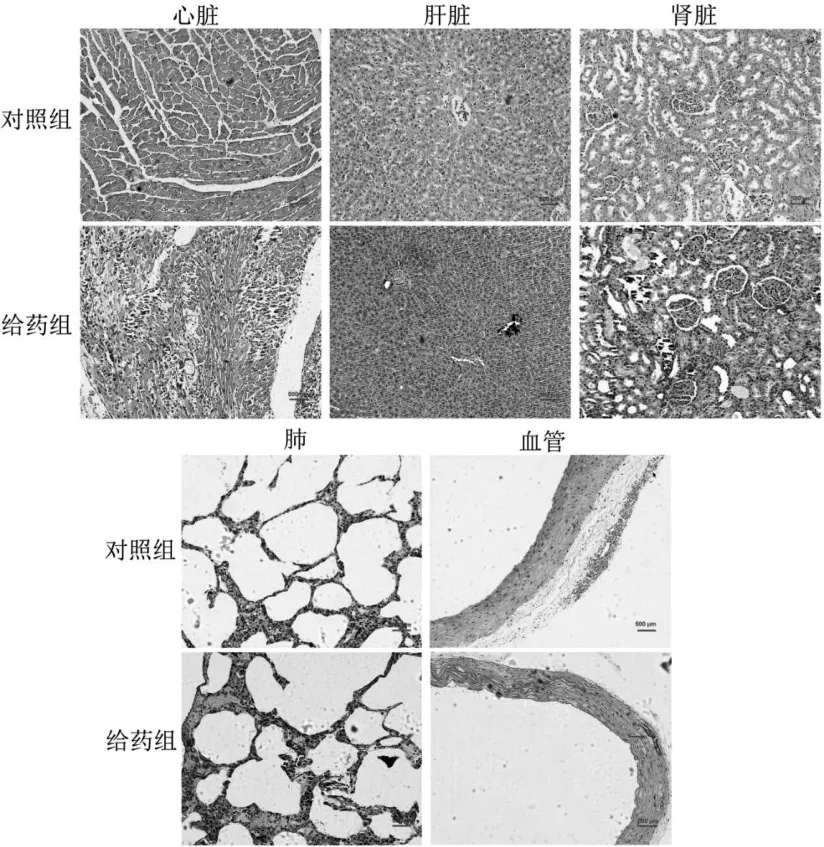
图1 给药组与对照组大鼠组织器官病理改变(HE染色)
2.3 两组大鼠组织器官钙化情况 对照组未见红色结节,给药组大鼠心脏、肾脏、肺、血管均可见较多红色结节,而肝脏中未见红色结节。见图2。

图2 给药组与对照组大鼠组织器官钙化情况(茜素红染色)
2.4 两组大鼠组织器官中BMP2 mRNA 表达比较 见表1。
表1 两组大鼠组织器官中BMP2 mRNA表达比较()
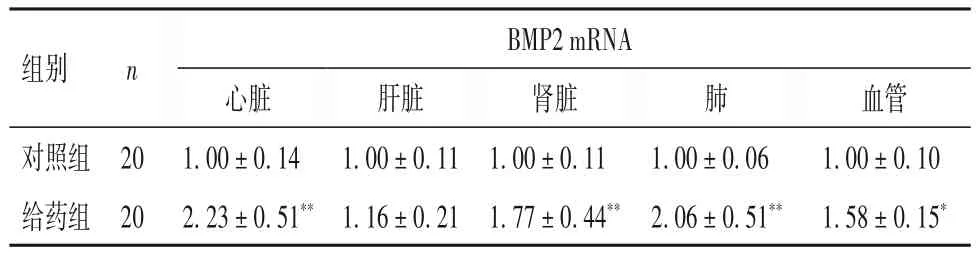
表1 两组大鼠组织器官中BMP2 mRNA表达比较()
注:与对照组比较,*P<0.05,**P<0.01。
BMP2 mRNA组别 n血管1.00±0.10 1.58±0.15*肺对照组 20给药组 20心脏1.00±0.14 2.23±0.51**肝脏1.00±0.11 1.16±0.21肾脏1.00±0.11 1.77±0.44**1.00±0.06 2.06±0.51**
2.5 两组大鼠组织器官中BMP2 蛋白表达比较 见图3、表2。

图3 两组大鼠组织器官中BMP2蛋白表达情况(免疫组化法)
表2 两组大鼠组织器官中BMP2蛋白表达比较()

表2 两组大鼠组织器官中BMP2蛋白表达比较()
注:与对照组比较,*P<0.05,**P<0.01。
BMP2蛋白组别 n肺心脏2.20±1.10 5.60±1.67**血管1.40±0.55 4.40±1.67*肝脏0.60±0.55 0.40±0.55对照组 20给药组 20肾脏1.80±0.45 8.20±2.49**0.20±0.45 6.60±1.95**
3 讨论
VitD 是体内骨骼和矿物质平衡所必需的营养元素,其生物学效应通过肾脏将VitD 的活性形式1α,25(OH)2D3转移到存在VitD 受体(VDR)的靶器官中来实现。1α,25(OH)2D3-VDR 信号不仅存在于调节钙和磷酸盐稳态的VitD 经典靶器官如肠道、骨骼、肾脏和甲状旁腺中,还存在于非VitD 的经典靶细胞中,包括皮肤角质形成细胞、胰腺β 细胞、心肌细胞等[6]。
目前,有关VitD 多系统作用的科学证据不断增加,VitD 影响着包括肾脏、心脏在内的多种器官,并且在器官的发育和功能维持中发挥重要作用[7-8]。研究表明,VitD 与急性肾损伤之间存在复杂的关系。VitD 缺乏或过量可引起急性肾损伤,而且急性肾损伤还可导致VitD 的稳态和功能失调,且VitD 可以作为急性肾损伤治疗中潜在的新型预后生物标志物和治疗药物。此外,即使在无毒剂量下,VitD 在心血管病理生理学中也会呈现两相剂量反应曲线,并可能造成有害影响[9]。
软组织中发生的病理性钙化沉积称为异位钙化。当钙磷乘积大于40时,磷酸钙结晶开始在身体靶组织器官累积,造成器官功能障碍甚至衰竭[10]。本研究中,当大鼠给予70 万U/kg 的VitD3灌胃两次后,给药组20只大鼠死亡9只,并出现不同程度的精神萎靡、进食量减少、毛发无光泽、口角有血迹、咖啡色尿、弥漫性肺出血及肠梗阻等急性中毒症状。由HE 染色结果可知,短期内给予过量VitD3后,大鼠心脏、肾脏、肺、血管中均出现不同程度的钙化灶,并出现肌纤维排列紊乱、变性、坏死及炎细胞浸润等病理改变。茜素红染色显示,对照组未见红色结节,给药组大鼠心脏、肾脏、肺、血管均可见较多红色结节,而肝脏中未见红色结节。因此,我们推测,软组织器官钙化的累积生理效应造成器官功能障碍引起了大鼠死亡。肝脏是VitD3的代谢器官,VitD3在肝脏中被25-羟化酶代谢,再由肾脏1α-羟化酶转化为其活性形式,与 VDR 在不同组织中发挥作用[15]。然而,本研究中HE 染色及茜素红染色均未观察到肝脏发生钙化,我们推测原因可能为肝脏对VitD3的代谢速率较快,具体原因有待进一步探索。
BMPs是TGF-β家族成员,与成骨分化和异位钙化密切相关[12]。BMPs与特异性受体结合后,通过调控下游靶基因转录,诱导机体发生异位钙化。BMP2作为BMPs 家族一员,与异位钙化关系最为密切。机体在一系列外界刺激下,诱导间充质前体细胞分泌BMP2,并激活BMP2 介导的信号通路调控前体细胞分化为成骨样细胞,并促进基质钙化[13]。研究表明,与正常动脉组织相比,BMP2 在动脉粥样硬化钙化斑块及纤维帽中表达增高[14]。本研究结果显示,与对照组相比,给药组大鼠心脏、肾脏、肺、血管中BMP2 mRNA 及蛋白表达水平均显著升高,表明过量VitD3给药可促进上述大鼠脏器钙化,与HE 染色及茜素红染色结果一致。
总之,本研究从VitD3急性中毒症状及器官钙化的角度阐述了VitD3的毒性作用。随着VitD3补充剂的使用增加,有必要注意VitD3的过量与中毒反应。当过量补充VitD3后出现食欲减退、头痛、恶心、呕吐、便秘等症状时,应立即检测血钙含量,预防毒性反应发生。
