HBx 转染的肝癌Huh7 细胞中差异表达mRNA、lncRNA筛选及其功能分析
2021-07-24曹永成张晶王翠翠辛萱曹瑞雪姜贝贝刘晓红
曹永成,张晶 ,王翠翠,辛萱,曹瑞雪,姜贝贝,刘晓红
1 中国人民解放军联勤保障部队第九六〇医院病理科,济南250031;2 山东省立第三医院病理科
乙型肝炎病毒(HBV)感染是肝细胞肝癌(HCC)发病的主要危险因素[1]。HBV 基因组含有4 个开放读码框,其中最小的X 基因编码含145~154 个氨基酸的HBV X(HBx)蛋白。现有研究证实,HBx 蛋白通过与各种细胞因子和生长因子相互作用、或通过调节许多细胞信号通路激活,间接触发病毒和细胞的启动子或增强子,从而加速肝癌的发展[2-6],但其具体分子机制尚不明确。长链非编码RNA(ln⁃cRNA)是长度大于200 nt 且不具有编码蛋白质功能的 RNA[7]。lncRNA 由于具有较长的核苷酸链,其复杂的二级空间结构含有多个蛋白质结合位点,或与DNA、RNA 特异性结合,形成复杂、精确的基因表达调控网络[8]。越来越多的证据表明,lncRNA 在细胞增殖、侵袭转移、自噬和凋亡等多种生物过程中发挥重要作用,也参与了包括HCC 在内的多种恶性肿瘤的进展[9-10],而 lncRNA 在 HBV 相关 HCC 发病中的作用及机制有待深入研究。本研究利用lncRNA 芯片观察HBx 相关HCC 肿瘤细胞中的mRNA 和lncRNA表达谱,筛选HBx 诱导的HCC 潜在的关键调控基因,并进行功能分析,为进一步研究HBx 作用的分子机制奠定基础。
1 材料与方法
1.1 主要实验材料 肝癌细胞Huh7购自中国科学院细胞库。真核表达载体pcDNA3.1和脂质体Lipo⁃fectamine2000 转染试剂盒购自美国Invitrogen 公司。鼠抗HBx单克隆抗体(57760)、辣根过氧化酶(HRP)标记的鼠抗兔IgG 二抗、ECL 化学发光检测试剂盒购自美国Santa Cruz公司。十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶配制试剂盒购自上海碧云天公司。G418 培养基、胎牛血清、DMEM 培养基购自美国Gibco BRL 公司。聚偏二氟乙烯(PVDF)膜购自美国Bio-Rad 公司。lncRNA Array3.0(8×60 K)芯片购自美国Arraystar 公司。TRIzol 试剂、SuperScriptⅢ逆转录酶购自美国Invitrogen公司。
1.2 HBx 转染Huh7 细胞 从NCBI 数据库下载野生型HBx 基因(HBx-FJ)的CDS 区序列,采用重叠延伸聚合酶链反应(OE-PCR)分段扩增,以第一轮PCR产物作为模板,拼接为全长基因,PCR产物进行琼脂糖凝胶电泳,目的条带预期大小为465 bp。将全长HBx 和pcDNA3.1 扩增产物分别用限制性内切酶HindⅢ和EcoRⅠ进行酶切,T4 DNA ligase 连接酶切后的PCR 产物及载体pcDNA3.1,将10 μL连接产物转化至DH5α 感受态细胞,涂布于含氨苄青霉素抗性的LB 平皿,37 ℃培养过夜至克隆长出。次日进行菌落PCR,将阳性克隆抽提质粒。Huh7细胞培养于含10%胎牛血清的DMEM 培养基中,转染前1 d将细胞以3×105/孔的密度接种于6 孔板,将细胞随机分为 HBx-FJ 组和 pcDNA3.1 组,分别转染 4 μg 的pcDNA3.1-HBx-FJ 或 pcDNA3.1。G418 筛选稳定转染细胞。Western blotting法在HBx-FJ组细胞检测到阳性条带,而在pcDNA3.1 组未检测到阳性条带。标准变性琼脂糖凝胶电泳检测各组稳转细胞总RNA的完整性符合芯片杂交要求。
1.3 HBx-FJ 组和 pcDNA3.1 组差异表达 mRNA、lncRNA 筛选 lncRNA Array3.0(8×60 K)芯片包括来自Refseq、UCSC knowngenes、Gencode 等权威数据库和高影响因子论文中的lncRNA,可以检测人类30 586个lncRNA 和26 109个mRNA 的转录本,芯片上也包括阳性探针(管家基因)和阴性探针。根据制造商的标准协议进行样本制备和芯片杂交。使用Agilent DNA 微阵列扫描仪扫描芯片,Agilent Fea⁃ture Extraction 软件提取数据,Agilent Gene Spring GX11.5.1 软件进行归一化和数据分析,通过t检验筛选差异表达的mRNA 和lncRNA,筛选标准为折叠倍率(FC)≥2.0、两组差异有统计学意义(P<0.05)、错误发现率(FDR)<0.05。
1.4 HBx-FJ 组和 pcDNA3.1 组差异表达 mRNA 功能分析 绘制散点图对数据进行质量评估,直观反映差异表达mRNAs 和lncRNAs 的分布情况。对差异表达mRNAs 和lncRNAs 进行分层聚类分析,以使这些差异基因能够进行适当分类,分在同一簇的基因具有相似的生物学性质。以全部差异表达的mRNA 为目标基因,以KEGG 通路数据库中全部基因为参照基因,利用可视化整合注释数据库将目标基因与KEGG Pathway 数据库关联,利用χ2检验比较目标基因中与某一条通路相关基因所占比例和参照基因中与该通路相关基因的比例,若P<0.05,该通路即为目标基因中富集的通路。将目标基因放入GO 数据库进行分析,对其功能进行注释。以GO 数据库中全部基因为参照基因,利用χ2检验比较目标基因中与某一条GO 术语相关基因所占比例和参照基因中与该术语相关基因的比例,若P<0.05,该术语即为目标基因中富集的GO术语。
1.5 HBx 转染的Huh7 细胞中差异表达mRNA、lncRNA的RT-qPCR检测验证 对lncRNA芯片检测结果进行交集分析,寻找差异表达的mRNA 及可能参与调控的同时差异表达的lncRNA,变化趋势符合相互作用的mRNA及lncRNA序列。根据既往文献,选择 6 个关键 mRNA 在 HBx 转染的 Huh7 细胞中进行验证。样本总RNA 提取、cDNA 合成和PCR 反应根据说明书进行。以2−ΔΔCt表示目的基因相对表达量。实验重复3次。
1.6 统计学方法 采用SPSS17.0 统计软件。计量资料以表示,两组比较采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 HBx-FJ 组和pcDNA3.1 组差异表达mRNA、lncRNA 筛选结果 与 pcDNA3.1 组相比,HBx-FJ 组表达上调mRNA 253 个,表达下调mRNA 321 个;表达上调lncRNA 1 108个,表达下调lncRNA 1 182个。变化倍数最大的前5 个差异表达mRNA 和lncRNA见表1、表2。

表1 HBx-FJ组和pcDNA3.1组差异表达变化倍数最大的前5个mRNA
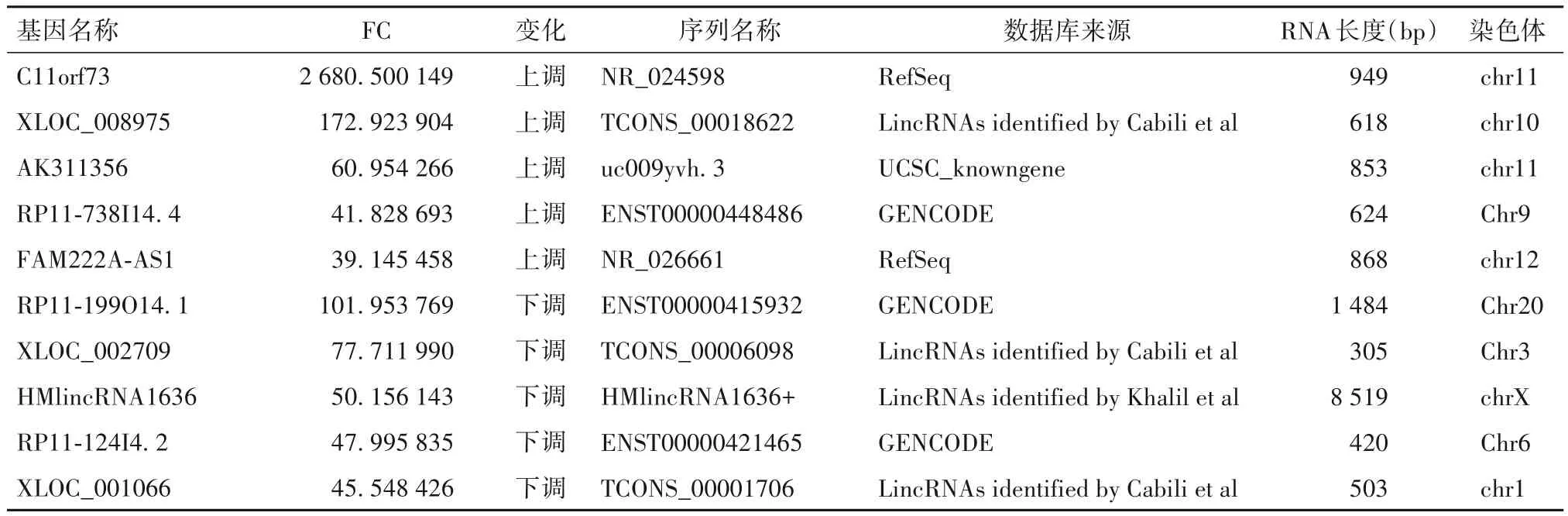
表2 HBx-FJ组和pcDNA3.1组差异表达变化倍数最大的前5个lncRNA
2.2 HBx-FJ 组和 pcDNA3.1 组差异表达 mRNA 功能分析结果 散点图及分层聚类分析结果显示,HBx-FJ 组细胞存在显著差异表达的mRNA 和lncRNA。差异表达的基因能将pcDNA3.1 组和HBx-FJ 组正确分类。HBx-FJ 组和 pcDNA3.1 组差异表达mRNA的功能主要参与离子通道、跨膜转运、抗体的处理和呈递及蛋白加工的调节等方面。见OSID 码图 1。HBx-FJ 组表达上调的 mRNA 参与的通路有10 条,表达下调的mRNA 参与的通路有24条。差异表达mRNA主要参与转录失调、信号转导、钙信号通路等途径。见OSID码图2。
2.3 差异表达mRNA的RT-qPCR检测结果 HBx转染的 Huh7 细胞中,6 个差异表达 mRNA(ASAP3、CFTR、POSTN、CAMTA1、ESRRG、ROBO1)的RT-qPCR检测结果与芯片检测结果变化趋势基本一致,但表达水平变化较大。见表3。

表3 差异表达mRNA的RT-qPCR验证结果
3 讨论
2018年全球新增原发性肝癌患者84.1万例,死亡78.1 万例,分居全球恶性肿瘤发病和死亡的第6位和第4 位[11]。肝癌患者即便手术切除肿瘤,多数患者治疗后还会复发[12],且肝癌对化疗不太敏感,预后很差[13]。由于单用化疗或单用生物靶向药物治疗中晚期肝癌疗效不满意,化疗联合生物靶向药物治疗已成为当前研究的热点,但是目前有效的分子靶向药物极少。虽然公认HBV 感染是HCC 发病的主要危险因素,HBx蛋白可以加速肝癌的发展,但其致病的分子生物学机制至今不清楚。因此有必要深入研究HBx 在HCC 发病中的调控机制,寻找核心调控基因及更多有效的分子靶点。
恶性肿瘤是通过不断选择对肿瘤细胞有利的遗传变化并逐渐积累而发生、演变的,恶性肿瘤相关的基因功能变化通常由DNA 序列的改变(染色体易位、缺失、点突变、插入等)引起,而mRNA 作为DNA与蛋白之间遗传信息传递的信使,对其功能的探索一直是生物医学领域的研究热点。
随着大规模测序技术的发展和高通量芯片的应用,越来越多的RNA 分子被发现,有大量的基因组DNA 转录成lncRNA,参与调节正常生理过程(如发育、细胞周期调控)和恶性肿瘤的发生发展进程[14-16]。lncRNA 可通过多种分子调控机制,调控DNA 甲基化、组蛋白修饰或染色体重构,参与X 染色体沉默、转录激活、转录干扰及核内运输等重要生物过程[17]。现有研究发现,一些lncRNA 经常在与HBV 感染相关的HCC 中特异表达,如MALAT1、UCA1、unigene56159 等,功能研究显示,这些 ln⁃cRNA 可以促进 HBV 相关 HCC 的发病和进展[18-20]。而HBx 可以通过调节多种lncRNA 的表达促进HBV相关HCC的发生[21]。因此,深入研究HBx调控的ln⁃cRNA 表达异常对于阐明HBV 相关HCC 发病机制具有重要意义。
lncRNA 芯片技术是目前用于筛选肿瘤相关lncRNA 和mRNA 的有效方法,可以快速、高效地获得肿瘤相关特异lncRNA和mRNA表达谱数据,这些差异表达基因可能是某种肿瘤的特征分子标志,并可能成为肿瘤的诊断和治疗靶点。本研究采用lncRNA 芯片检测野生型HBx转染肝癌Huh7细胞后的mRNA 和lncRNA 表达谱,与转染空载体的Huh7细胞进行比较,结果发现,差异表达的mRNA 和lncRNA 无论是种类还是数量都较多,有些明显表达上调,而有些明显表达下调,散点图及分层聚类分析结果也证实,HBx-FJ 组的Huh7 细胞存在大量明显差异表达的mRNA 和lncRNA,提示这些mRNA 和lncRNA 可能参与了HCC 发病的分子调控过程,并且发挥了不同甚至相反的调控功能。我们将筛选出的差异表达mRNA 进行GO 分析,对HBx 调控HCC发生发展过程中可能的生物学过程进行探索,结果显示,差异表达mRNA 主要涉及离子通道和信号传递过程,以及抗原加工和蛋白加工调节过程,这提示离子通道功能的损伤和免疫功能的改变可能是HBx调控HCC 发生的重要因素。通过对差异表达 mRNA 进行 KEGG 通路分析,可以对 HBx 调控HCC 过程中可能涉及的信号转导通路进行预测,结果显示,富集程度较高的有转录调控、糖代谢、钙信号转导等信号通路。根据GO 及KEGG 通路分析结果,并查阅文献,我们筛选出了6 个关键基因ASAP3、CFTR、POSTN、CAMTA1、ESRRG、ROBO1,它们可能参与HBx 对HCC 的调控并发挥重要作用。采用RT-qPCR 法检测HBx 转染的Huh7 细胞中的6个关键基因,结果显示,细胞层面的验证结果与芯片检测结果的变化趋势基本一致,证实了芯片结果的可靠性,但是差异mRNA的表达水平变化较大,可能是因为在细胞中的调控因素更加复杂。此外,我们同时进行的另一项lncRNA 芯片检测筛选出了差异表达基因PDK2,也已通过体外实验在细胞层面进行了验证,与芯片结果一致[22],下一步我们将在人体组织样本中进行蛋白水平及RNA水平的验证。
总之,本研究采用lncRNA芯片技术分析HBx调控HCC 发展过程中的相关mRNA 及lncRNA 表达情况,筛选HCC 相关的差异表达基因,为深入探索HBx 调控HCC 的分子机制提供了研究方向,并提出合理策略。
