腮腺睾丸核蛋白癌1例病例报告
2021-07-15黄金云任国欣
黄金云, 任国欣, 钟 薏
(1.潍坊医学院口腔医学院,山东 潍坊 261053;2.上海交通大学医学院附属第九人民医院口腔颌面头颈肿瘤科,上海 200011;3.上海市中西医结合医院中医肿瘤科,上海 200082)
睾丸核蛋白(NUT)癌最早由Kees等[1]于1991年发现并报道,病例描述为纵隔/胸腺肿瘤。该肿瘤是15号染色体上的NUT基因发生重排的恶性肿瘤,多见于喉部、鼻腔、纵隔等中线部位,也可见于肝、胰腺、膀胱等器官[2]。其最常见的染色体易位是t(15;19),因此,又称NUT中线癌、t(15;19)癌[3]。2017年第4版世界卫生组织(WHO)头颈部肿瘤的分类中首次将具有鳞状分化特点的低分化癌——NUT癌列入鼻窦实体肿瘤[4]。本文报告1例右腮腺NUT癌,并查阅相关文献,总结并探讨其临床病理特征、诊断、治疗及鉴别诊断,以提高对该肿瘤的认识。
1 临床资料
1.1 基本资料
患者男性,36岁,既往身体健康,无吸烟史。2020年6月11日因“右腮腺癌术后半月余”于上海交通大学医学院附属第九人民医院就诊,患者正面像及侧面像见图1A、1B。患者主诉发现右腮腺肿物3年余,2020年4月初自觉肿物逐渐增大。腮腺MRI增强示:右侧腮腺多发占位,考虑腺淋巴瘤(Warthin瘤)可能;腮腺CT增强示:右侧腮腺多发结节,考虑腮腺淋巴结结核可能。体格检查右腮腺区可触及约3 cm×2 cm大小肿物,质硬,界尚清,活动度稍差,无触痛。2020年5月19日于外院全麻下行“右腮腺肿物切除术+右腮腺部分切除术(浅叶切除)”。术后病理示:右腮腺未分化癌,考虑①癌在多形性腺瘤中;②黏液表皮样癌;③淋巴上皮癌。上海交通大学医学院附属第九人民医院病理会诊结果示:NUT癌。患者面部多发皮疹,右腮腺区呈术后改变,愈合良好,无明显红肿渗出,稍麻木感,伴右侧皱眉障碍、右眼闭合不全、口角歪斜等面瘫症状。
1.2 影像学表现
2020年4月23日腮腺MRI增强示(图1C):右侧腮腺见多发结节及斑点异常影,大者约2.6 cm×1.2 cm,位于咬肌外缘,呈长圆形,压迫周围组织,T1WI呈等低信号,T2WI压脂呈高信号,增强后结节明显强化,弥散加权成像 (diffusion weighted imaging,DWI)弥散受限,较大病灶内见斑点及片状未强化影,界限清楚;两侧颈部颈动脉鞘旁见轻度增大淋巴结,大小约0.6 cm;两侧胸锁乳突肌对称,未见明显异常信号影;右侧腮腺多发占位,考虑腺淋巴瘤(Warthin瘤)可能,需结合临床。2020年4月24日腮腺CT增强示:右侧腮腺见多发大小不一结节影,位于腮腺浅叶,大者约2.5 cm×1.3 cm,增强后结节不均匀强化,较大病灶见低密度坏死影;右侧颈动脉鞘旁见小淋巴影,右侧腮腺多发结节,考虑腮腺淋巴结结核可能,需结合临床。
2020年6月12日正电子发射计算机体层成像-CT(PET-CT)示(图1D):①右腮腺术后,术区不均匀稍低密度影伴氟代脱氧葡萄糖(FDG)轻度摄取,考虑术后改变,右腮腺深部软组织增厚影伴局灶FDG摄取增高灶,考虑恶性肿瘤可能,直径约1.5 cm,考虑右腮腺术后局灶有残留;②直肠后方盆底筋膜增厚伴FDG摄取增高,考虑炎性可能性大,部分胃窦慢性炎症可能,需结合胃镜随访;③两肺上叶慢性炎性结节,需CT随访;④未见远处转移。

图1 临床及影像学表现Figure 1 The clinical and imaging findings
1.3 病理学表现
镜下苏木精-伊红(HE)染色可见肿瘤细胞呈巢团状分布(图2A);间质内淋巴细胞条索状浸润,类似淋巴上皮瘤样癌的结构(图2B);肿瘤细胞形状不规则,细胞质呈淡嗜伊红色,细胞核较大,核型多不规则,部分见核仁,偶见核分裂象(图2C)。免疫组织化学EnVision结果(图2D~2G):NUT(+),AE1/AE3(部分+),EMA为部分(+),p63为局灶(+),CK7、CK9、MUC-1少量表达,F1i-1个别(+),CD56、Syn(-)。分子检测结果:NUT分离探针FISH检测结果(+)(图2H),MAML2分离探针FISH检测结果(-),EBER CISH(-)。
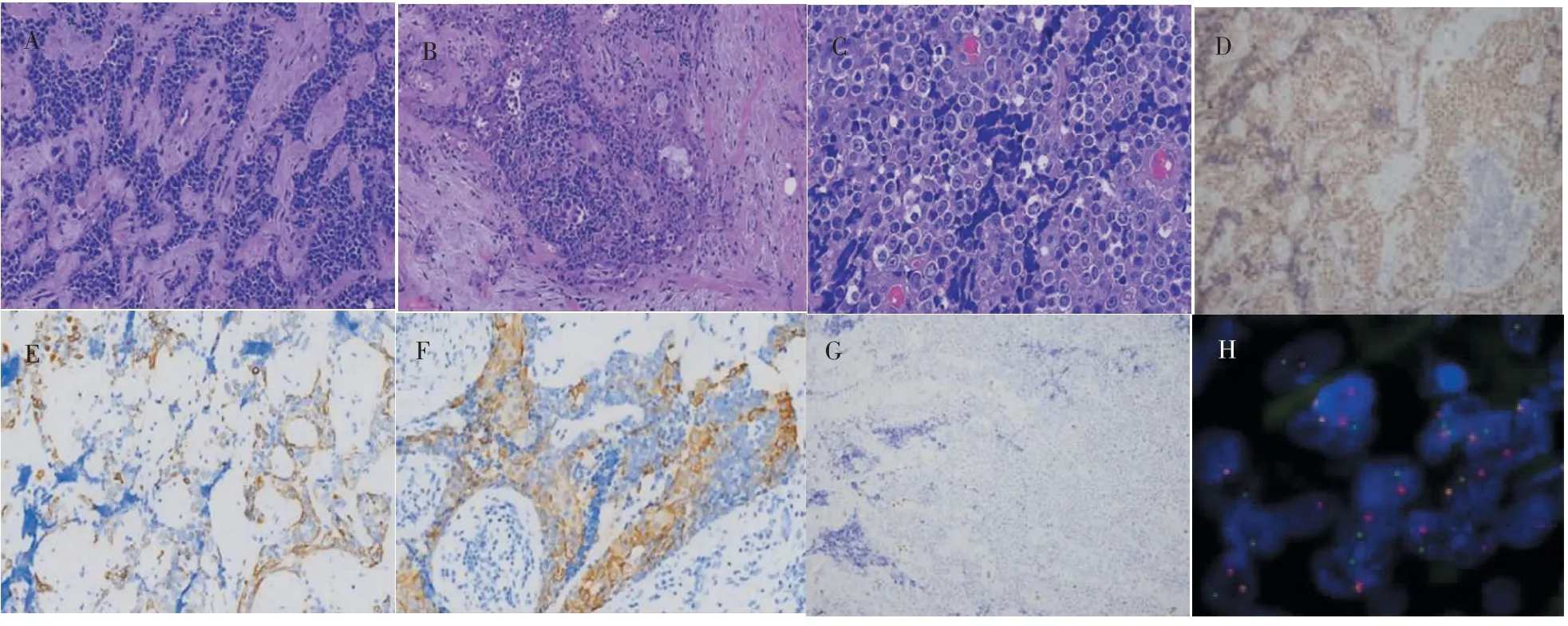
图2 NUT癌组织病理学表现Figure 2 Histopathology of NUT carcinoma
1.4 治疗
患者2020年6月29日于仁济医院行术后辅助放疗,同步行TP方案化疗(白蛋白结合型紫杉醇100 mg+顺铂40 mg,第1天静脉滴注,每周1次)联合西妥昔单抗靶向治疗,靶向治疗过程中患者全身出现Ⅰ~Ⅱ级皮疹,鼻部皮肤尤为明显,给予米诺环素口服,百多邦外用对症处理,暂停靶向治疗。2020年7月17日、24日分别行第3、4疗程TP方案化疗(白蛋白结合型紫杉醇100 mg+顺铂40 mg,第1天静脉滴注,每周1次),化疗过程顺利。目前该患者正处于随访观察中。
2 讨论
2.1 临床特点
NUT癌极度罕见且具有高度侵袭性,发病率尚不清楚,回顾国内外文献报道,头颈部NUT癌仅300余例[5-7]。目前为止,仅有10例腮腺NUT癌的病例报道[8]。文献显示,唾液腺NUT癌患者男女比例为1.5∶1,年龄为12~55岁(中位年龄29岁),该肿瘤可以发生于任何年龄,但多见于儿童及年轻人[9-12]。尽管最初认为NUT癌是与中线结构相关的恶性肿瘤,但最近有该罕见病发生在单侧性器官的报道,如肺[13]和腮腺[14]。因此,WHO将NUT中线癌改名为NUT癌[15-16]。大约39%的NUT癌发生在头颈部,鼻腔鼻窦区是该肿瘤最常见的发生部位,其次是鼻咽部、口咽部、下咽、喉部和其他未知区域[17]。NUT癌临床通常表现为迅速增大的肿块,以早期局部淋巴结转移或远处转移为特征[18]。因此,多数患者表现为鼻漏、鼻塞、视力下降、吞咽困难或疼痛等,少数出现发热和体重减轻[19]。该病病因不明,没有证据表明其与吸烟或其他环境因素相关,迄今为止也尚未发现该病与EB病毒或人乳头瘤病毒相关的病例。
2.2 组织学特点
镜下,低分化或未分化的NUT癌细胞呈片状分布,少数病例纤维间质内可见瘤细胞,呈巢状排列。间质淋巴细胞灶性浸润,类似淋巴上皮瘤样癌的结构。瘤细胞为未分化状,黏附性差,细胞小到中等大小,胞质呈嗜酸性,核质比高,核异型明显,囊状染色质,核仁明显,坏死灶可见,核分裂象多见[20]。少数细胞团有明显的鳞状分化,与未分化细胞之间无过渡形态,这种突然的鳞状分化是该肿瘤的特征性表现[21]。中央可有角化物形成,有时会出现类似胸腺小体的结构。组织学特点并无特异性,细胞组成较单一。因此,仅根据形态学很难诊断为NUT癌。
2.3 免疫组织化学特点
免疫组织化学NUT阳性是该肿瘤的特征。Haack等[22]使用NUT特异性单克隆抗体诊断法,其特异度为100%,敏感度为87%。NUT抗体阳性(≥50%)或FISH等检查确定NUT基因易位,可诊断为NUT癌。当NUT抗体阳性或形态学可疑时,可应用FISH或实时聚合酶链反应 (real-time polymerase chain reaction,RT-PCR)协助诊断[6]。该肿瘤中AE1/AE3、p63、波形蛋白(vimentin)、CD34、CD56和Syn的阳性率分别为80%、81%、50%、30%、29%和17%[23]。对于表达量较高的细胞可进行免疫组织化学检测以辅助诊断。
2.4 遗传学特点
NUT癌的特点是染色体15q14上的NUT基因(又名NUTM1基因)可与多个基因易位融合,最常见的是t(15;19)(q14;p13.1),形成BRD4-NUT基因,占70%;其次是t(15;9)(q14;p34)易位,形成BRD3-NUT基因,占6%[2];其余为少见或未知的易位融合[24-25]。生物学上肿瘤是被NUT融合基因的过度表达所驱动,阻止细胞的分化,并维持肿瘤生长[26]。本例中,FISH检测结果示,NUT分离探针阳性(+),结合免疫组织化学结果可诊断为NUT癌。
2.5 鉴别诊断
NUT癌组织学特点无特异性,需与未分化或低分化鳞状细胞癌、淋巴上皮瘤样癌、黏液表皮样癌、多形性腺瘤等相鉴别。①与未分化癌或低分化鳞状细胞癌的鉴别:未分化癌或低分化鳞状细胞癌与NUT癌相似,均具有高度侵袭性,预后均较差,与NUT癌镜下形态也相似,但其免疫组织化学NUT抗体呈阴性[27]。②与淋巴上皮瘤样癌的鉴别:上皮瘤样癌与NUT癌一样,也表达鳞状细胞的标志物,但形态无鳞状分化,组织学特征主要由低分化或未分化的癌细胞和丰富的淋巴细胞间质组成,常伴有EB病毒感染,NUT抗体呈阴性。③与黏液表皮样癌的鉴别:黏液表皮样癌的组成细胞有黏液细胞、中间细胞、表皮样细胞、透明细胞等,其中最重要的是黏液细胞。肿瘤性黏液细胞相对较大,含丰富淡染呈泡沫样的细胞质,呈圆或卵圆形、立方或柱状。泡沫样的黏液细胞成团聚集或构成囊腔的腔面细胞,用阿辛蓝或过碘酸希夫(periodic acid Schiff,PAS)染色呈阳性可诊断为黏液表皮样癌,NUT抗体呈阴性。④与多形性腺瘤的鉴别:多形性腺瘤多发生于腮腺中,常有面瘫症状。构成多形性腺瘤的主要成分为腺上皮细胞、肌上皮细胞、黏液、黏液样组织及软骨样组织,有时可见鳞状化生。多形性腺瘤免疫组织化学染色中细胞角蛋白、S-100蛋白、胶质纤维酸性蛋白(GFAP)、肌动蛋白(actin)、波形蛋白(vimentin)、上皮膜蛋白(EMA)、癌胚抗原(CEA)等均呈阳性反应,NUT抗体呈阴性。
2.6 治疗与预后
NUT癌的发病人群多为年轻人,且疾病进展迅速,恶性侵袭程度高,中位生存期为6~7个月,80%的患者在明确诊断后1年内死亡[28]。尽管头颈部NUT癌的标准治疗方法尚未建立,但临床上已采用全身化疗、手术和放疗的多模式治疗方式。手术通常被认为是与改善预后相关的主要选择,与放疗或化疗相比,完全手术切除可显著提高生存率,但仍不能保证好的疗效,大多数患者术后仍需行放疗或化疗[29]。特别是顺铂、紫杉烷和烷基化剂的应用,取得了一定的成效[19,30-31]。本例患者在全身麻醉下行右腮腺浅叶(2 cm×3 cm)切除术;术后PET-CT示,右腮腺深部软组织增厚影伴局灶FDG摄取增高灶,考虑恶性肿瘤可能大,肿瘤直径约1.5 cm,考虑右腮腺肿瘤术后局灶残留,遂行术后放、化疗的联合治疗。研究表明,有学者针对NUT-BRD4融合基因发现了2种靶向制剂:组蛋白脱乙酰酶抑制剂(histone deacetylase inhibitor,HDACi)和BET抑制剂(BET inhibitor,BETi),尽管这2种靶向制剂初有疗效,但所有接受HDACi或BETi治疗的头颈部NUT癌患者在治疗期间均出现耐药性和复发的情况[8]。最近发现的非致瘤驱动因子CDK9可能为NUT癌患者的药物靶点,CDK9抑制剂(Alvocidib)正在一期临床试验中[32]。许多临床前期研究表明,BETi与免疫检查点调节剂有协同作用,可以调节免疫检查点配体PD-L1的表达,并与抗肿瘤细胞毒性T细胞的增加相关[33]。
综上所述,NUT癌是一种极为罕见(尤其是发生于腮腺的NUT癌)、发病原因不明、高侵袭性、极易复发和远处转移、治疗手段有限、预后极差的恶性肿瘤,针对该病的发病部位、组织学形态、细胞起源、分子遗传学改变、致病机制、治疗及预后等,都需行进一步探索[34]。目前靶向制剂HDACi、BETi和CDK9等药物都处于临床试验中,BETi联合PD-L1等药物可能成为一种新的治疗手段,期望多学科综合治疗未来能使更多的NUT癌患者获益。
