过表达Sirt6促进脂多糖诱导大鼠骨髓间充质干细胞骨生成
2021-07-15荆得宝于素平刘雪阳
王 开, 荆得宝, 于素平, 刘雪阳
(海军军医大学附属公利医院口腔科,上海 200135)
炎性衰老的典型表现是牙槽骨丧失导致的牙齿脱落和面型改变。因此,抑制口腔牙周炎症,促使口腔颌骨再生,维持牙齿稳定,成为我们面临的问题。骨髓间充质干细胞(BMSCs)是一种异质的基质细胞群,具有自我更新及多向分化的潜能,能生成分化为多种其他细胞系,是现代组织工程研究、基因治疗和细胞免疫替代治疗中的种子细胞,尤其在维持骨吸收和骨形成的骨稳态中具有极其重要的作用[1-2]。
沉默信息调控因子6(Sirt6)是一种依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的脱乙酰化酶,具有腺二磷酸(adenosine diphosphate,ADP)核糖基转移酶活性,可保护机体免受衰老和疾病的侵袭。此外,Sirt6通过减少活性氧类(reactive oxygen species,ROS)的产生和蛋白激酶B(protein kinase B,PKB)的磷酸化,抑制了肿瘤坏死因子-α(TNF-α)诱导的血管外膜成纤维细胞的炎症[3]。过表达Sirt6可通过诱导椎间盘退变(intervertebral disc degeneration,IDD)模型中NP细胞的自噬来抑制NP细胞的衰老和凋亡[4]。本研究采用脂多糖(LPS,10 μg/mL)来诱导大鼠BMSCs的炎症反应,检测Sirt6在炎症大鼠BMSCs中的骨生成作用,为进一步加深对Sirt6生物学功能的理解,也为研究Sirt6在BMSCs成骨分化中的作用提供新见解。
1 材料和方法
1.1 实验动物
3~4周龄SD大鼠2只,体质量为250~300 g/只,雌雄不限,由同济大学实验动物中心提供。
1.2 实验试剂及仪器
DMEM培养液(Gibco公司,美国);胎牛血清(杭州四季青公司,中国);L-抗坏血酸400 μL、β甘油磷酸钠2 mL、地塞米松20 μL、ELISA检测试剂盒(Sigma公司,美国);TRIzol试剂盒(Invitrogen公司,美国);Sirt6抗体(1∶2 000)、OCN抗体(1∶2 000)、ALP抗体(1∶1 000)、BSP抗体(1∶2 000)(Abcam公司,英国);GAPDH(1∶2 000)(CST公司,美国);山羊抗兔IgG(Beyotime公司,中国);低温冷冻离心机(卢湘仪离心机仪器有限公司,中国);酶标仪(BMG LABTECH公司,德国);Nano Drop2000分光光度计(Thermo公司,美国);倒置相差显微镜(Olympus公司,日本);RT-qPCR荧光定量仪(ABI公司,美国)。
1.3 实验方法
1.3.1 SD大鼠BMSCs体外分离培养与鉴定将SD大鼠处死后,用75%乙醇消毒浸泡,取出其股骨及胫骨,去除周围肌肉组织,随后将其浸泡于适量培养液中。用5 mL注射器吸取一端干垢端,将骨髓中的细胞吸取后冲至培养皿中,反复几次,收集此细胞悬液,用200目滤网过滤去除杂质后,将细胞悬液收集至离心管中,800 r/min离心5 min,弃去上清液,加入适量DMEM培养液混匀后,将其接种于培养瓶中培养,置37℃、5%CO2饱和湿度孵育箱中培养48~72 h后更换培养液,每3天更换1次培养液。待细胞长满瓶底70%~80%时,用0.25%胰酶消化后,1∶2传代培养,待鉴定后,取P3代细胞用于后续实验[5-6]。
1.3.2 ELISA检测炎性因子TNF-α、白细胞介素-1β(IL-1β)、IL-6的表达用10 μg/mL的LPS刺激BMSCs,参照试剂盒说明书,使用ELISA试剂盒检测不同时间点(12、24、48、72 h)的对照组及LPS诱导组培养液中炎性因子TNF-α、IL-1β、IL-6的表达,酶标仪波长为450 nm,读取吸光度值,并绘制标准曲线。
1.3.3 过表达Sirt6质粒构建及转染根据实验需求,构建过表达载体,选用质粒pcDNA3.1(+),利用NCBI数据库查找目的基因的mRNA序列,针对蛋白质编码区域(coding sequence,CDS)选用载体设计引物及酶切位点。Sirt6(NM_001031649.1)基因CDS区域全长993 bp,根据载体信息选择酶切位点为上游HindⅢ、下游EcoRⅠ,合成含有酶切位点的目的基因CDS区域序列。引物序列如下,下划线为酶切位点。Sirt6-F:5′-CCCAAGCTTATGTCGGTGAATTATGCAGCAG-3′(HindⅢ);Sirt6-R:5′-CGGAATTCTCAGCTGGCGGCAGCC-3′(EcoRⅠ)。
根据质粒提取试剂盒说明书进行质粒提取,并进行质粒DNA测序比对。将Sirt6过表达质粒(约1.5 μg)溶于245 μL Opti-mem无血清培养液中,此为A液,而后将5 μL lipo2000溶于245 μL Optimem无血清培养液中,此为B液,混匀后室温下静置5 min。然后将A液与B液混合,室温静置20 min。弃去原培养液,用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗1次,再加入2 mL不含血清的培养液。把复合物缓缓加入对应培养液中,摇匀,置37℃培养箱6 h,吸除无血清转染液,放入完全培养液继续培养,转染48 h后进行后续实验。
1.3.4 RT-qPCR检测Sirt6 mRNA的表达实验分为LPS组、LPS+空载体组及LPS+过表达Sirt6组。用TRIzol试剂盒分别从各组细胞中提取总RNA,用cDNA合成试剂盒转化为互补DNA(cDNA)。使用SYBR Green Master Mix的实时检测分析。引物序列如下。Sirt6上游引物:5′-AGGGTTGTCGCCATACGC-3′;下 游 引 物:5′-GGAGGACTGCCACATCAGC-3′。GAPDH上 游 引 物:5′-GGAGTCTACTGGCGTCTTCAC-3′;下游引物:5′-ATGAGCCCTTCCACGATGC-3′。反应条件为95℃预变性60 s;95℃30 s,54℃45 s,72℃60 s,共30个循环;72℃延伸10 min。检测Sirt6的扩增效率,实验重复3次取均值。采用2-ΔΔCt法计算mRNA的相对表达量。
1.3.5 Western blot技术检测BMSCs细胞中Sirt6、OCN、ALP、BSP蛋白的表达用RIPA裂解缓冲液分别提取各组总蛋白。在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)中将蛋白质分级,然后转移到聚偏氟乙烯(PVDF)膜上,放入5%牛血清白蛋白置室温封闭过夜。然后,用一抗和适量的辣根过氧化物酶(horseradish peroxidase,HRP)偶联的山羊抗兔IgG对膜进行探测。TBST缓冲液洗膜3次,每次10 min,使用化学发光系统检测蛋白质信号。GAPDH作为内源性参照。逐项分析各组Sirt6、OCN、ALP、BSP蛋白的表达。
1.3.6 茜素红染色法检测BMSCs矿化情况将各组细胞以1×105个/mL的密度接种于含有成骨诱导培养液的6孔培养板中。该培养液是根据先前研究中的方法制备的,每2天更换1次。诱导21 d后,用4%甲醛固定细胞0.5 h,用茜素红(0.1%,pH 8.3)染色3~5 min。然后,用XDS-600C型显微镜(上海蔡孔光学仪器有限公司,中国)观察各组矿化骨细胞钙结节,放大倍数为200倍。
1.4 数据分析
实验数据采用GraphPad Prism 6软件分析,计量资料用均数±标准差(±s)表示。完全随机设计的两均数比较采用Student-t检验,多组间的均数比较采用单因素方差分析(ANOVA)检验。结果以P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs的形态学观察
镜下可见聚集的不规则多角形伸长细胞,为BMSCs,继续培养至细胞长满瓶底70%~80%时,贴壁的BMSCs细胞典型,呈梭形、网状,聚集铺开生长。详见图1。

图1 倒置显微镜观察BMSCs的形态特点(×100)Figure 1 Morphological characteristics of BMSCs by reverse microscopy(×100)
2.2 ELISA检 测 炎 性 因 子TNF-α、IL-1β、IL-6的表达
与对照组相比,同一时间点的LPS诱导组中TNF-α、IL-1β、IL-6的含量均呈现高表达,并且TNF-α的含量明显高于IL-1β、IL-6,差异具有统计学意义(P<0.05);随着时间的延长,TNF-α的含量未见明显下降,而IL-1β、IL-6的表达量呈现下降趋势。详见图2。
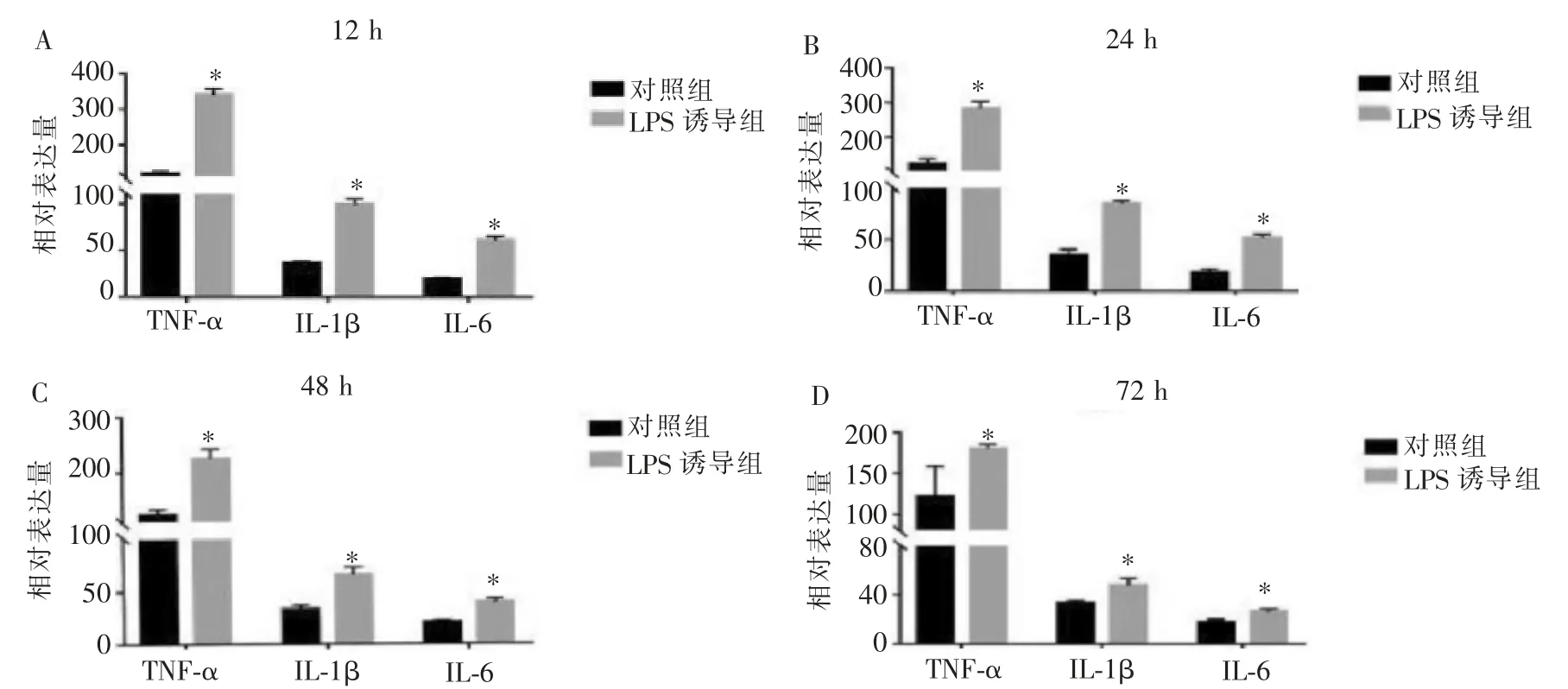
图2 TNF-α、IL-1β、IL-6在不同时间点的表达量对比Figure 2 Expression comparison of TNF-α,IL-1β and IL-6 at different time point
2.3 过表达Sirt6重组真核载体测序结果
通过测序比对,Sirt6无错配、缺失及反向链接。该结果表明过表达Sirt6重组真核载体构建成功,可以用于后续实验。
2.4 RT-qPCR检测Sirt6的mRNA 水平
与LPS组和LPS+空载体组相比较,LPS+过表达Sirt6组中Sirt6的mRNA水平显著升高(P<0.05),差异具有统计学意义(图3)。
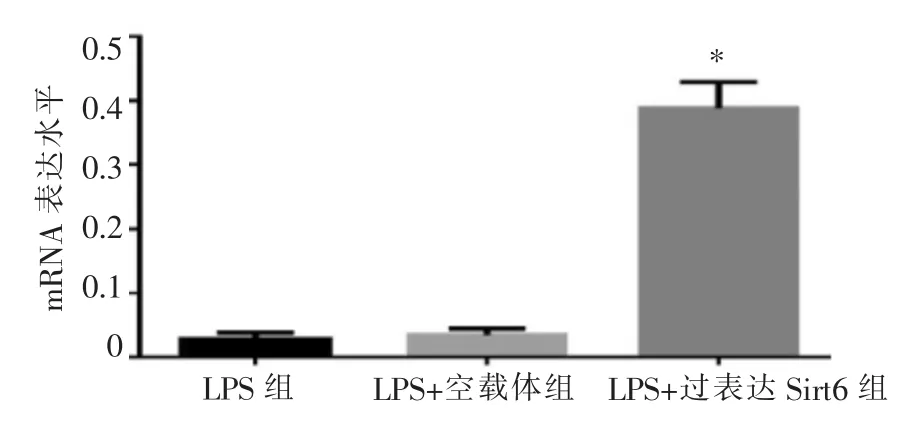
图3 RT-qPCR检测不同组Sirt6的mRNA表达水平Figure 3 mRNA expression of Sirt6 in different groups by RTqPCR
2.5 Western blot检测BMSCs中Sirt6、OCN、ALP、BSP蛋白的表达
与LPS组相比较,LPS+空载体组中Sirt6、OCN、ALP、BSP蛋白的表达量未见明显加强(P>0.05),而LPS+过表达Sirt6组中,Sirt6、OCN、ALP、BSP蛋白水平表达量均呈现显著加强(P<0.05)。详见图4。
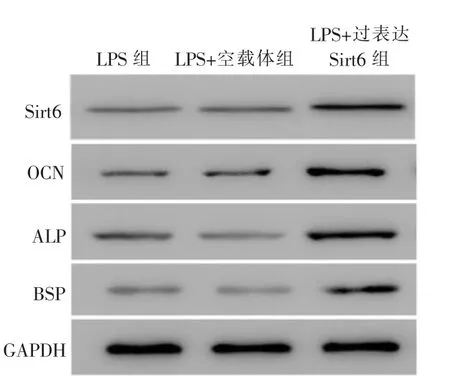
图4 不同组BMSCs中Sirt6、OCN、ALP、BSP的蛋白表达Figure 4 Protein expression of Sirt6,OCN,ALP and BSP in different groups of BMSCs
2.6 茜素红染色法检测不同组中BMSCs的骨化钙结节生成情况
成骨诱导21 d后,LPS组镜下未见明显的钙结节形成,LPS+空载体组可见极少量的钙结节区域,而LPS+过表达Sirt6组镜下可见大量斑块状的红色钙结节形成,说明过表达Sirt6可以抑制炎症反应,促进骨生成。详见图5。
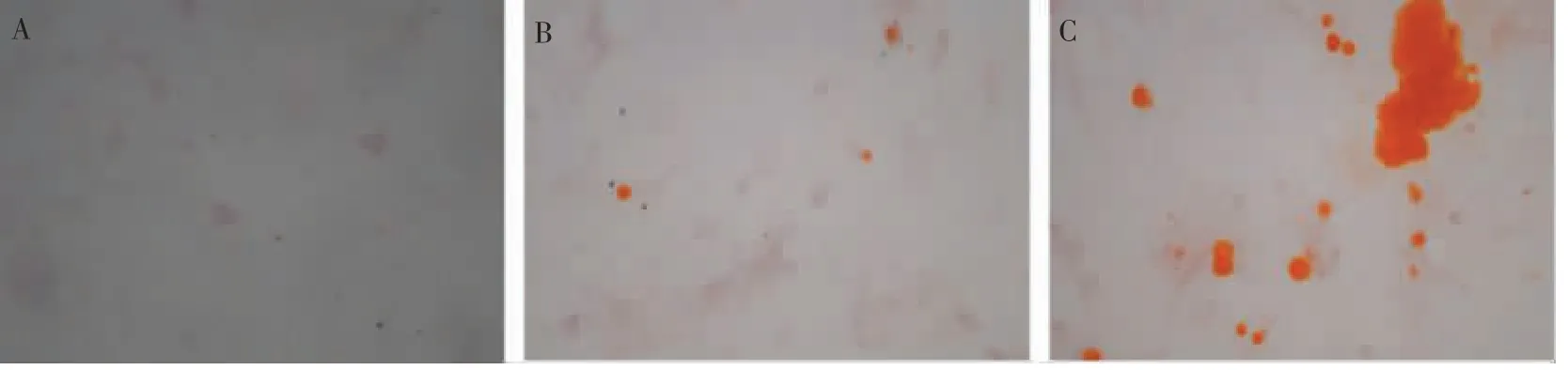
图5 镜下观察不同组中钙结节的生成量(×200)Figure 5 Microscopic observation of production of calcium nodules in different groups(×200)
3 结论
BMSCs具有较强的免疫抑制特性,能够通过分泌抗炎蛋白,抑制炎性因子的释放和迁移,发挥直接或者间接的抗菌和保护周围组织的作用[7]。此外,研究证实,炎性状态下,BMSCs较牙周膜干细胞具有更强的成骨分化能力[8]。利用LPS诱导BMSCs发生炎症反应,探讨Sirt6在炎性条件下对BMSCs骨向分化的作用,能加深我们对BMSCs成骨的理解。我们通过原代贴壁培养技术从SD大鼠骨髓中成功提取了BMSCs,为后续研究提供了良好的研究载体。
LPS是脂质和多糖的复合物,为革兰氏阴性菌外膜层中特有的一种化学成分,也是内毒素的主要化学成分。LPS具有强大的免疫刺激能力,极低水平的LPS足以能诱导TNF-α和白细胞介素家族(如IL-18)等炎症介质的合成与释放。研究表明,炎性衰老过程中存在大量炎性因子的表达,如IL-1、IL-6和TNF-α等典型炎症标志物水平的升高。衰老与炎症是相互作用的,衰老过程常伴随炎症稳态失衡,而炎症又可导致衰老。牙周炎导致颌骨和牙齿的丧失,即可看作炎性衰老的进程之一。TNF-α促进炎症细胞侵入牙周组织,破坏骨改建的内稳态,使骨代谢发生紊乱,加速骨组织的丧失[9]。本研究利用LPS刺激BMSCs产生炎症反应,检测结果显示,培养液中TNF-α、IL-1β、IL-6的表达量升高,同时BMSCs也具有反向抑制炎症因子分泌的功能。然而,也有学者认为,炎性条件下TNF-α会刺激骨的形成,并推断TNF-α具有不同的功能,可能与TNF-α的干预时间或骨形成的不同阶段有关[10-11]。
已有报道表明,Sirt6可抑制TNF-α诱导的血管外膜成纤维细胞的炎症反应[12]。在骨关节炎(osteoarthritis,OA)软骨和滑液中观察到IL-1β和TNF-α等促炎细胞因子水平升高,进而增加基质金属蛋白酶的表达,降低软骨胶原和蛋白多糖的含量。Lee等[13]证明,过表达Sirt6可以抑制胶原诱导的关节炎小鼠的炎症反应。此外,Xiao等[14-15]的研究表明,干扰Sirt6可以抑制骨向分化,影响成骨细胞的生成;靶向miR-186下调,可以抑制小鼠BMSCs的成骨分化,而过表达Sirt6则可以逆转这一趋势。本研究中,Sirt6的过表达干扰了炎症BMSCs中TNF-α、IL-1β和IL-6的表达,减弱了炎症反应的程度。这些结果表明,Sirt6在BMSCs中是一种抗炎因子。Sirt6通过抑制促炎细胞因子的分泌,减轻LPS诱导的BMSCs炎症反应。然而,在LPS长时间的作用下,BMSCs也会受到一定的损伤,自身功能会减弱。重要的是,我们发现Sirt6在炎症条件下能刺激BMSCs向成骨细胞分化。过表达Sirt6后,成骨标志物OCN、ALP、BSP的蛋白水平明显升高,并且在LPS的刺激下,骨性分化生成钙结节的表达量明显增多。这一发现与之前的报告[16]一致,Sirt6通过抑制核因子-核转录因子κB(nuclear factor-kappa B,NF-κB)信号通路促进大鼠BMSCs成骨分化,也可以通过正向调控骨形态发生蛋白(bone morphogenetic protein,BMP)通路促进大鼠BMSCs成骨分化。本课题组通过过表达Sirt6调控p38/ERK信号通路,也能促进大鼠BMSCs的成骨分化,但该结果尚未发表。所有这些结果进一步证明,Sirt6在BMSCs的成骨过程中是一个关键的调节因子,具有抑制炎症和促进骨向分化的双重作用。随着年龄的增长,Sirt6蛋白逐渐衰减,炎性衰老趋势明显。因此,如何控制抗衰老蛋白Sirt6的衰减周期,增强Sirt6的表达,进而延长机体的寿命,仍然是摆在我们面前的一个挑战。
