GO-PEEK复合材料的骨诱导功能
2021-07-15张琳梅张耀超左艳萍
张琳梅,张耀超,左艳萍,梁 斌
(1西安医学院口腔医学院口腔解剖生理学教研室,西安 710021;2西安医学院口腔医学院口腔修复学教研室;3西安医学院口腔医学院口腔组织病理学教研室;*通讯作者,E-mail:2111422131@qq.com)
由颌面部外伤、肿瘤等疾病引起的下颌骨缺损将会导致患者咀嚼、言语、吞咽和呼吸功能障碍,严重影响患者生活质量。近年来,生理重建技术有了很大的提高,随之涌现出了大批具有良好组织相容性的生物重建材料。钛金属及其合金材料因其优异的耐蚀性能、机械强度以及组织细胞相容性,成为目前整形外科以及口腔界最受欢迎的生物替代材料[1]。然而,在临床工作中严重的术后并发症如骨溶解、过敏反应、植入物松动以及最后的植入失败都有可能发生[2]。为了克服这些金属植入物的临床限制性,尽量减少植入后生物反应的负面影响,寻找金属的有效替代品也是亟待突破的重点问题。
聚醚醚酮(polyetheretherketone,PEEK)是一种聚芳半结晶热塑性聚合物,其分子结构为(-C6H4-O-C6H4-O-C6H4-CO-)n[3]。PEEK材料在医学中的应用主要常见于外科领域。从加工的角度来看,PEEK材料可以通过传统的塑料加工获得,反复消毒和加热可制作出个性化的轮廓,以适应于相应的骨骼形状[4]。然而,因为缺乏初期直接骨沉积和后期骨结合的能力,它在重建后的骨承重方面的应用是有限的[5]。
氧化石墨烯(graphene oxide,GO)是石墨烯家族中最重要的衍生物之一,GO通过疏水性和静电作用显著改善与蛋白质的相互影响,并有可能潜在地增强干细胞的成骨分化[6]。尽管如此,纳米材料自身的毒性还是引起了广泛的争议。将GO结合在无毒副作用的基质上,可以限制其流动性,从而使控制细胞毒性降到可接受的水平以下[7]。已有研究证实GO基平面拥有较多的π键结合结构,它可以与PEEK材料中的π键形成强大而稳定的π-π结合[8]。然而通过文献研究发现,利用GO作为表面涂层应用在PEEK中是否具有更强的成骨活性并没有相应的深入研究。
本研究设想通过3D打印PEEK仿下颌骨多孔支架,利用GO修饰表面,通过成骨相关指标检测复合支架的生物性能及成骨性能,初步探索GO-PEEK复合材料在细胞外基质中的骨诱导功能。为GO-PEEK作为一种新型的具有良好抗菌性能及成骨能力的下颌骨缺损修复材料提供理论依据,以进一步拓宽骨组织工程在颌面部骨缺损领域的应用。
1 材料和方法
1.1 实验设计及分组
为了增加支架表面的微孔结构,研究组首先对3D打印PEEK仿下颌骨支架进行硫化处理,形成S-PEEK支架。继而通过将S-PEEK支架与GO(氧化石墨烯)混合,以达到GO充分结合支架,优化骨诱导能力以及材料本身抗菌性能的目的,从而制备GO-PEEK支架。根据骨髓间充质细胞接种于PEEK、S-PEEK、GO-PEEK不同支架表面,实验分为:空白对照组(仅接种骨髓间充质干细胞,无支架)、PEEK组(骨髓间充质干细胞+PEEK支架4枚)、S-PEEK组(骨髓间充质干细胞+硫化PEEK支架4枚)、GO-PEEK组(骨髓间充质干细胞+氧化石墨烯PEEK支架4枚)。采用CCK、RT-PCT等检测方法考察研究不同支架对骨髓间充质干细胞的物学性能及成骨相关基因:Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)、Ⅰ型胶原蛋白α1(collagen type Ⅰ alpha 1,COLLA1)、骨钙素(osteocalcin,OCN)的表达情况的影响。
1.2 实验材料
细胞及PEEK支架;骨髓间充质细胞(提取自SD大鼠下颌骨);PEEK支架(由西安交通大学快速制造国家工程研究中心经3D打印获得)。FTC-3000TM System(Funglyn生物公司,加拿大);正反向引物及测序引物合成(上海生工生物有限公司);DEPC纯水(ABI公司,美国);低温高速离心机(5810R,Eppendorf公司,美国);UV3000紫外可见分光光度仪(岛津,日本);扩增仪(9700NA,MJ公司,美国);无核酸酶离心管(Eppendorf,EP,先锋生物科技有限公司);氯仿,75%乙醇,异丙醇,98%硫酸,丙酮(西安交通大学医学院设备科);裂解液(Trizol,Invitrogen,美国);PrimeScript RT reagent kit(TaKaRa,美国);SYBR Premix Ex(TaKaRa,美国);干细胞培养基(MesenPRO RSTMMedium,Gibco,USA);恒温孵育箱(RC03000T-5-VBC-C02,Therono Electron Corporation);96孔板;烤箱(西安交通大学医学院设备科);图像信号采集及处理系统(Q550CW,Leica公司,德国)。
1.3 实验方法
1.3.1 3D打印PEEK仿下颌骨微孔支架 采用西安市中心医院影像中心Philipsi CT对健康成年人下颌骨进行薄层CT扫描。扫描参数为:厚度0.625 mm;像素0.580 mm;电压120 kV;单位时间射线量240 mAs;无间隙容积扫描。受试者取仰卧位、张口位(上下牙列分离);眶耳平面与水平面垂直;扫描平面垂直于眶耳平面。扫描范围:全颅骨。所获扫描数据以DICOM 3.0储存。将CT扫描的原始DICOM数据导入Mimics 16.0。所有数据转交于西安交通大学快速制造国家工程研究中心,由相关技术人员提取下颌骨松质骨相关数据,并运用医疗级PEEK材料进行3D打印,最终形成2 mm×2 mm×2 mm标准微孔支架。
1.3.2 样本制备 3D打印的的PEEK支架均使用丙酮、乙醇、蒸馏水超声波洗涤。室温下,部分PEEK支架采用98%的硫酸进行硫化处理5 min,为了获得均匀的多孔结构,整个过程中均使用超声搅拌。随后将样品取出并浸入丙酮中,搅拌10 min,去除表面残留。之后,样本在蒸馏水中超声波清洗10 min。重复3次,最后标本在烤箱60 ℃烤干作为S-PEEK组支架备用。超声波振动将5 mg的GO分散到50 ml蒸馏水中4 h,形成均匀的GO悬浮液。部分S-PEEK支架浸泡在GO混悬液中10 min。浸泡之后,支架于烤箱中100 ℃烤干10 min。上述过程重复5次,以确保S-PEEK支架所有微孔隙均被GO覆盖。最后将样本置于60 ℃烤箱过夜,留作GO-PEEK组支架备用。
1.3.3 SD大鼠下颌骨骨髓间充质细胞提取 选择6-8周龄SPF级雄性SD大鼠,体质量约350-400 g(西安交通大学医学部动物实验中心)。经4%水合氯醛腹腔麻醉后处死,75%酒精浸泡消毒,无菌条件下解剖双侧下颌骨后浸泡在1%青链霉素PBS中。紫外光下静置30 min,倒掉PBS,再次冲洗3次。去除下颌骨双侧骨骺,暴露骨髓腔。随后用干细胞培养基反复冲洗骨髓腔,并将其移至含MesenPRO RSTMMedium培养瓶中,37 ℃,5% CO2培养箱中培养。
1.3.4 细胞培养 提前24 h将PEEK支架、S-PEEK支架、GO-PEEK支架置于超净台中紫外照射。实验当天用灭菌镊,分别将不同处理支架放置于6孔板中。骨髓间充质细胞计数,以每孔1.2×106个细胞浓度接种于不同分组支架表面。空白对照组仅接种骨髓间充质干细胞。
1.3.5 CCK-8检测细胞生物学活性 通过测定细胞增殖,探究空白对照组、PEEK支架组、S-PEEK组、GO-PEEK组中不同支架对下颌骨间充质干细胞生存状态的影响。按照1.3.4细胞培养的方法,骨髓间充质细胞培养第1天后,经0.25%胰酶消化,细胞计数,以每孔5×104个细胞浓度按不同分组铺96孔板。培养24,48,72 h向每孔加入10 μl CCK-8溶液,再次孵育4 h,使用酶标仪测定在450 nm处的吸光度,吸光度值越高,细胞活性越高。
1.3.6 RNA提取 按照1.3.4细胞培养的方法,细胞培养第5天后,分别收集不同分组的细胞,加入1 ml的Trizol液,室温放置10 min;随后转移至1.5 ml EP管中,12 000 r/min,4 ℃离心10 min;将混悬液上清转移至无菌无酶EP管,加入200 μl氯仿,震荡15 s,室温下静置2-3 min;混悬液12 000 r/min,4 ℃离心15 min;吸取上层水相于新的无菌无酶EP管中,加入500 μl异丙醇,室温静置10 min;混合液12 000 r/min,4 ℃离心10 min;离心完毕后弃上清,加入1 ml含有75%乙醇,吹起位于底部的沉淀后7 500 r/min,4 ℃离心5 min;离心完毕后弃上清,EP管室温放置干燥10 min。EP管内完全干燥后加入30 μl无核酸酶水(Diethyl pyrocarbonate,DEPC),离心1 min,55-60 ℃水浴溶解RNA。分光光度仪检测RNA浓度,一般A260/A280在1.8-2.0,A260/A230在1.9-2.1为宜。
1.3.7 qRT-PCR检测成骨相关基因RUNX2、OOLA1、OCN表达情况 设计与成骨相关基因的上下游引物。按照1.3.4的细胞培养方法,培养第2天后,Trizol法提取RNA。经过逆转录、RT-PCR分别检测与成骨密切相关的Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)、Ⅰ型胶原蛋白α1(collagen type Ⅰ alpha 1,COLLA1)、骨钙素(osteocalcin,OCN)的表达情况,β-actin作为内参对照。qRT-PCR实验所得数据运用2-ΔΔCt公式计算。反应条件为:首先95 ℃,30 s;接着95 ℃,5 s→60 ℃,30 s,40个循环。引物设计见表1。

表1 RUNX2、COLLA1、OCN引物序列Table 1 Primer sequences of RUNX2, COLLA1 and OCN
1.4 统计学分析
qRT-PCR实验所得数据运用2-ΔΔCt公式计算。数据统计分析选用独立样本t检验。CCK-8实验所得数据通过双因素方差分析(two-way ANOVA)进行统计分析。所有结果重复3次。Graph Pad Prism 6软件进行绘图。P<0.05认为差异有统计学意义。
2 结果
2.1 不同支架材料对骨髓间充质干细胞活性的影响
2.1.1 PEEK材料抑制骨髓间充质干细胞活性 与空白对照组相比,PEEK组间充质干细胞接种于PEEK材料24 h,未见明显细胞增殖差异;当继续培养至48 h,细胞活性显著下降(P<0.01),出现细胞死亡现象(见图1)。
2.1.2 S-PEEK材料抑制骨髓间充质干细胞活性 与空白对照组相比,S-PEEK组培养24 h,即发生细胞活性降低趋势,少量细胞死亡现象,差异无统计学意义。当继续培养至48 h,细胞活性显著下降(P<0.01),出现大量细胞细胞死亡现象。与PEEK组相比,S-PEEK组S-PEEK培养至24 h时,出现细胞活性降低趋势,72 h细胞活性显著降低(P<0.01,见图2)。
2.1.3 GO-PEEK支架材料促进骨髓间充质干细胞活性 与空白对照组相比,GO-PEEK组培养24 h,细胞活性出现增长。自24 h后间充质细胞活性出现逐渐增长趋势。48 h及72 h均出现骨髓间充质细胞活性增长,差异具有统计学意义(P<0.01,见图3)。
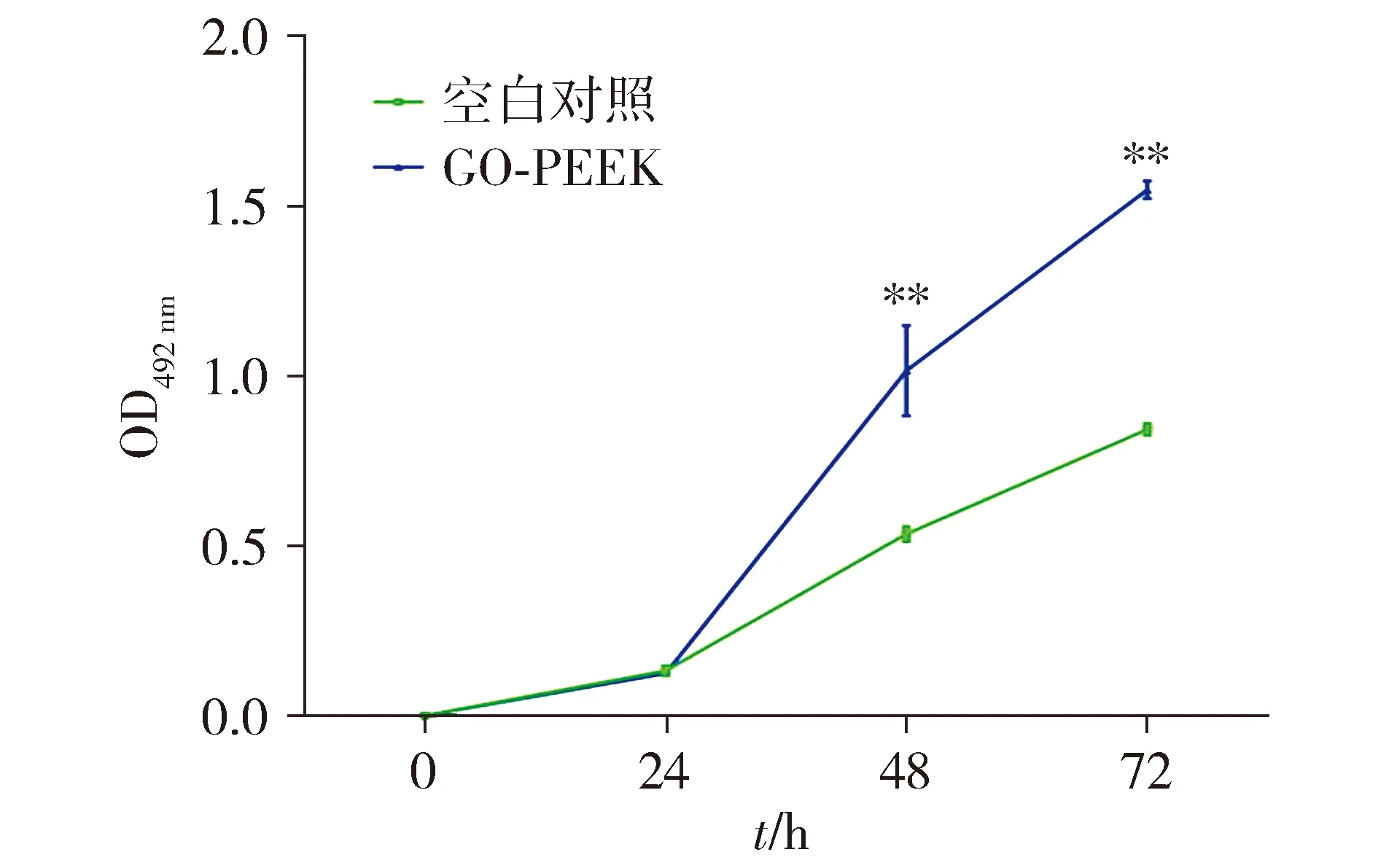
与空白对照组比较,**P<0.01图3 CCK-8检测GO-PEEK支架表面间充质干细胞活性Figure 3 The proliferation of mesenchymal stem cells on the surface of GO-PEEK by CCK-8
2.2 不同支架材料对骨髓间充质干细胞成骨相关因子的影响
与空白对照组相比,PEEK组骨髓间充质干细胞RUNX2基因在mRNA水平表达量降低(P=0.018);S-PEEK组骨髓间充质干细胞RUNX2基因在mRNA水平表达量亦降低(P<0.01);GO-PEEK组RUNX2基因在mRNA水平表达量增高(P<0.01,见图4)。
实验结果显示:与空白对照相比,间充质干细胞与PEEK支架共培养后,COLLA1基因在mRNA水平表达下调未见明显差异;而与S-PEEK支架共培养后,出现表达量下调(P<0.01);与GO-PEEK共培养后,COLLA1基因在mRNA水平表达量增高(P<0.01,见图4)。
相比较于空白对照组,PEEK组及S-PEEK组OCN基因表达量呈下调趋势,S-PEEK组明显下调(P<0.01);而GO-PEEK组OCN基因在mRNA水平表达量增高,差异有统计学意义(P<0.01,见图4)。
3 讨论
聚醚醚酮是一种聚芳半结晶热塑性聚合物,其分子结构为(—C6H4—O—C6H4—O—C6H4—CO—)n[3]。其物理性质如下:①水溶性(室温下)是0.5%(W/W)[5];②除98%的硫酸外,不溶于任何传统溶剂[9];③弹性模量约为3-4 GPa,与人类骨密质(7-30 GPa)相比略显不足[4];④具有较好的热性能,在体内有较强的稳定性[3]。除了这些优良特性外,PEEK材料还具有良好的耐化学腐蚀性能、无毒性、天然的辐射透射性能和磁共振成像兼容性等[10]。由此可知,PEEK材料在颅颌面重建中的应用无可非议,然而,因为缺乏初期直接骨沉积和后期骨结合的能力,它在重建后的骨承重方面的应用是有限的[5]。同样,PEEK材料的生物惰性以及较差的抗菌性也在很大程度上限制了其在临床工作中的应用[11]。研究提示RUNX2是调控成骨细胞、促进骨性形成的关键性调控因子[12],COL1A1型胶原蛋白是骨骼、皮肤和肌腱等许多人体组织中最丰富的胶原蛋白。COL1A1基因的功能丧失与成骨不全症(脆骨病)密切相关[13]。OCN骨钙蛋白是成骨的主要标记物[14]。本研究通过在PEEK组检测上述基因表达情况,结果发现,将SD大鼠下颌骨骨髓间充质干细胞与PEEK材料共培养时,细胞的增殖能力逐渐减弱,与无支架培养的对照组相比较,成骨相关基因RUNX2、COL1A1、OCN的表达量下调(P<0.05)。说明PEEK材料本身不利于促进骨组织在材料表面沉积及形成稳定的骨结合。这可能与其自身生物惰性、较差的抗菌性以及支架本身表面缺乏微空隙结构,不利于细胞沉积密切相关。
为了增加PEEK材料周围骨组织的沉积以及生物学性能,可以采用表面结构改性或进行生物活性物质表面涂层等方法[15,16]。经过改性的PEEK复合材料在一定程度上提高了单一PEEK材料的弹性模量,促使其近似于皮质骨(18 GPa),在一定程度优化了其骨诱导能力以及材料本身抗菌性能。本研究通过用氧化石墨烯混悬液(GO)处理PEEK支架,形成GO-PEEK复合支架,并在此基础上研究其生物学性能及成骨性能。但是由于PEEK材料为惰性材料,很难在其表面形成理想的微孔隙结构,GO混悬液的附着率及后期成骨虽仍不尽人意。有一种提高PEEK材料骨结合能力的方法例如在其表面增添孔隙结构,多孔的表面结构能显著促进软硬组织的生长,从而创造了更多的生物锚定,以此提高植入物的稳定性[17]。研究认为,应用于金属表面的微孔隙结构包括喷砂[18]、微弧氧化[19]、阳极氧化[20]、酸蚀[21]以及碱处理[22]。但是大量硫官能团产生的硫化作用直接导致细胞中DNA的损伤[23]。有学者研究发现,经过浓硫酸处理的PEEK材料表面可形成理想的网络微孔隙,这种结构在体外能更好地促进细胞黏附、细胞增殖、骨分化且大幅增强骨整合和骨植入物在体内的结合强度[24]。因此本研究采用98%浓硫酸酸化处理PEEK支架(S-PEEK),改善PEEK材料自身的不足,促使其结构更趋近于下颌骨的筛状结构,从而在一定程度促进GO混悬液的附着率;后期成骨能力;改善其细胞损伤、抗菌性能不足等劣势。实验结果发现S-PEEK支架具有比PEEK支架更明显的细胞毒性作用,附着在其中的骨髓间充质干细胞生物学活性明显降低(P<0.01),成骨能力几乎为零。推测可能与S-PEEK支架表面残留的酸性物质,直接导致细胞中DNA的损伤相关。
氧化石墨烯含有sp2杂化碳原子,并且具有大量的活性氧官能团[25]。GO通过疏水性和静电作用显著改善与蛋白质的相互影响,并有可能潜在地增强干细胞的成骨分化[6]。此外,GO纳米片对革兰氏阴性和革兰氏阳性细菌表现出明显的抗菌能力[26]。因此,GO广泛应用于生物传感器、细胞成像、纳米探针、药物传递和组织工程等生物技术和生物医学领域[27,28]。但是,GO生物反应的变化取决于其层数、刚度、疏水性、表面功能化、剂量、靶细胞中活性氧的生成以及GO极高的疏水性表面均可能导致直接的物理毒性或生物分子的吸附作用引起间接毒性。有研究表明[8]:GO溶液比GO涂层具有更高的毒性,因为GO的粗糙边缘可以穿透细胞膜,破坏正常的细胞功能。因此,将GO结合在无毒副作用的基质上,可以限制其流动性(从而避免其与细胞之间不必要的相互作用),以此可调整GO尺寸,从而使控制细胞毒性降到可接受的水平以下。本实验研究通过GO溶液充分覆盖在经酸化的多孔PEEK支架表面(GO-PEEK),结果发现:将SD大鼠下颌骨骨髓间充质干细胞与GO-PEEK材料共培养时,细胞的增殖能力增强(P<0.01),与PEEK和S-PEEK支架材料相比较,成骨相关基因RUNX2、COL1A1、OCN的表达量显著升高(P<0.01)。
以上结果表明:GO-PEEK复合支架在一定程度上改善了PEEK自身的生物惰性、较差的抗菌性、缺乏初期直接骨沉积和后期骨结合的能力;中和优化了因为S-PEEK支架表面残留的酸性物质直接导致的细胞DNA损伤;优化了GO本身极高的疏水性表面导致的直接物理毒性和生物分子吸附作用引起地间接细胞毒性。GO-PEEK对间充质干细胞的成骨相关有一定促进作用。是一种新型的具有良好抗菌性能及成骨能力的下颌骨缺损修复材料,最终可拓宽骨组织工程在颌面部骨缺损领域的应用。
