纳米蛹虫草活性肽靶向型微囊降血糖活性研究
2021-07-15张海东郭鸿儒冯亚民宫田娇杨淑芳
张海东 郭鸿儒 冯亚民 张 健 宫田娇 杨淑芳
(吉林省蚕业科学研究院,吉林吉林 132000)
蛹虫草,又称北虫草,简称蛹草,属子囊菌亚门(Ascomyxotinae)肉座目(Hypocreales)麦角菌科(Clavicipitaceae)虫草属[1]。蛹虫草活性肽是一类具有抗氧化、增强免疫功能以及降血糖作用的小分子生物,但直接口服极易被生物体内酶所分解,失去生物活性[2-4]。复相乳液法是指对于亲水性药物可以采用在 O/W 型溶剂挥发法基础上改良的 W/O/W 型溶剂挥发法[5-6]。在医学、农业、食品、日用化学品、生物制品化工等领域应用广泛[7-10]。药物首先溶解于内水相中,然后药物溶液加入油相中通过超声或高速搅拌乳化形成 W/O 初乳,接着初乳加入外水相中,制成 W/O/W 复乳,最后得到微球,此种方法对于大分子亲水性物质能够得到高药品包封率,有效地保留了生物活性。
近年来,随着经济的发展和生活水平的提升,人们的膳食结构发生了显著的变化,与饮食相关的以高血糖、高血脂、高血压为主的代谢性疾病—糖尿病的发病率逐年升高[11-13]。目前常用食疗、口服降糖药或胰岛素治疗糖尿病[14-15]。然而,传统的双胍类药物和磺酰脲类有许多副作用,使部分患者无法进行使用[16-17]。植物多糖来源广泛且毒副作用小,针对于具有降血糖活性的植物多糖研究已成为生物技术及医药界的热门话题[18-20]。本研究对蛹虫草肽聚乳酸微囊作为治疗糖尿病的功能性药物进行的研究,为其在生物、医药领域的应用提供理论基础。
1 材料与方法
1.1 材料与主要试剂
蛹虫草:由吉林省蚕业科学研究院提供。
蛹虫草肽聚乳酸微囊:复相乳液法制得的蛹虫草肽聚乳酸微囊。
链脲佐菌素(STZ),Sigma公司;盐酸二甲双呱片,北京太洋药业有限公司;
血糖试纸,长沙三诺生物传感技术股份有限公司;95%乙醇、浓硫酸、苯酚、正丁醇、氯仿均为分析纯;甘油三酯(TG)测定试剂盒、总胆固醇(CHO)测定试剂盒、血清尿素氮(BUN)测定试剂盒、肝糖元测定试剂盒、胰岛素(INS)测定试剂盒,南京建成生物工程研究所。
昆明种小白鼠(体重18~22 g,雄性):辽宁长生生物有限公司提供的清洁级实验动物。
1.2 研究方法
1.2.1 蛹虫草肽聚乳酸微囊的制备
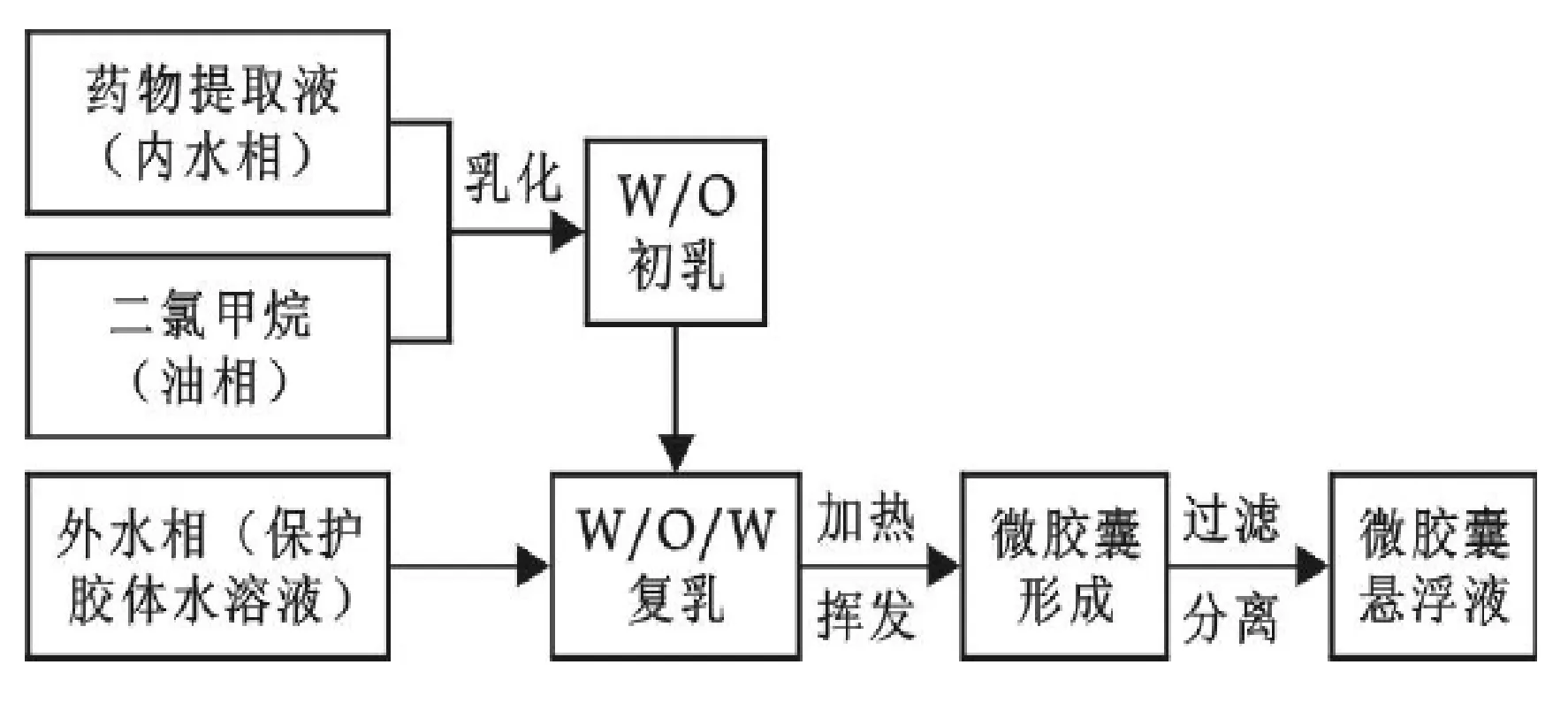
图1
内水相为多肽冻干粉的水溶液,油相为溶解了PLA的DCM溶液。将油相慢慢注入激烈搅拌着的内水相中,并高速搅拌20 min,使其成为一个超细、均匀的W/O乳液。待均匀乳液形成后,将得到的乳液迅速冷却到10 ℃左右,以增加W/O乳液本身的粘度。然后再将浓度为3.5% PVA溶液用注射器注入搅拌着的乳液中,低速低温条件下继续搅拌一定时间后,将该W/O/W乳液置于40 ℃的恒温水浴中继续搅拌,蒸发除去其中的DCM,1 h后停止加热。待乳液冷却后进行离心分离。离心得到的固体用蒸馏水洗涤,再离心分离。最后将离心得到的固体置于表面皿上,真空冷冻干燥至固体粉末恒重为止。
1.2.2 一般状态观察
每天观察动物1次,观察各组间动物的精神状况、行为和毛色的差异。给药前称体重,每周称重并记录动物体重1次。
1.2.3 多糖对血糖及糖耐量的影响
1.2.3.1 模型的建立
选择健康雄性昆明小鼠,体重18~22 g,标记,称重,禁食12 h后按80 mg/(kg·bw)剂量腹腔注射链脲组菌素,连续注射3 d。72 h后,尾部静脉取血,利用血糖仪对血糖进行测定。选择血糖值在11.1 mmol/L以上的小鼠进行观察,连续出现多食、多饮、多尿症状的小鼠,视为糖尿病(DM)小鼠模型,以备后续试验。
1.2.3.2 分组与处理
将建模成功的小鼠分成5组,每组8只,分别为:模型对照组、阳性对照组以及蛹虫草肽聚乳酸微囊低剂量组、中剂量组、高剂量组,同时设置正常对照组。阳性对照组灌胃二甲双胍组溶液200 mg/(kg·d),各剂量组分别灌胃蛹虫草肽聚乳酸微囊溶液100 mg/(kg·d)、200 mg/ (kg·d)和300 mg/(kg·d),正常对照组、模型对照组每天灌胃等体积蒸馏水,连续灌胃4周。
1.2.3.3 血糖的测定
将小鼠禁食12 h,尾部静脉取血,利用血糖仪对血糖进行测定。
1.2.3.4 糖耐量试验
连续给药4周后,在第29天禁食12 h,空腹尾静脉采血测血糖1次。然后给予1.11 mol/L葡萄糖体重灌胃,0.5 h、1 h和2 h后尾静脉采血,利用血糖仪对血糖进行测定。
计算公式:
曲线下面积(AUC)=0.5×空腹血糖值+0.5 h血糖值+1.5×1 h血糖值+2和血糖值
1.2.4 小鼠脏/体比的测定
解剖前对小鼠称重记录。动物摘眼球取血后,立即解剖,取肝脏、肾脏、脾脏和心脏置于低温生理盐水中清洗,用滤纸擦干后称重,并记录。
1.2.5 血清生化分析
1.2.5.1 TG的测定
a.检测原理
脂肪酶分解血清中甘油三酯为甘油与脂肪酸。在ATP 存在下,甘油激酶将甘油磷酸化生成3-磷酸甘油。3-磷酸甘油被磷酸甘油氧化酶氧化生成磷酸二羟丙酮和过氧化氢。过氧化氢与过氧化物酶、4-氨基比林进行显色反应,生成有色苯醌亚胺。生成醌类化合物颜色的深浅与甘油三酯的含量成正比。其反应如下:




b.检测步骤
血清样本前处理:将新鲜血液置于室温下,自然凝固10~20 min,离心(2 000~3 000r/min-1,5 min)。收集上清,置于低温保存。测定前若出现沉淀,应再次离心。后续操作按试剂盒说明进行,具体操作如表1。
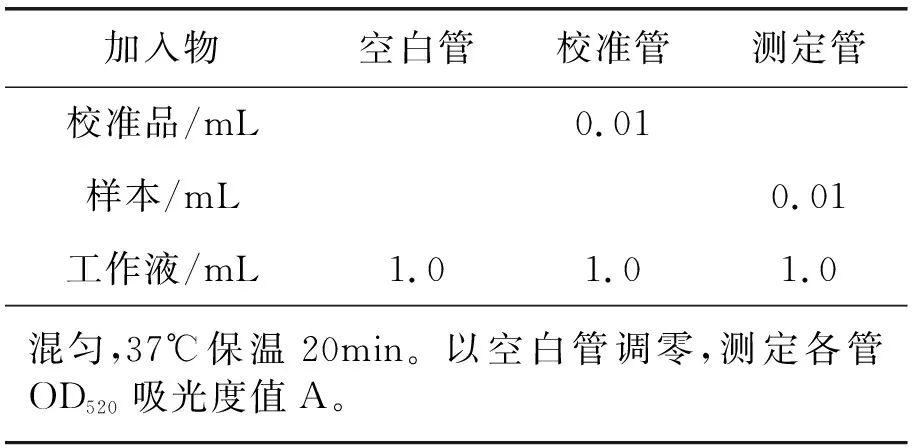
表1 加样操作Ⅰ
c.计算公式
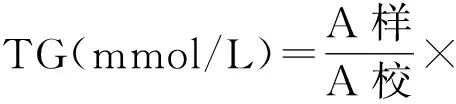
1.2.5.2 CHO的测定
a.检测原理
胆固醇酯加水在胆固醇酯酶的作用下生成游离胆固醇和脂肪酸。游离胆固醇加氧在胆固醇氧化酶的作用下生成胆脘-4-烯-3-酮和过氧化氢,过氧化氢再加4-氨基氨替比林和酚在过氧化酶的作用下生成红色的苯醌亚胺。其反应如下:



b.检测步骤
血清样本前处理:将新鲜血液置于室温下,自然凝固10~20 min,离心(2 000~3 000r/min-1,5 min)。收集上清,置于低温保存。测定前若出现沉淀,应再次离心。后续操作按试剂盒说明进行,具体操作如表2。

表2 加样操作Ⅱ
c.计算公式
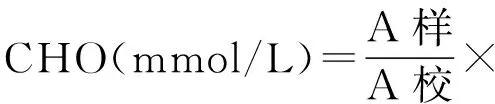
1.2.5.3 BUN的测定
a.检测原理
尿素在脲酶的作用下水解产生氨离子和二氧化碳,氨离子在碱性介质中与酚显色剂生成蓝色的物质,该物质的生成量与尿素含量成正比。
b.检测步骤
血清样本前处理:将新鲜血液置于室温下,自然凝固10~20 min,离心(2 000~3 000r/min-1,5 min)。收集上清,置于低温保存。测定前若出现沉淀,应再次离心。后续操作按试剂盒说明进行,具体操作如表3。
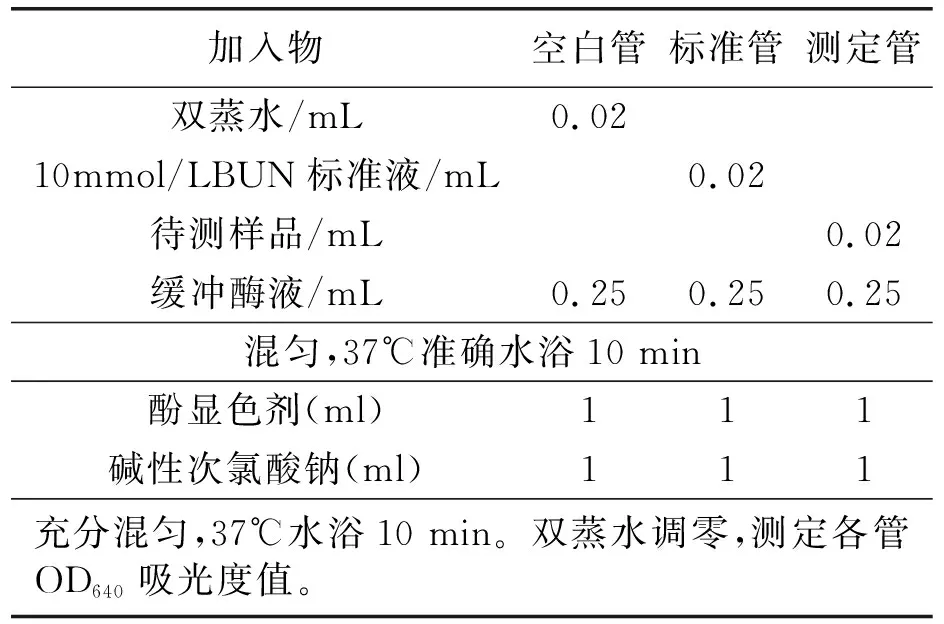
表3 加样操作Ⅲ
c.计算公式:
尿素氮含量(mmol/L)=

1.2.6 对肝糖原的影响
a.检测原理
糖元在浓碱溶液中较稳定,故肝组织先置浓碱中加热,破坏蛋白质及其他成分保留肝糖元,然后加酒精至60%使之沉淀析出并除去小分子有机物质,以免后者在浓硫酸中炭化影响生色。糖原在浓硫酸中可先水解生成葡萄糖,然后进一步脱水生成糠醛衍生物。后者和葱酮作用,形成蓝绿色化合物,与同法处理的葡萄糖标准液比色。
b.操作步骤
肝脏样本前处理:准确称取肝脏组织重量(≤100 mg),按肝脏重量(g)∶碱液体积(mL)=1∶3,一起加入试管中,沸水煮20 min,流水冷却,得糖元水解液。按肝脏重量(g)∶蒸馏水体积(mL)=1∶96向糖元水解液中加入蒸馏水,进一步制备成糖元检测液。后续操作按试剂盒说明进行,具体操作如表4。
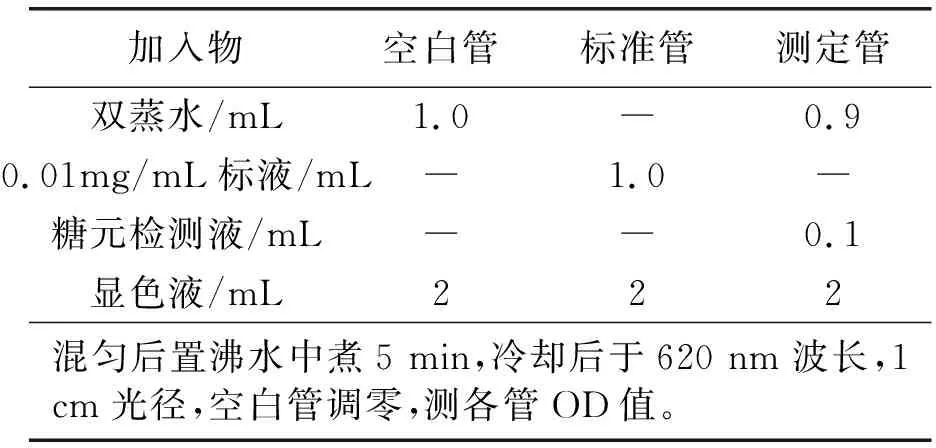
表4 加样操作Ⅳ
1.2.7 对胰岛素的影响
a.原理
应用双抗体夹心法测定标本中小鼠胰岛素(INS)水平。用纯化的小鼠抗-胰岛素(INS)抗体包被微孔板,制成固相抗体,往包被单抗体的微孔中依次加入胰岛素(INS),再与HRP标记的胰岛素(INS)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的胰岛素(INS)呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中小鼠胰岛素(INS)浓度。
b.操作步骤
血清样本前处理:将新鲜血液置于室温下,自然凝固10~20 min,离心(2 000~3 000r/min-1,5min)。收集上清,置于低温保存。测定前若出现沉淀,应再次离心。后续操作按试剂盒说明进行,具体操作如下。
标准品的稀释与加样:在酶标包被板上设标准品孔10孔,在第一、第二孔中分别加标准品100 uL,然后在第一、第二孔中加标准品50 uL,混匀;然后从第一孔、第二孔中各取100 uL分别加到第三孔和第四孔,再在第三、第四孔分别加标准品稀释液50 uL,混匀;然后在第三孔和第四孔中先各取50 uL弃掉,再各取50 uL分别加到第五、第六孔中,再在第五、第六孔中分别加标准品稀释液50 uL,混匀;混匀后从第五、第六孔中各取50 uL分别加到第七、第八孔中,再在第七、第八孔分别加标准品稀释液50 uL,混匀后从第七、第八孔中各取50 uL分别加到第九、第十孔中,再在第九、第十孔分别加标准品稀释液50 uL,混匀后从第九、第十孔中各取50uL弃掉。(稀释后各孔加样量都为50 uL,浓度分别为12 mU/L,8 mU/L,4 mU/L,2 mU/L,1 mU/L)。
加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔先加样品稀释液40 uL,然后再加待测样品10 uL(样品最终稀释倍数为5倍)。加样将样品加于酶标板底部,尽量不触及孔壁,轻轻晃动混匀。
温育:用封板膜封板后置37 ℃温育30 min。
配液:20倍浓缩洗涤液用蒸馏水20倍稀释后备用。
洗涤:小心揭掉封板膜,弃掉液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。
加酶:每孔加入酶标试剂50 uL,空白孔除外。
温育:再次用封板膜封板后置37 ℃温育30 min。
洗涤:再次小心揭掉封板膜,弃掉液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。
显色:每孔先加入显色剂A 50 uL,再加入显色剂B 50 uL,轻轻振荡混匀,37℃避光显色15 min。
终止:每孔加终止液50 uL,终止反应(此时蓝色立转黄色)。
测定:以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。测定应在加终止液后15 min以内进行。
1.2.8 统计分析
采用SPSS软件处理数据,各项指标均以“平均数±标准差”表示。组间和组内比较采用t检验进行统计学分析,并以LSD法进行组间的两两比较。
2 结果与分析
2.1 动物生长状况
在试验过程中,小鼠注射STZ后,毛色杂乱,行动迟缓,具出现明显的“三多一少”的糖尿病症状。给药治疗4周后,与高血糖模型对照组相比,蛹虫草肽聚乳酸微囊组小鼠的皮毛光泽,行动较为灵活,说明蛹虫草肽聚乳酸微囊可使糖尿病小鼠的健康状况呈现良好的状态。
蛹虫草肽聚乳酸微囊对糖尿病小鼠体重的影响图2-1。由图2-1可知,建模后的小鼠体重明显低于正常对照组的小鼠。建模后将小鼠按照体重及血糖水平状况平均分组。4周后,正常对照组健康小鼠体重呈正常增长趋势,模型对照组以及蛹虫草肽聚乳酸微囊剂量组小鼠体重明显低于正常对照组(P<0.01),蛹虫草肽聚乳酸微囊低、中、高剂量三组的小鼠体重与模型对照组相比无显著差异。
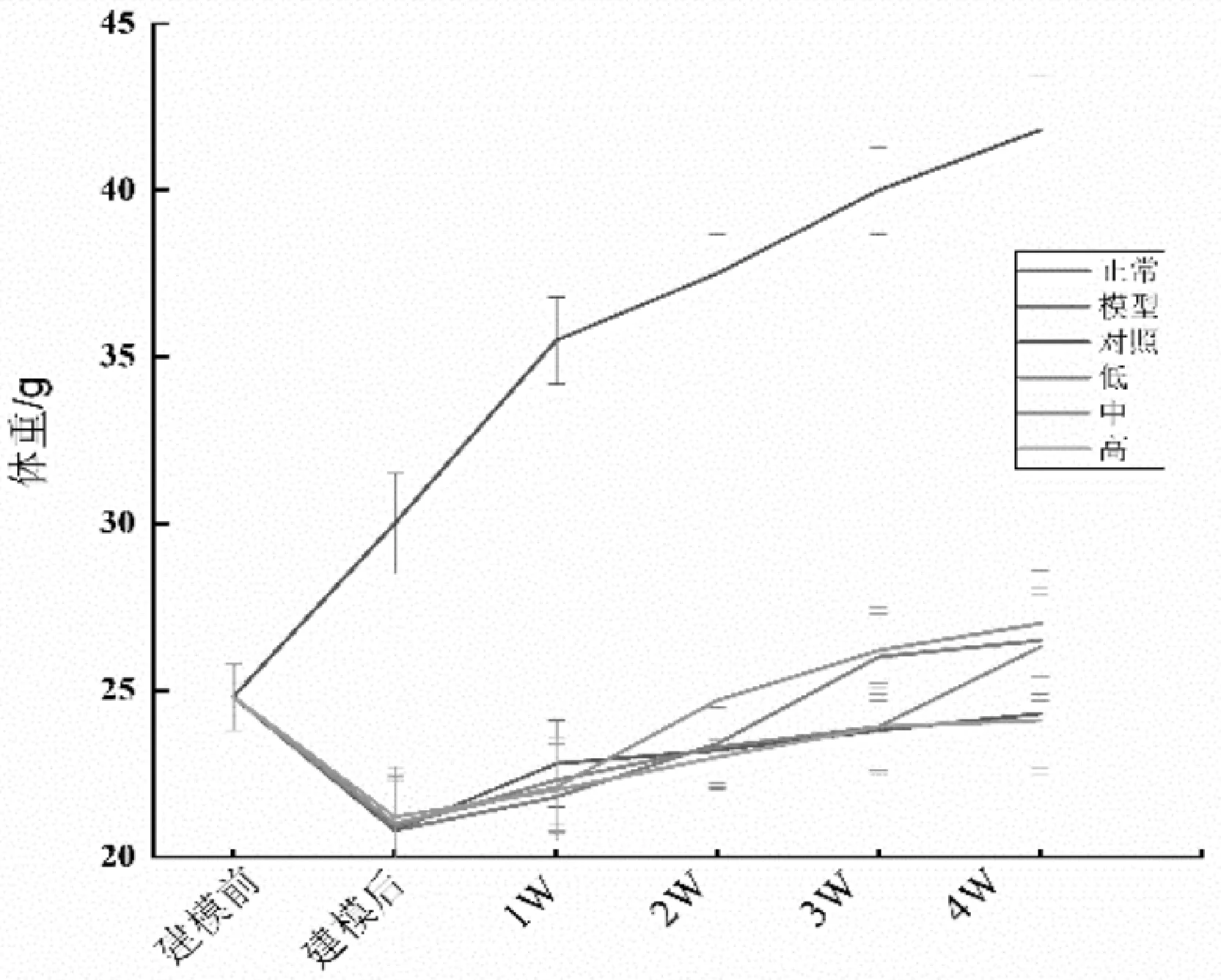
图2-1 蛹虫草肽聚乳酸微囊对糖尿病小鼠体重的影响
2.2 蛹虫草肽聚乳酸微囊对小鼠血糖的影响
蛹虫草肽聚乳酸微囊对糖尿病小鼠血糖的影响如图2-2所示。由图2-2可知,建模后与正常对照组比较,糖尿病小鼠的血糖明显升高,说明造模成功。给药4周后,MCP 剂量组:100 mg/(kg·bw)、200 mg/(kg·bw)和300 mg/(kg·bw)的血糖浓度分别为(13.26±0.36)mmol/L、(10.88±0.78)mmol/L、(11.73±1.33)mmol/L,与给药前相比,血糖浓度分别降低了18.60%、38.12%、27.99%,中剂量组的降糖效果最佳。阳性对照组降糖效果高于蛹虫草肽聚乳酸微囊低剂量和高剂量组,降糖率达33.21%,但却低于蛹虫草肽聚乳酸微囊中剂量组。
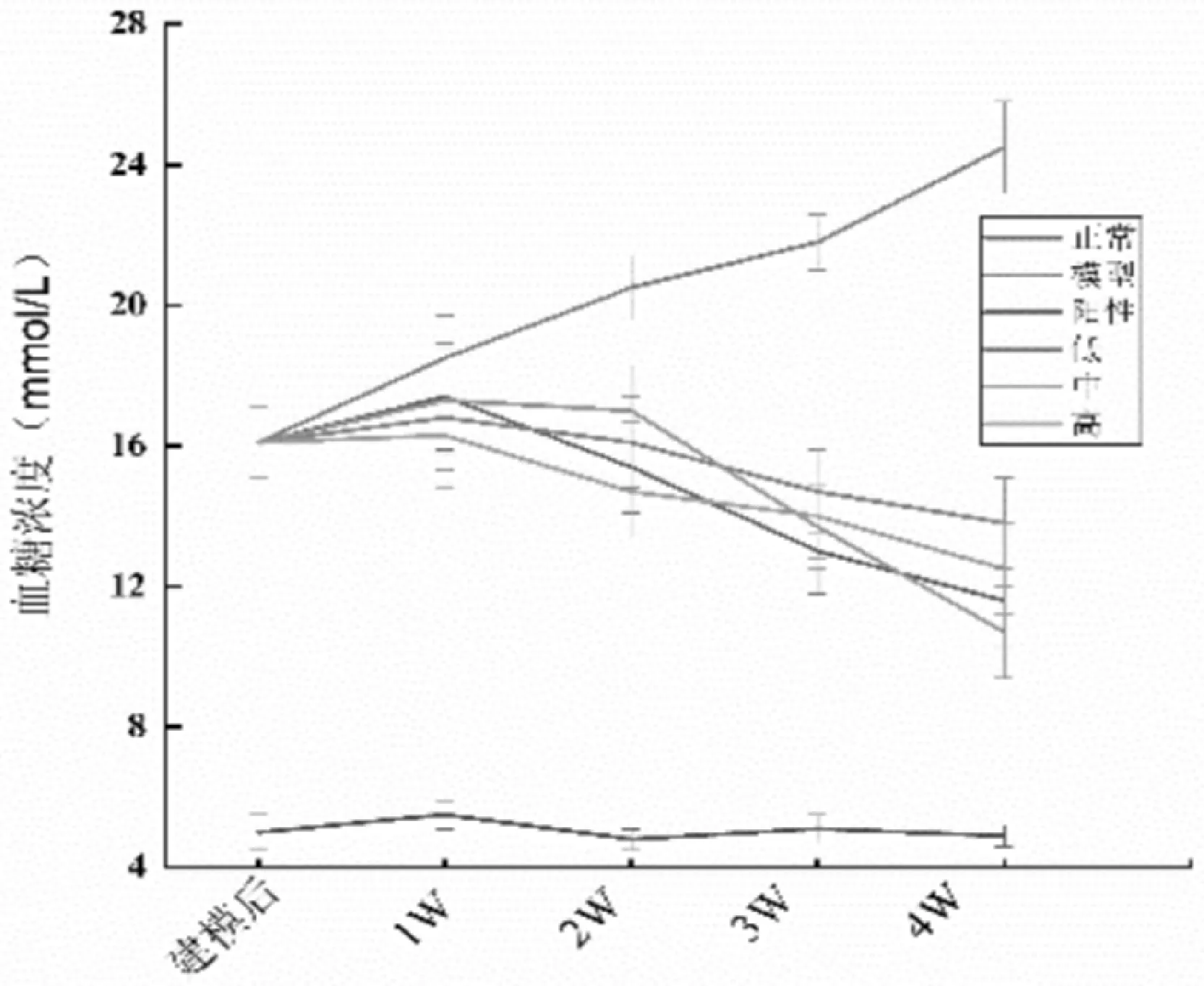
图2-2 蛹虫草肽聚乳酸微囊对糖尿病小鼠血糖的影响
2.3 蛹虫草肽聚乳酸微囊对小鼠糖耐量的影响
糖耐量的实验结果如图2-3和2-4所示。与模型对照组比较,阳性对照组与蛹虫草肽聚乳酸微囊剂量组小鼠的血糖水平和血糖曲线下面积(AUC)均显著降低(P<0.05),说明蛹虫草肽聚乳酸微囊有益于缓解糖尿病症状。
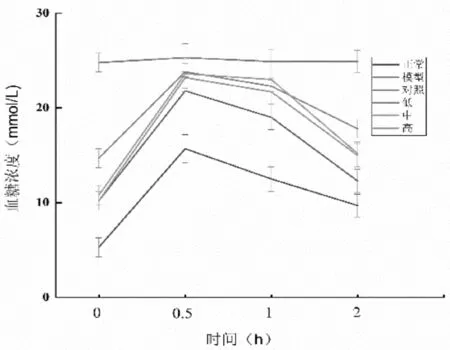
图2-3 蛹虫草肽聚乳酸微囊对小鼠血糖的影响
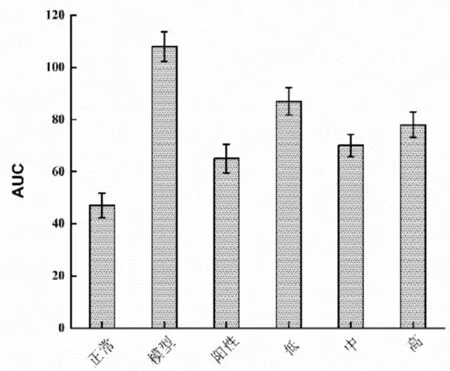
图2-4 蛹虫草肽聚乳酸微囊对糖尿病小鼠糖耐量的影响
2.4 脏器/体重比例的变化情况
在试验终期,小鼠摘眼球取血后迅速解剖,取出脏器,滤纸擦干血迹后称重。结果如图2-5所示。与正常对照组相比,糖尿病模型小鼠肝/体和肾/体的比例明显增加(P<0.05),分别上升了16.42%、20.59%。与模型对照组相比,蛹虫草肽聚乳酸微囊低、中、高剂量组及阳性对照组的肝/体比分别降低了6.33%、12.52%、10.42%和11.29%,其中除低剂量组外其它均表现出显著性差异。(P<0.05);肾/体比分别降低了6.54%、13.06%、11.19%和12.36%,差异均显著(P<0.05)。肾/体比的结果表明蛹虫草肽聚乳酸微囊对肾脏具有一定的保护作用,可抑制肾脏肿大。糖尿病模型小鼠的脾/体比与正常对照组相比则明显降低了14.37%(P<0.05),蛹虫草肽聚乳酸微囊低、中、高剂量组和阳性对照组与模型对照组相比分别上升了11.62%、6.34%、12.86%和10.62%,且除低剂量组外差异均显著(P<0.05)。而心/体比各组间则无明显差异。
2.5 蛹虫草肽聚乳酸微囊对小鼠血清中甘油三酯、总胆固醇和尿素氮的影响
如图2-6所示,本试验利用STZ复制糖尿病小鼠后,与正常对照组相比血清甘油三酯(TG)、血清胆固醇(CHO)、血清尿素氮(BUN)水平都显著升高(P<0.01),分别上升了20.59%、21.16%和23.13%。糖尿病小鼠经灌胃治疗4周后,与模型对照组相比,蛹虫草肽聚乳酸微囊低、中、高剂量组及阳性对照组的TG、CHO、BUN水平均出现了明显的下降现象(P<0.05),TG下降值依次为6.50%、13.01%、11.38%和12.20%;CHO水平分别降低了8.37%、14.59%、11.24%和13.64%;BUN水平分别降低了8.55%、14.66%、13.25%和13.75%。由以上结果分析可知,中剂量组效果最佳。而阳性对照组的治疗效果虽好于低、高剂量组,但却不及中剂量组。
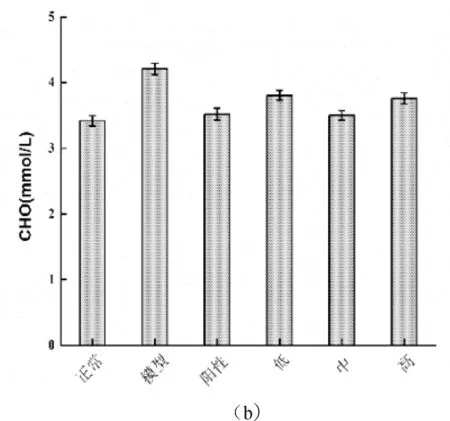
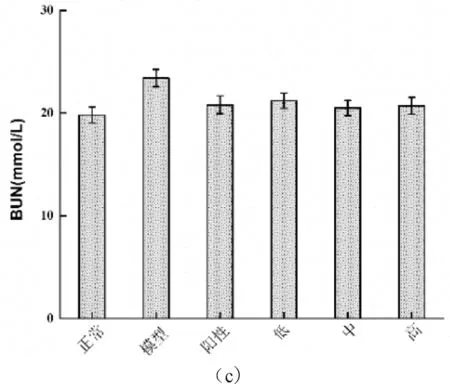
图2-6 蛹虫草肽聚乳酸微囊对糖尿病小鼠血脂的影响
2.6 蛹虫草肽聚乳酸微囊对肝糖元的影响
实验结束时,各实验组小鼠的肝糖元水平变化情况如图2-7。与正常对照组相比,模型组小鼠的肝糖元含量下降了29.23%,差异极显著(P<0.01)。糖尿病小鼠经灌胃治疗4周后,治疗组的肝糖元的含量得到了提升。与模型对照组相比,蛹虫草肽聚乳酸微囊低、中、高剂量组及阳性对照组的肝组织中糖元含量依次升高了14.19%、31.06%、21.47%和25.01%,且差异显著(P<0.05)。
2.7 蛹虫草肽聚乳酸微囊对胰岛素分泌的影响
由于STZ能直接破坏胰岛β细胞,从而减少胰岛素的分泌。结果如图2-8所示。DM小鼠胰岛素含量小于正常小鼠水平,正常对照组血清胰岛素含量为(21.07±2.50)mU/L,而模型组仅为(13.04±1.61)mU/L,下降了38.11%,二者差异显著(P<0.01)。经MCP灌胃治疗后,血清胰岛素含量升高,中、高MCP剂量组胰岛素含量分别为(19.28±2.27)mU/L和(17.90±2.46)mU/L,显著高于模型对照组(P<0.05),从而说明MCP能有效促进胰岛素的分泌,这对血糖的降低有重要贡献。在MCP剂量组中200 mg/(kg·bw)剂量组的胰岛素水平最高,且高于阳性对照组。
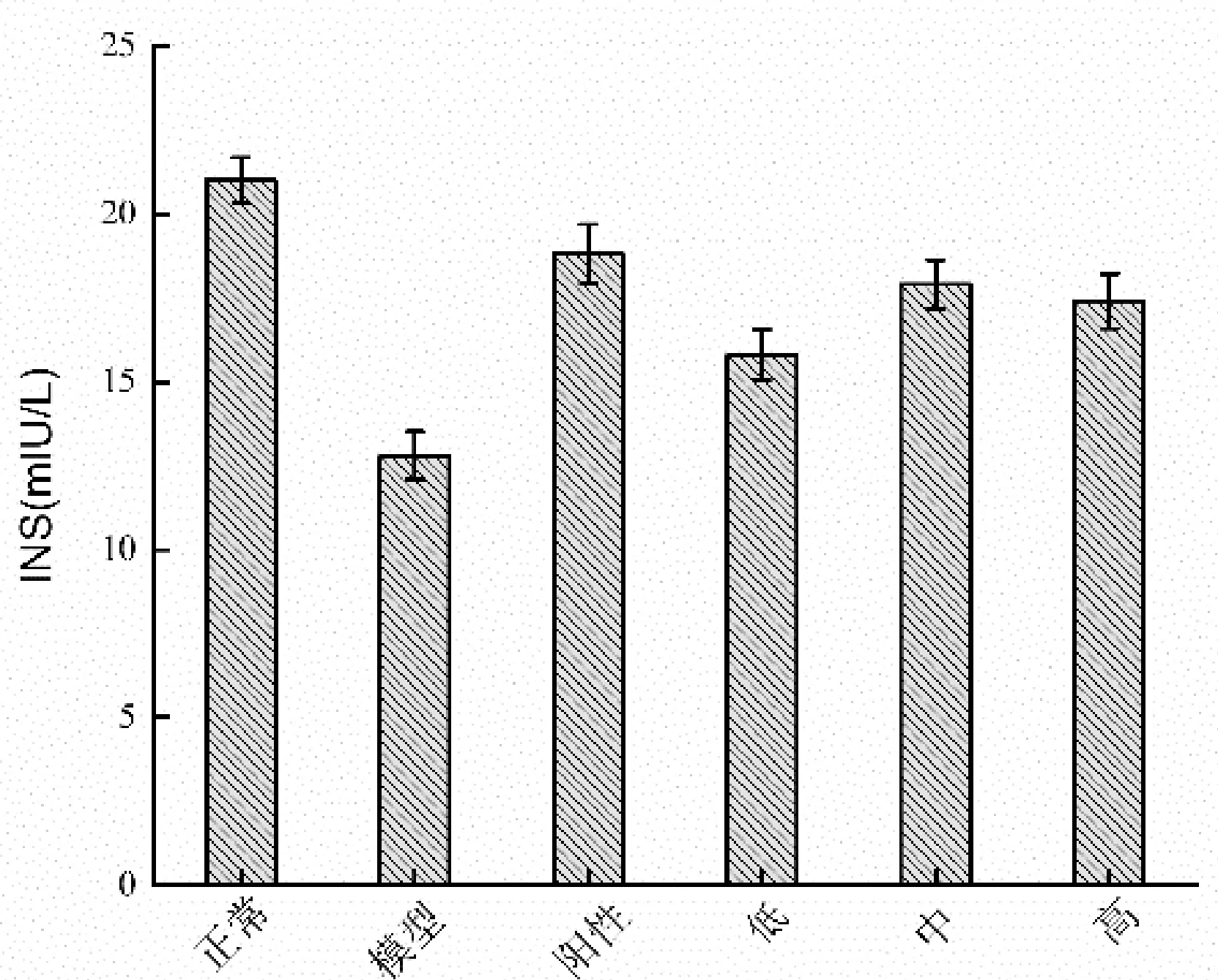
图2-8 蛹虫草肽聚乳酸微囊对糖尿病小鼠血清胰岛素的影响
3 结 论
采用链脲佐菌素腹腔注射,小鼠出现了多饮、多食、消瘦症状,血糖明显升高,这说明成功地建立了糖尿病小鼠模型。
蛹虫草肽聚乳酸微囊能改善糖尿病小鼠消瘦和毛色暗淡等症状,降低糖尿病小鼠血糖浓度,加糖尿病小鼠肝脏中肝糖元的含量,增强糖尿病小鼠耐受葡萄糖能力,提高胰岛素水平,说明蛹虫草肽聚乳酸微囊具有降血糖功效。
蛹虫草肽聚乳酸微囊可治疗糖尿病并发症。经蛹虫草肽聚乳酸微囊灌胃后的小鼠血脂水平(TG、CHO)得到了降低,说明蛹虫草肽聚乳酸微囊可治疗糖尿病引起的脂代谢紊乱症。脏器/体重比例实验结果表明,蛹虫草肽聚乳酸微囊可抑制肝、肾肿大,并修复脾脏的损伤。与模型对照组相比,蛹虫草肽聚乳酸微囊中剂量的尿素氮水平下降了14.66%,肾/体比降低了13.06%,提示蛹虫草肽聚乳酸微囊对糖尿病肾病有着治疗作用。
