纳米蛹虫草活性肽靶向型微囊制备工艺和性能研究
2022-07-19郭鸿儒宫田娇张春杨孙继红杨淑芳
郭鸿儒 宫田娇 张春杨 孙继红 王 茹 杨淑芳
(吉林省蚕业科学研究院,吉林吉林 132012)
蛹虫草是我国重要的人工栽培食药用真菌之一,因其丰富的营养药用价值而被联合国粮农组织誉为“21世纪的健康食品”[1-2]。目前国内外对蛹虫草的营养价值与功效的研究主要聚焦在多糖、虫草素、萜类等方面[3-5],随着多层次多样蛹虫草价值的探索,食药用真菌中活性肽的研究备受瞩目,对深度研发、蛋白质资源高效利用具有重要意义[6-7]。研究表明,以蛹虫草纳米粉为基质,利用地衣芽孢杆菌发酵制备的蛹虫草肽是一类具有抗氧化、增强免疫功能以及降血糖作用的小分子生物无活性物质,是蛹虫草深加工的产物,可广泛应用于食品、医药等行业[8-9]。然而,直接口服生物活性肽极易被生物体内的酶分解,其生物活性也随之消失,使其在医药保健和疾病预防领域受到很大程度的限制,严重阻碍蛹虫草活性肽的市场研发[10]。针对以上问题,本研究采用高分子包埋技术制备蛹虫草肽靶向微囊,不仅可使蛹虫草肽进入到人体后在一定的时间内释放,达到对活性肽剂量的有效控制,还可实现药物的靶向输送,达到缓释/控释目的。试验选取天然明胶、半合成材料乙基纤维素及高分子聚合材料聚乳酸,通过筛选不同囊材制备蛹虫草肽微囊及对其结构进行表征,考察微囊制剂的释放度和降解性,优化工艺条件使其成为理想的靶向剂,为蛹虫草的深加工提供必要的理论及实践指导,也为虫草肽类制剂通过口服途径应用于食品、保健养生等领域提供理论依据。
1 材料与方法
1.1 材料与主要试剂
蛹虫草:由吉林省蚕业科学研究院北冬虫夏草研究中心提供。
地衣芽孢杆菌(Bacilluslicheniformis)E-30,沈阳农业大学酶工程实验室保藏菌种。
聚乳酸(PLA)、聚乙烯醇(PVA)、明胶、司盘80、二氯甲烷(DCM)、乙醇(国药集团化学试剂有限公司);氢氧化钠、盐酸、氯化钠、牛肉膏、蛋白胨、酵母浸提粉。以上试剂均为分析纯。
2 方法
2.1 研究方法
2.1.1 纳米级蛹虫草的制备
以蛹虫草子实体为原料,高能纳米冲击磨为试验设备,研磨时间为5 h,粒径为0.606 μm,由吉林省蚕业科学研究院制得纳米级蛹虫草。
2.1.2 地衣芽孢杆菌的活化
菌液由地衣芽孢杆菌(BacilusLicheniformis)和无菌水组成。已灭菌完成的白金环蘸取少许配置好的菌液,在固体培养基上以划线法划线后密封,置于恒温培养箱中,调节温度至37℃倒扣活化1 d。
2.1.3 蛹虫草液体培养基的配制
取2.5%纳米级蛹虫草粉末,逐一添加到6个250 mL三角瓶中,以1%葡萄糖作为碳源和能源,再分别加入100 mL无菌水和少量灭菌后的搅拌玻璃珠均匀搅拌1 min,高压灭菌25 min,待冷却至室温后,即为制成的蛹虫草液体培养基。
2.1.4 纳米蛹虫草活性肽的制备
挑取3%接种量的菌至三角瓶液体培养基中,均匀搅拌,35 ℃,150 r/min条件下位于摇床中摇3 d,制备蛹虫草发酵液。再将发酵液于3 500 r/min离心10 min,超滤(N2,0.15 pa),收集5 000 Da下的溶液,真空冷冻干燥,即得纳米蛹虫草活性肽,以下简称蛹虫草肽。
2.1.5 蛹虫草肽明胶微囊的制备
取轻质液体石蜡15 mL,加入司盘80乳化剂150 μL(质量分数1%),即为油相。精准称取1 g明胶,加入5 mL蒸馏水,60 ℃水浴加热,制得质量分数为20%的明胶溶液,即为水相。油相∶水相的比例为3∶1。水相需在50 ℃水浴加热搅拌,滴加于油相中,乳化10 min后,改为冰浴。1 h后,滴加0.3 mL甲醛交联固化,复搅拌1 h,转移至小烧杯中4 ℃以下,固化1 d,最后采用适量异丙醇脱水,制得明胶固化球,先用乙醇再用石油醚洗涤两至三次,1 600 r/min离心3 min,真空冷冻干燥。即为干燥的明胶微囊。
包封率及载药率的计算:
取微囊4 mg加到5 mL容量瓶中,蒸馏水定容,在波长560 nm下,采用可见分光光度法测定吸光度并记录,根据考马斯亮蓝法制备标准曲线及检测肽含量。
包封率=(微囊中虫草肽含量/投入肽量)×100%
载药率=(药物的质量/明胶药物微囊的质量)×100%
2.1.6 蛹虫草肽乙基纤维素微囊的制备
将0.5 g乙基纤维素(壁材)与0.25 g蛹虫草活性肽(芯材)溶于50 mL纯水备用,将30 mL无水乙醇以2 mL/min的速率滴加到备液中,并以150 r/min的速率行搅拌,过滤悬浮液、25 ℃干燥,制得芯材/壁材分别为1:2的白色粉末状活性肽微囊。
1)活性肽包封率测定:将制备得到的微囊悬浮液离心分离后,在286 nm波长下测量上清液的吸光度,并通过标准曲线得到上清液中活性肽的含量。
活性肽包封率=1-悬浮液中游离活性肽/活性肽总量
2)载药率测定:称取一定量样品于干燥的试管中,加入10 mL无水乙醇,25 ℃下浸提20 min,于286 nm处测定浸提液中的吸光值,每个样品平行测定3 次,取平均值。根据标准曲线计算浸提液中的活性肽含量,即为包裏在微囊中的活性肽,从而计算出载药率。
载药率=微囊中活性肽质量/微囊质量。
2.1.7 蛹虫草活性肽聚乳酸(PLA)微囊的制备
将活性肽溶液加入一定浓度的PLA二氯甲烷溶液中,冰浴降温,在超声波的作用下乳化成白色乳状液后,立即滴入聚乙二醇外水相溶液中分散,并用磁力搅拌器在25 ℃下搅拌3 h,二氯甲烷完全挥发后,载药微囊分散液以5 000 r/min离心10 min,保留上清,沉淀下的微囊以去离子水冲洗3次,最后得到的微囊真空干燥,4 ℃贮藏。
聚乳酸微囊包封率的测定:

其中,A总为加入的活性肽总量,A游为上清中的活性肽含量。

2.2 检测方法
2.2.1 微囊的体外释药实验方法
采取动态膜透析法,将微囊倒入透析袋中,并加入10 mL PBS缓冲溶液,将透析袋系紧后放入盛有190 mL PBS缓冲溶液的烧杯中,25 ℃磁力搅拌。定时取出1 mL溶液,利用福林酚法测定多肽含量,并加入1 mL新鲜释放介质。

2.2.2 蛹虫草肽聚乳酸微囊胃内微环境降解过程体外模拟实验方法
1)人工胃液配制:取1 mol/L盐酸16.4 mL,加水约800 mL及胃蛋白酶10 g,搅匀后加水定容至1 000 mL即可。
2)体外模拟实验:采用动态膜透析法,取0.5 g微囊分别装于含有上述模拟胃液的透析袋中,磁力搅拌器上低速搅拌,胃液4 h后将微囊取出正置显微镜下观察,肠液24 h后观察。
2.2.3 蛹虫草肽聚乳酸微囊肠道内微环境降解过程体外模拟实验方法
1)人工肠液配制:取磷酸二氢钾6.8 g加水500 mL。用0.4%的氢氧化钠溶液调节pH至6.8;另取胰酶10 g加水适量使溶解,将两液混合后,加水定容至1 000 mL即可。
自1932年但采尔回德国至蔡元培病逝的8年间,两人虽未曾再谋面,但一直保持着频繁的书信交流,但采尔也成为蔡元培交往时间最长、感情最深的一名外国学者。
2)采用动态膜透析法,取0.5 g微囊分别装于含有上述模拟肠液的透析袋中,磁力搅拌器上低速搅拌,在模拟肠液中反应24 h将微囊取出正置显微镜下观察。
2.2.4 微囊的外部形态特征的观察方法
采用光学显微镜观察所制微囊悬浮液的整体形状及微囊的形态,将所制微囊悬浮液滴1滴到载玻片上,进行检测;采用Quanta 250型的扫描电镜观察微囊的表面形貌; 取少量微囊样本,加入蒸馏水,超生震荡使其粒子分散,再取少量样品溶液置于铜托上,用红外灯照射干燥,再进行样品检测。
2.2.5 红外光谱测试方法
在检测样品制备中,首先称取适量溴化钾以红外灯105 ℃干燥3 h,备用。以空气为参比,用溴化钾压片成空白片。取0.3 mg样品,复用红外灯105 ℃干燥3 h,加入溴化钾100 mg,在研钵中充分研磨,用压片机压制成片状。扫描范围在4 000-500 cm-1。
2.2.6 蛹虫草肽微囊稳定性试验
1)3种微囊的储存稳定性试验:将各种微囊放置于冷藏条件下(4 ℃)6个月后,各取100 mg检测肽含量减损情况。
2)蛹虫草活性肽微囊在人工胃液中稳定性试验:分别取100 mg 3种蛹虫草肽微囊并各自加入10 mL 人工胃液 (按2005年版中国药典配制)中,置37 ℃,120 r/min恒温振荡培养箱中于规定时间取出,10 000 ×g 离心,检测上清液及微囊中肽含量。同时以未处理的微囊为对照并设置其肽含量为100%。
2.2.7 三种微囊细胞毒性测定试验
在96孔板中,每孔接种200 μL细胞悬液。设置空白组(无细胞),对照组(有细胞)和试验组(有细胞),每组设3~5个复孔,在37 ℃的 CO2的培养箱中孵育过夜。次日吸弃培养液,加入200 μL各微囊,相应质量浓度设置1 mg·mL-1、2 mg·mL-1、3 mg·mL-1、4 mg·mL-1的无酚红DMEM完全培养液。在2 d后取出96孔板,每孔吸剔100 μL培养液,同时加入10 μL MTT(5mg·mL-1),37 ℃孵育4 h,吸掉上清,每孔加入100 μL DMSO,震荡混匀至沉淀完全溶解,用酶标仪在570 nm测定各孔的吸光值。
3 结果与分析
3.1 乳化交联法制备蛹虫草肽明胶载药微囊
3.1.1 明胶胶囊的形态观察及性能测试
如图1A所示,在显微镜下明胶微囊光镜检测为纯白色。从图1B电镜检测所示微囊表面平滑,微囊中央部位不透光,但黑色囊心物,边缘处呈半透光。实验条件下包封率为50.84%,载药量为23%。

1A 明胶微囊的光镜检测 1B 明胶微囊的扫面电镜检测 1C 明胶微囊红外光谱检测图1 蛹虫草肽的明胶微囊
3.1.2 明胶微囊的释药性能
采用2.2.1的方法,发现明胶微囊在48 h内累积释药量可达到48%。
3.2 采用油相分离法制备乙基纤维素蛹虫草活性肽胶囊
3.2.1 乙基纤维素胶囊的形态观察及性能测试
如图2B所示,乙基纤维素胶囊呈表面光滑、分散均匀的球形粒子(粒径大约为200 nm~1 μm),少量微囊有黑色囊心。如图2C所示,2 965 cm-1与2 884 cm-1这两处的吸收峰均为乙基纤维素-CH键的伸缩振动特征峰,表明包埋成功。在该试验条件下,包封率为83%,载药量为21%。
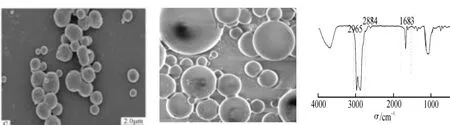
2A 乙基纤维素胶囊的光镜检测 2B 乙基纤维素胶囊的扫描电镜 2C 乙基纤维素胶囊的红外光谱图2 蛹虫草肽的乙基纤维素微囊
3.2.2 乙基纤维素微囊的释药性能
采用2.2.1的方法,发现乙基纤维素微囊释药量变化在36 h内释药率达到28%,然而随即开始下降至48 h的20%。
3.3 复相乳液法制备蛹虫草肽聚乳酸载药微囊
3.3.1 聚乳酸微囊的形态观察及包封率和载药量检测
如图3中所示,复相乳液法制备的蛹虫草肽聚乳酸微囊冻干粉呈白色,在显微镜下为球状,无黑色囊心。在该试验条件下,包封率为79.2%,成球率为86.90%,载药量为58%。
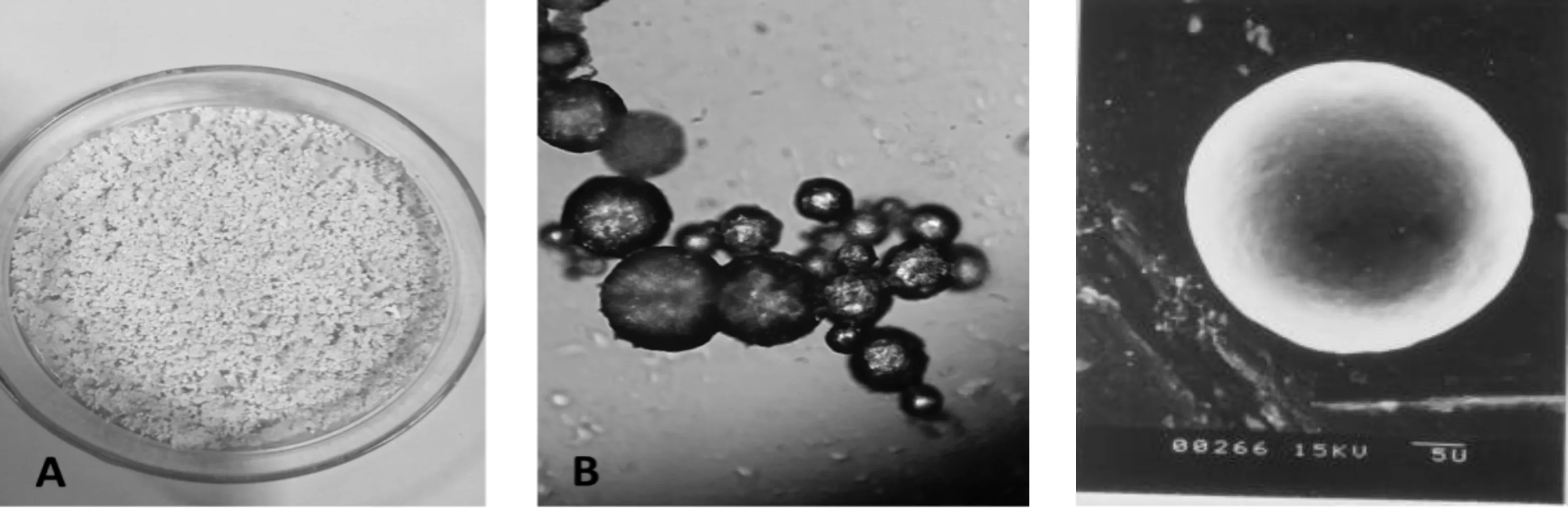
3A 聚乳酸微囊冻干粉 3B聚乳酸微囊显微镜观察 3C 聚乳酸微囊的扫描电镜观察图3 蛹虫草肽的聚乳酸微囊
3.3.2 聚乳酸微囊的释药性能
采用2.2.1的方法,发现聚乳酸微囊释药量在48 h内呈递增趋势且最大峰值为67%。图4为释药前聚乳酸微囊,其外表圆润充裕且无裂缝但释药中却发现有缝隙出现。药物释出一般通过表面蚀解、整体崩解等方式表达,其缓释过程如下图5所示。
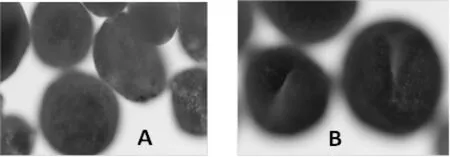
A 释药前 B 释药过程中图4 显微镜下蛹虫草肽释药聚乳酸微囊体外释药状态观察

蛹虫草聚乳酸微囊 表面蚀解 整体崩解的过程图5 蛹虫草肽的聚乳酸微囊缓释过程
3.3.3 响应面法优化蛹虫草肽聚乳酸微囊制备工艺
因素水平表,见表1。响应面分析参数见表2,响应面图分析四个提取因素对蛹虫草肽包埋率的影响见图6。
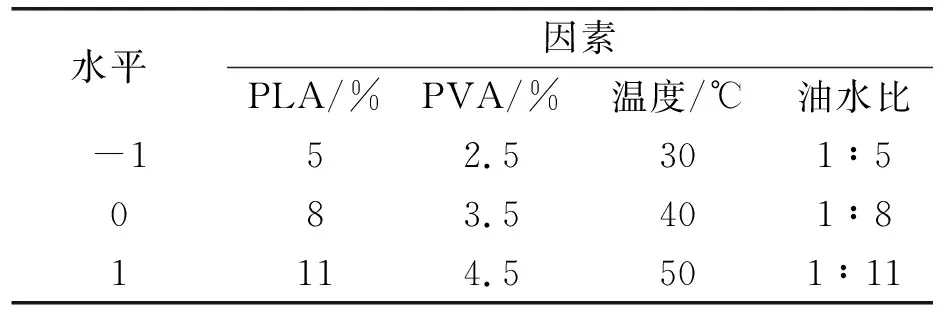
表1 因素水平表
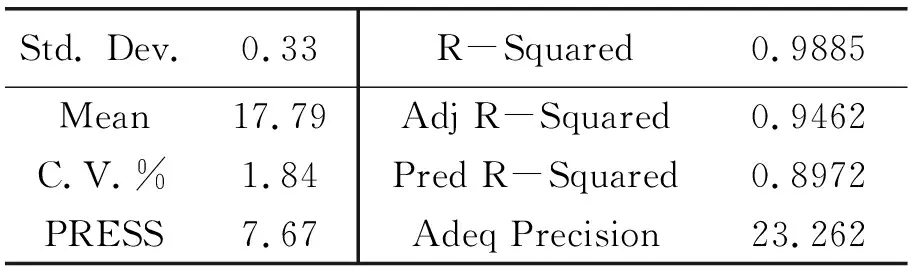
表2 响应面分析参数
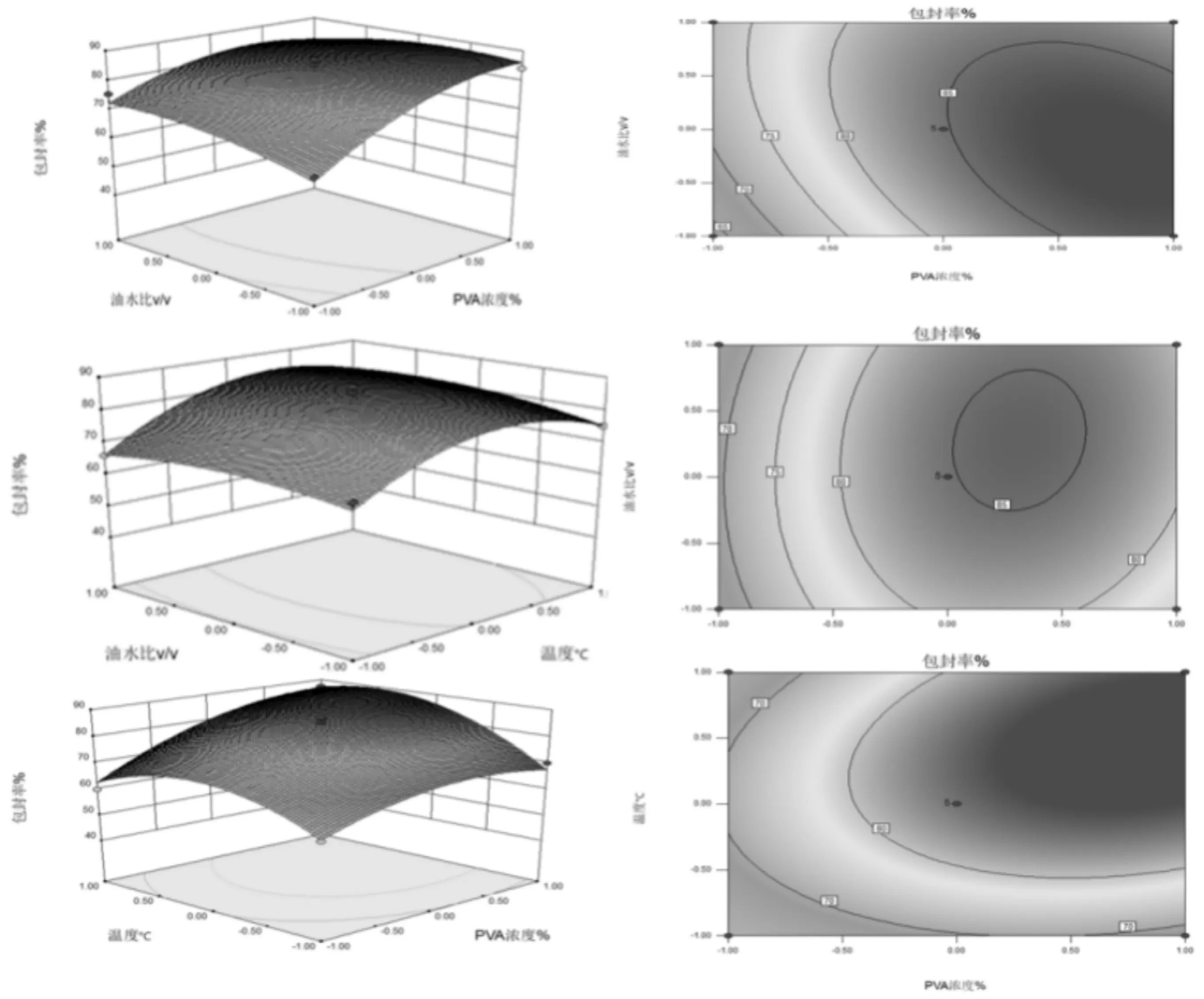
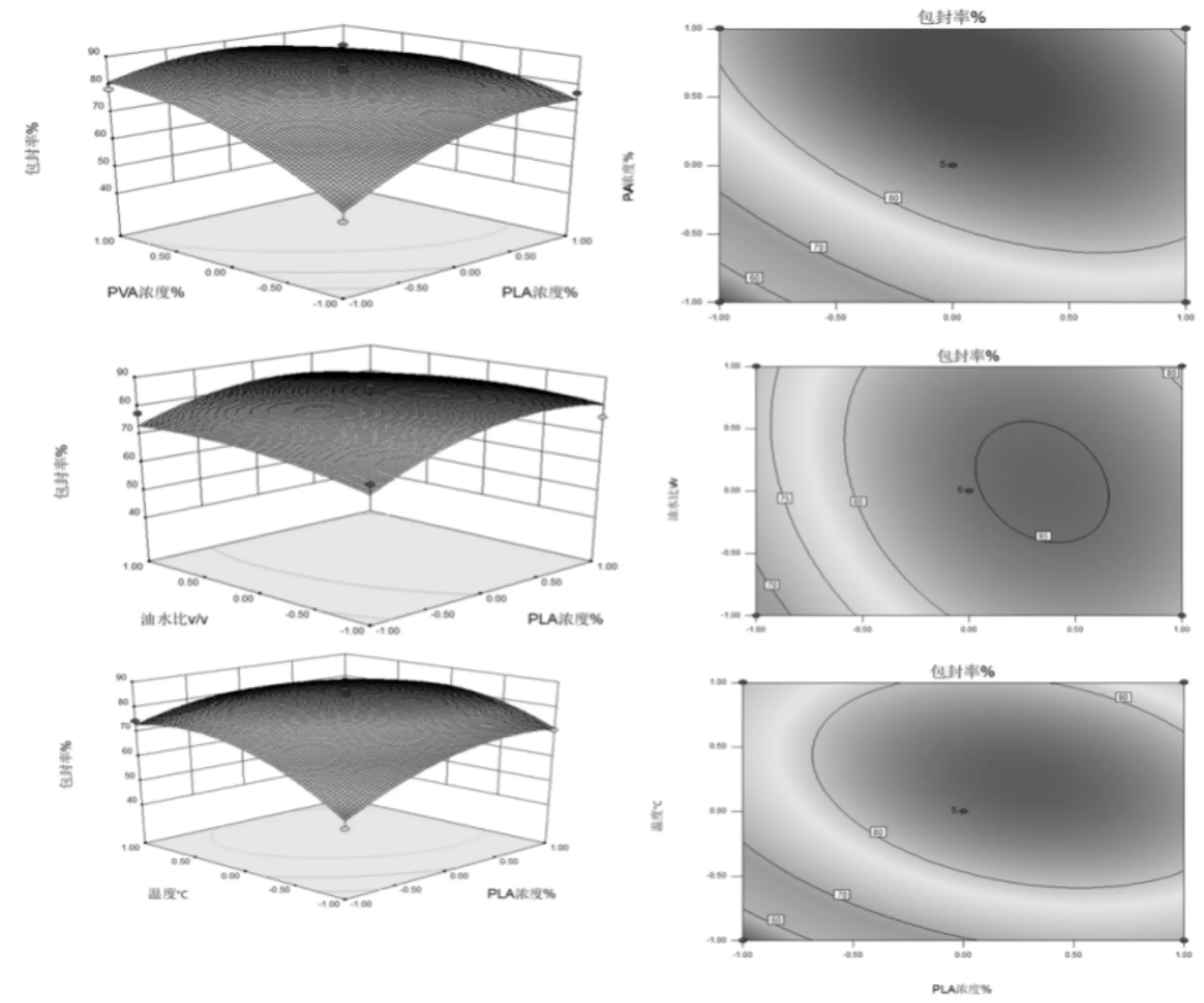
图6 响应面图分析四个提取因素对蛹虫草肽包埋率的影响
方差分析表明:决定系数(R2=0.9328),仅有0.7%的总变量在模型中没能解释,矫正决定系数(Adj.R2=0.8658)说明模型有1.35%的变异,能够比较真实地反应试验结果。变异系数值(C.V.%)仅为1.84,更加清晰的证明实验值的高度精确和可靠。可以采用回归模型对响应值进行预测。
利用Design Expert对上表的数据进行二次多项式拟合,建立蛹虫草肽包封率与PLA质量分数(A)、PVA质量分数(B)、温度(C)油水比(D)的回归方程为:
包封率(%)=84.76+4.91A+8.03B+5.64C+1.15D-5.92AB-4.18AC-2.13AD+4.00BC-3.27BD+1.45CD-6.94A2-5.88B2-9.67C2-2.88D2。
该模型的F值为13.88,相对于的P值小于0.000 1,说明该模型极显著,同时失拟项P值为0.253 5 >0.05,失拟不显著,说明所选用的二次回归模型是合适的,并且各因素对包封率影响程度大小依次是PVA质量分数>温度>PLA质量分数>油水比。
由该模型得到的最佳条件为包封率87.2%,PVA质量分数为3.56%,温度为40.8℃,PLA质量分数为8.11%,油水比为1∶8。在此条件下重复进行3次试验,得到包封率为87.2%±0.02%,进一步证明该模型合理。
3.4 PLA微囊粒径及形态观察
PLA微囊的扫描电镜结果如图7所示,不难看出聚乳酸微囊错落有致地均匀分布在扫面电镜下,平均粒径为50.4 μm。
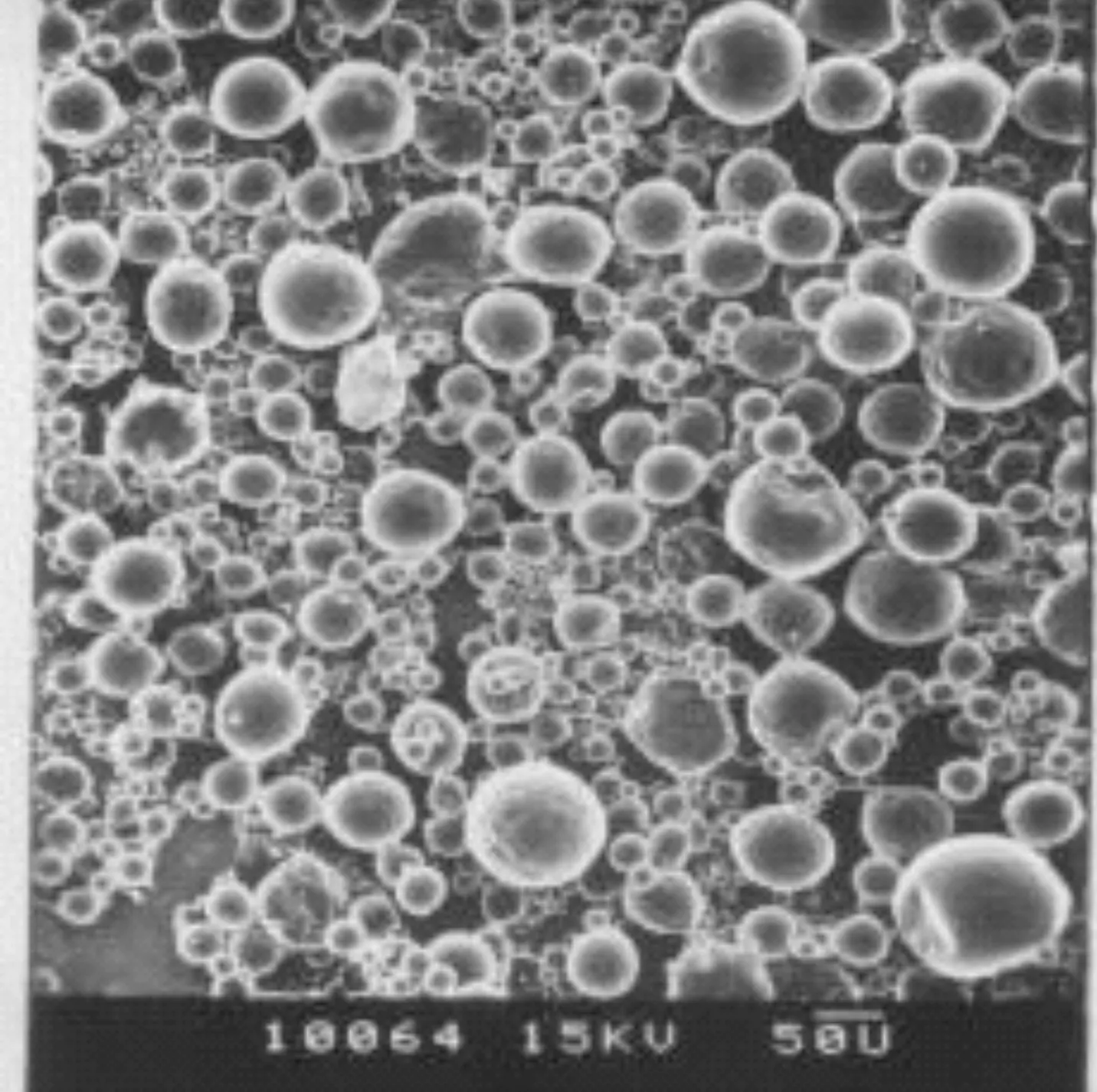
图7 PLA 微囊的扫描电镜结果
3.5 蛹虫草肽聚乳酸微囊制备工艺优化后的红外光谱及扫描电镜检测
从图8A中可判断出甲基的伸缩振动峰和弯曲振动分别发生在2 948 cm-1和1 458 cm-1,该红外数据说明成功制备了聚乳酸微囊,且在制备过程中未发生其他化学变化。从扫描电镜的结果图8B可以看出,聚乳酸微囊外形椭圆,表面光滑,包封率良好,符合微囊要求。
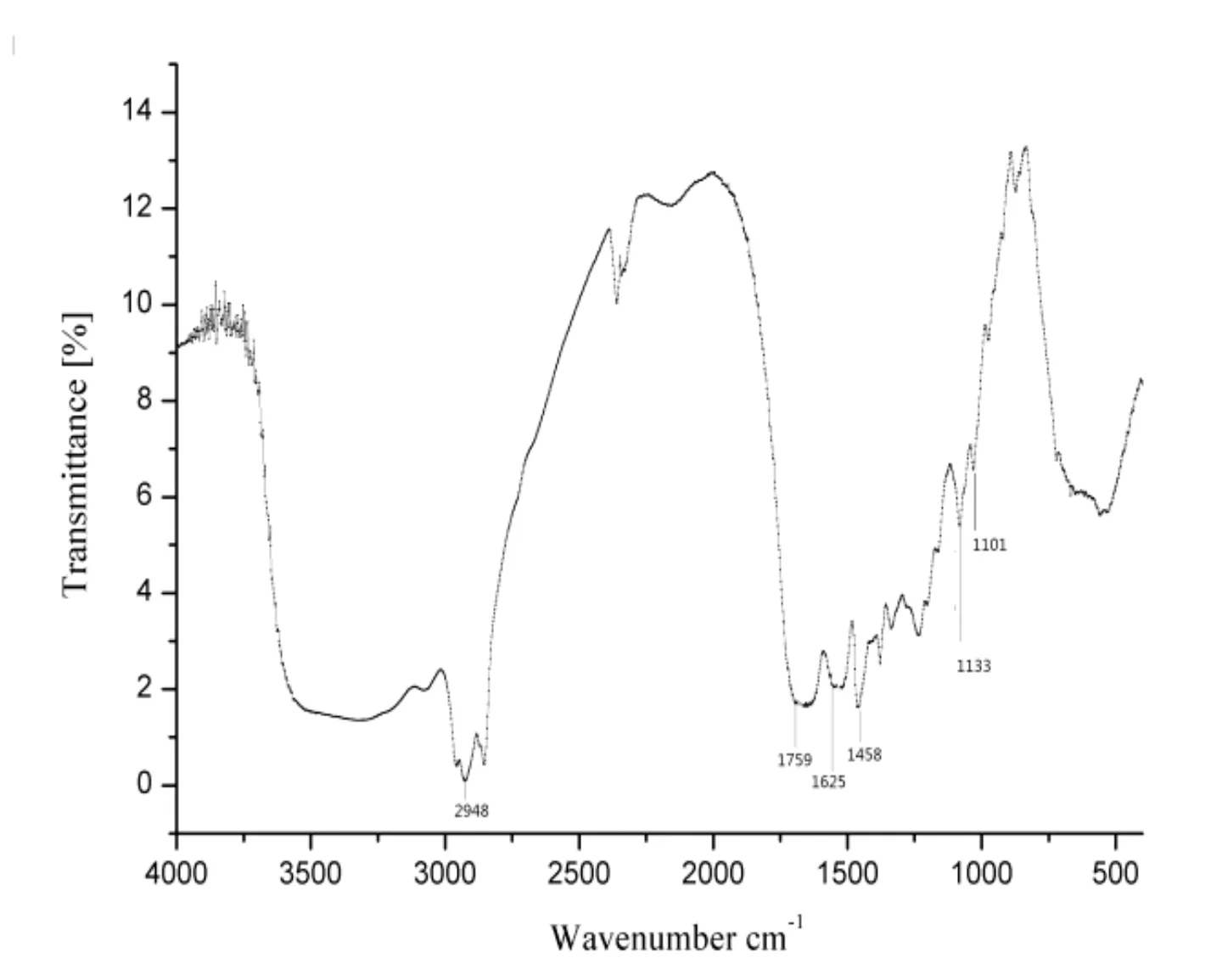
8A聚乳酸微囊的红外光谱图
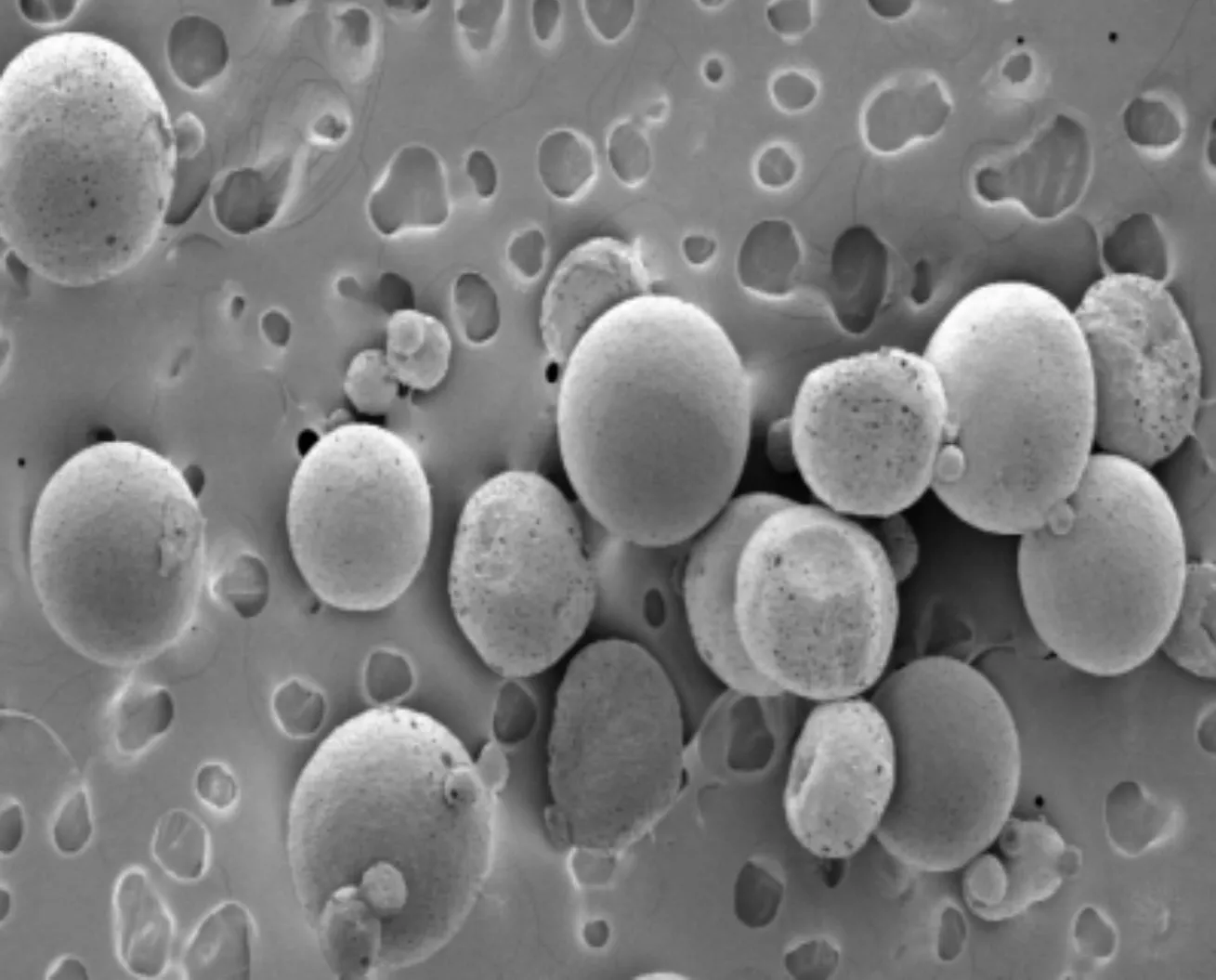
8B 聚乳酸微囊的扫描电镜图图8 蛹虫草肽聚乳酸微囊红外光谱及扫描电镜图
3.6 聚乳酸蛹虫草肽微囊体外降血糖活性检测
3T3-L1脂肪细胞是否分化完全主要从细胞形态与油红O染色两个方面来进行观察。如图9A所示,未分化的3T3-L1前脂肪呈现为纤维状、不规则梭型,用油红O染色后发现细胞内没有脂肪滴。随着诱导时间的增加,在12 d时,细胞逐渐变为椭圆,在倒置显微镜下可以观察到,大约90%以上的细胞均诱导成为脂肪细胞(图9B),3T3-L1脂肪细胞胰岛素抵抗模型稳定性试验显示, 在48 h后加入1 mmol/L的DEX和3 mmol/L的DEX胰岛素均出现了较为明显的变化。由图9C可以看出,在40 h后3 mmol/L的DEX胰岛素抵抗效果要优于1 mmol/L的DEX抵抗效果,可以用于构建胰岛素抵抗模型并进行下一步试验。
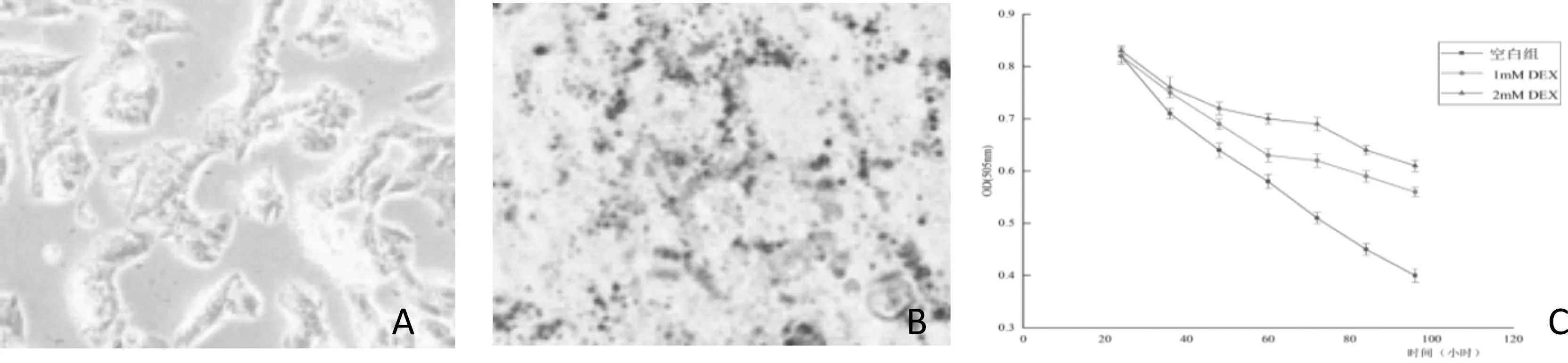
9A 未分化的脂肪细胞 9B 分化12 d的脂肪细胞 9C 胰岛素抵抗模型的建立图9 建立3T3-L1脂肪细胞胰岛素抵抗模型
本研究采用包埋好的3种蛹虫草肽微囊,利用3T3-L1脂肪细胞胰岛素抵抗模型进行降血糖活性检测试验,试验结果见图10。图中显示,对照组与正常组比较,葡萄糖消耗量下降极显著,阳性组对葡萄糖的利用率显著提高。但乙基纤维素微囊组对葡萄糖的利用率与对照组差异不显著,明胶微囊组与对照组相比,差异稍显著,而聚乳酸微囊组与对照组比较,差异极显著。以上结果说明3种处理中,聚乳酸微囊制备过程中对蛹虫草肽活性具有保护作用,而其他2种处理由于化学试剂的使用可能降低了蛹虫草肽活性。

图10 蛹虫草肽细胞水平上的体外降血糖活性检测
3.7 蛹虫草活性肽微囊稳定性
3.7.1 3种微囊的储存稳定性
将各种微囊放置于冷藏条件下(4 ℃)6个月后,各取100 mg检测肽含量减损,各种微囊肽含量未发生流失,说明冷藏条件下各种活性肽微囊很稳定。
3.7.2 蛹虫草活性肽微囊在人工胃液中的稳定性
采用2.2.6中的方法,发现将各微囊制剂置于人工胃液3 h后,聚乳酸微囊的肽含量为100%,乙基纤维素微囊的肽含量为75%,明胶微囊含量为70%。可见,聚乳酸微囊具有较好的抗胃酸及胃蛋白酶稳定性。
3.8 3种微囊细胞毒性试验
细胞毒性检测结果如图11所示。左图为24 h各样品的处理结果,其中1、2、3、4 为乙基纤维素微囊在4个不同质量浓度下对细胞毒性的影响,5、6、7、8为聚乳酸微囊在4个不同质量浓度下对细胞毒性的影响,9、10、11、12 为明胶微囊在4个不同质量浓度下对细胞毒性的影响。从左图结果可以看出,在乙基纤维素及明胶微囊制剂作用下,细胞生存能力与对照组不存在显著差异,说明二者不抑制细胞生长,无细胞毒性,而聚乳酸微囊肽处理则对细胞生长能力略有促进(P<0.01),推测与聚乳酸微囊载药量较大及释放量较高有关。右图为48 h各样品的处理结果,显示各处理与对照相比较其细胞生存能力无明显差异。可见,各种微囊对细胞无毒性。
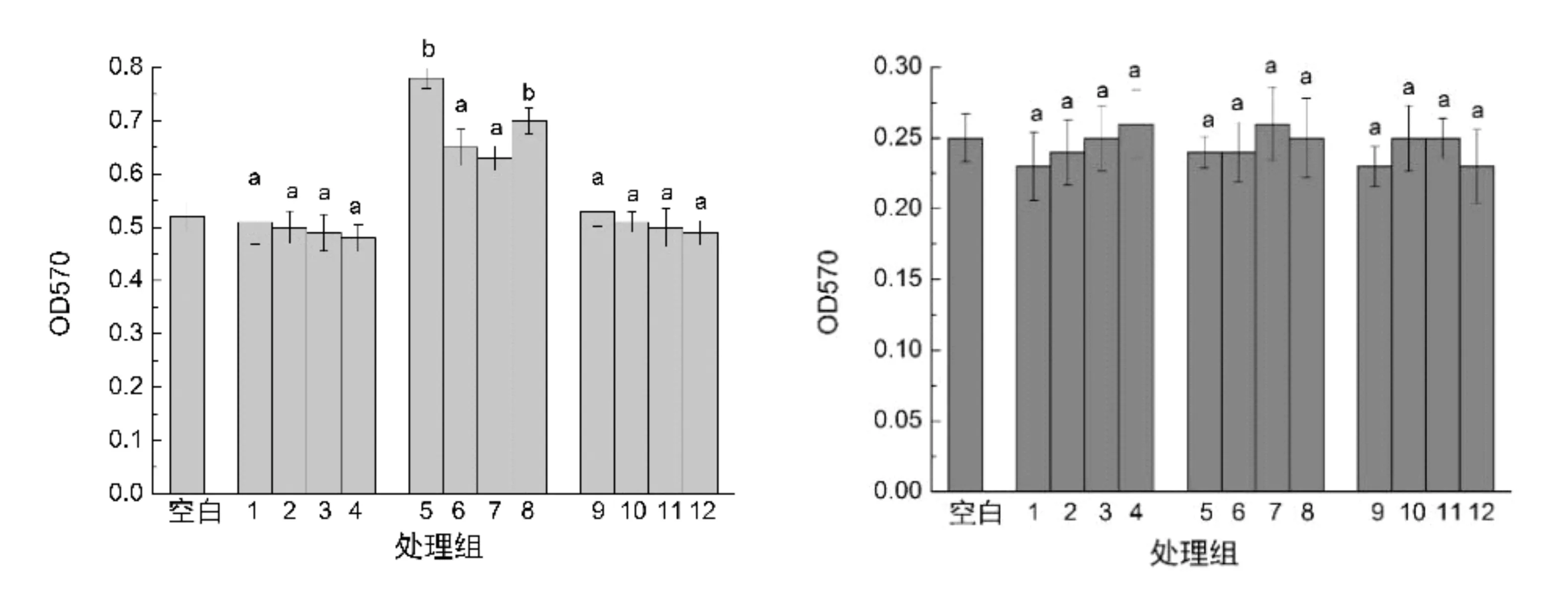
图11 MTT细胞毒性检测结果
4 结 论
本研究分别以药用明胶、乙基纤维素及聚乳酸为囊材制备蛹虫草肽微囊,并对其性能及生物学效应进行了检测。研究结果表明,从包封率、载药量及48 h的释药量三个主要指标比较,聚乳酸微囊的性能最优。
本项研究在筛选了载肽微囊不同囊材的基础上,获得且优化了蛹虫草肽聚乳酸微囊的制备工艺。由该模型得到的最佳条件为包封率87.2%,PVA质量分数为3.56%,温度为40.8 ℃,PLA质量分数为8.11%,油水比为1:8。在此条件下重复进行3次试验,得到包封率为87.2%±0.02%。
在此工艺条件下,蛹虫草肽聚乳酸微囊具备如下性能。一是靶向性。体外释药过程研究表明,在含有胃蛋白酶的酸性环境中,聚乳酸微囊未被水解,而在含有胰蛋白酶的碱性环境中,聚乳酸微囊裂解并释放蛹虫草肽,证明聚乳酸微囊具有明显的靶向性。二是控释性。聚乳酸微囊作为药物载体具有良好的缓控释性能。蛹虫草肽微囊稳定性研究的结果,冷藏条件下各种蛹虫草肽微囊很稳定;蛹虫草肽微囊在人工胃液中稳定性,聚乳酸微囊具有较好的的抗胃酸及胃蛋白酶稳定性。
本研究以明胶、乙基纤维素、聚乳酸(PLA)为囊材制备的3种纳米蛹虫草活性肽微囊经试验验证,对细胞无毒性。
