外泌体miR-217通过下调E-cadherin对宫颈癌Siha细胞 淋巴管新生的影响
2021-07-13康佳文郭思慧李乐赛
匡 婷,康佳文 ,郭思慧,李乐赛,张 勇
(1.湖南省肿瘤医院/中南大学湘雅医学院附属肿瘤医院,长沙 410013;2.湖南师范大学医学院,长沙 410013)
根据2018年全球癌症统计,宫颈癌是女性生殖道排名第一的恶性肿瘤[1],淋巴结转移阳性的患者预后差[2-4]。外泌体是细胞主动分泌的囊泡样小体,能自由经过淋巴管运输通道,可通过携带调节肿瘤转移的miRNAs,促进肿瘤淋巴结转移[5,6]。在本研究中,我们对宫颈癌淋巴结组织标本进行miRNAs的筛选及验证,探索外泌体携带的miRNA-217影响宫颈癌淋巴转移的作用及机制。
1 材料与方法
1.1 组织标本收集与检测患者签署知情同意书,根据术后病理结果选取淋巴结组织标本,淋巴结阳性(LN+)患者3例,淋巴结阴性(LN-)患者3例。RTqPCR 检测淋巴结组织中miR-217,miR-9-5p和miR-338-3p含量。
1.2 RT-qPCR 检测miRNA 表达Trizol法提取淋巴结组织总RNA,反转录为cDNA,实时荧光定量PCR两步法试剂盒进行检测。反应条件:95 ℃,10 min;95 ℃,15 s;60 ℃,50 s,40个循环。以GAPDH作为参照,测定miR-217、miR-9-5p 和miR-338-3p基因水平,采用2-ΔΔCt法检测各样品基因的相对表达水平。引物交由上海生物工程有限公司合成,引物序列见表1。
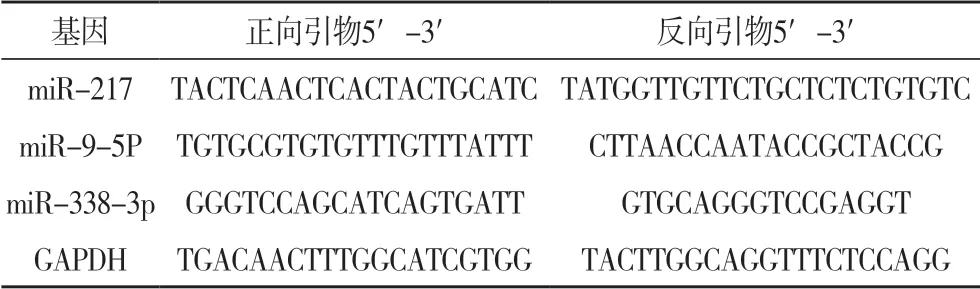
表1 qRT-PCR引物序列
1.3 细胞培养、转染及分组Siha细胞为本室保存,人淋巴内皮细胞(HLEC)购自德国海德尔堡PromoCell公司。细胞复苏后用含10%胎牛血清、1%青霉素和链霉素的RPMI1640培养。用lenti-mCherry/miR-217转染Siha细胞。细胞实验分组为:空白组(Siha 细胞)、阴性对照组(Siha 细胞慢病毒空载组,LV-NC)、阳性实验组(Siha细胞慢病毒miR-217 沉默组,LV-miR-217-siRNA)。收集各组细胞外泌体进行后续实验。
1.4 细胞外泌体的提取及鉴定依据试剂盒(ExoQuick-TC)说明书提取宫颈癌Siha细胞分泌的外泌体,电镜观察形态,加蛋白裂解液提取蛋白,使用Hsc70,CD63 和CD81 抗体,进行流式细胞学蛋白检测鉴定外泌体。
1.5 Transwell实验检测细胞侵袭能力用胰酶消化收集转染48h后的Siha细胞并计数,制成细胞密度为5×104单细胞悬浮液,三组不同细胞外泌体与细胞混和后,分别接种至Transwell小室中,置于细胞培养箱进行培养。48 h后,PBS洗3次,4%多聚甲醛固定30 min,0.1%结晶紫溶液染色,用棉签擦掉小室的下层细胞,显微镜观察并拍照,每组实验重复3次。
1.6 Western blot检测蛋白表达收集经三组不同细胞外泌体处理的人淋巴管内皮细胞(HLECs),提取三组细胞蛋白,加入蛋白上样缓冲液(5×),变性后,SDSPAGE凝胶电泳,转膜并封闭,一抗(E-cad 1:1000,GAPDH 1:5000)、二抗(1:10000),ECL试剂和显影仪图像采集。用Image J 软件测定光密度值分析E-Cadherin等蛋白相对表达量。
1.7 小管形成能力检测将分装的Matrigel胶在冰上用培基以1:3比例稀释后以200μL/孔平铺于24孔板内,放置在37℃、5%CO2培养箱中30 min后备用;HLECs制成细胞悬液,取三组含不同外泌体的细胞与培基混和,以1×105细胞/孔将细胞铺于胶表面,然后继续于培箱中培养6h,取出24孔板于显微镜下观察HLECs成管情况并计数、拍照。每组设置3个复孔。
1.8 统计学方法采用SPSS 16.0对数据进行统计学分析,计量资料以均数±标准差表示,两组间采用独立t检验,多组间采用多因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 生物信息学寻找和预测E-Cad(CDH1)上游miRNAs通过检索生物信息学网站TargetScan(www.targetscan.org)和miRcode(www.mircode.org),发现了miR-217,miR-9-5p 和miR-338-3p可能是E-cad的上游microRNA。结果见图1。
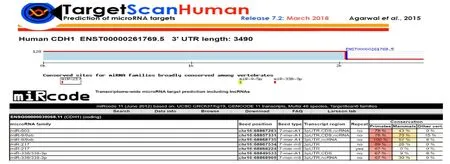
图1 软件预测E-cad(CDH1)上游miRNA
2.2 RT-qPCR 检测淋巴结组织中miR-217,miR-9-5p 和miR-338-3p 含量图2可见,LN+组的miR-9-5p 表达为6.2±1.2、miR-217表达为5.7±0.8、miR-338-3p 表达为3.5±1.1分别明显高于与LN-组的 2.1±0.7、1.5±0.8、1.7±0.8(P<0.05)。发现miR-217 表达差异最大(见图2)。
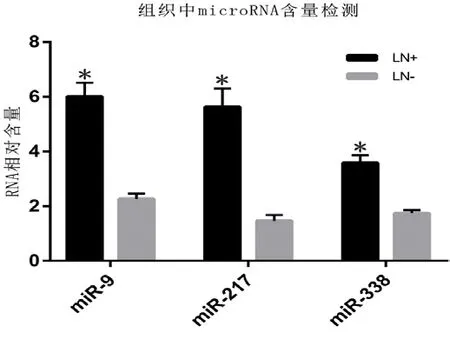
图2 淋巴结组织中miRNA 表达情况
2.3 外泌体miR-217对Siha细胞侵袭能力的影响通过Transwell小室法检测各组细胞外泌体对Siha 细胞侵袭能力的影响。通过对穿过小室滤过膜的穿膜细胞进行拍照和计数,发现外泌体miR-217 表达下调的Siha 细胞侵袭能力较其他两组明显下降。空白组、阴性对照组及LV-miR-217-siRNA 组通过对小室滤过膜上的穿膜细胞细胞数量分别为328±43,369 ±62 和 139±16,LV-miR-217-siRNA 组的穿膜细胞数在三组中最少,差异有统计学意义(P<0.05),提示外泌体miR-217 表达下调的Siha 细胞侵袭力明显减弱(见图3)。
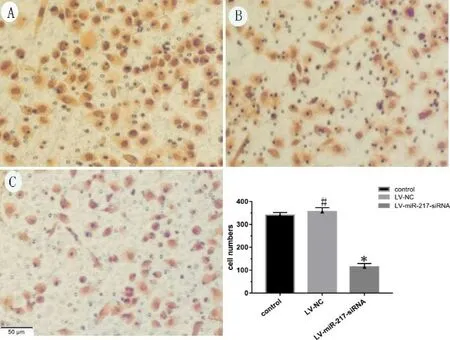
图3 Transwell 实验检测各处理组细胞侵袭情况(结晶紫染色,×400 光学显 微镜)及统计
2.4 外泌体miR-217对淋巴管新生的诱导影响检测三组细胞外泌体对人淋巴内皮细胞(HLECs)小管形成的影响。空白组、阴性对照组及LV-miR-217-siRNA 组细胞成管数量分别为43149 ± 401.3,44377 ± 284.4和 22144 ± 448.2。LV-miR-217-siRNA 组的细胞成管数量最少,差异具有统计学意义(P<0.05),提示外泌体miR-217 表达下调会显著降低HLECs成管能力。结果见图4。
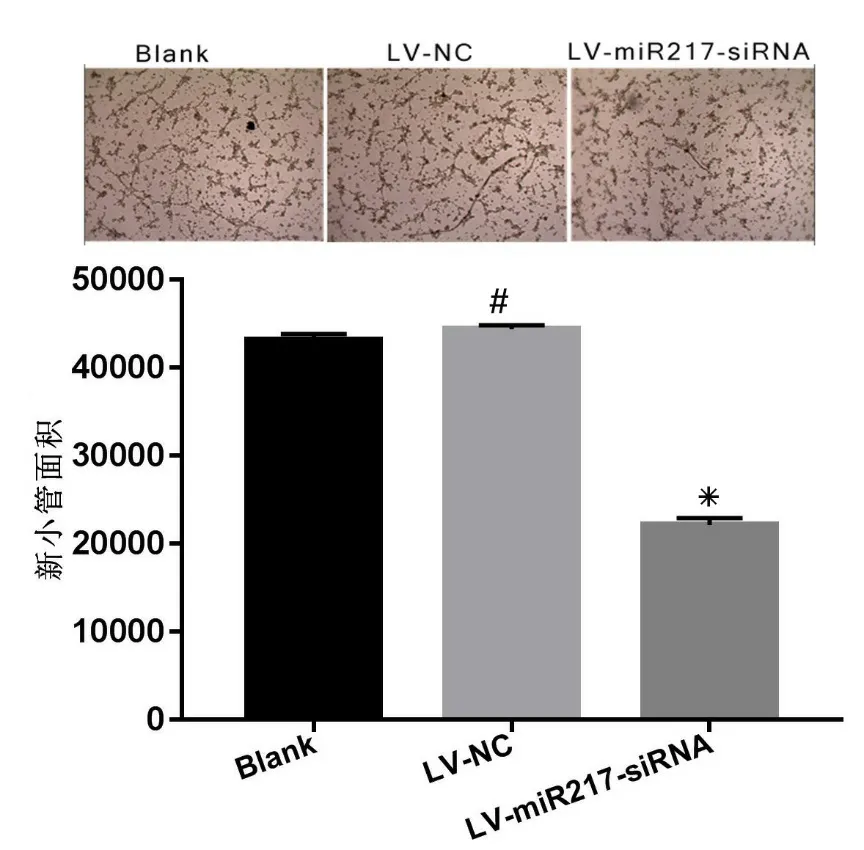
图4 检测各组细胞外泌体对人淋巴内皮细胞(HLEC)小管形成的影响及统计
2.5 外泌体miR-217对淋巴内皮细胞中E-cad表达水平的影响WB检测外泌体miR-217对人淋巴内皮细胞(HLECs)E-Cad表达的影响:三组细胞外泌体与HLECs共孵育48h,收集三组细胞并提取蛋白,WB检测E-Cadherin表达。空白组、阴性对照组及LV-miR-217-siRNA 组E-Cadherin蛋白表达分别为0.5619±0.0033,0.561±0.0047和0.6078±0.0016。发现:LVmiR-217-siRNA 组E-Cadherin 表达明显强于其它组,这提示外泌体miR-217 对淋巴内皮细胞E-Cadherin 蛋白表达是抑制的(见图5)。
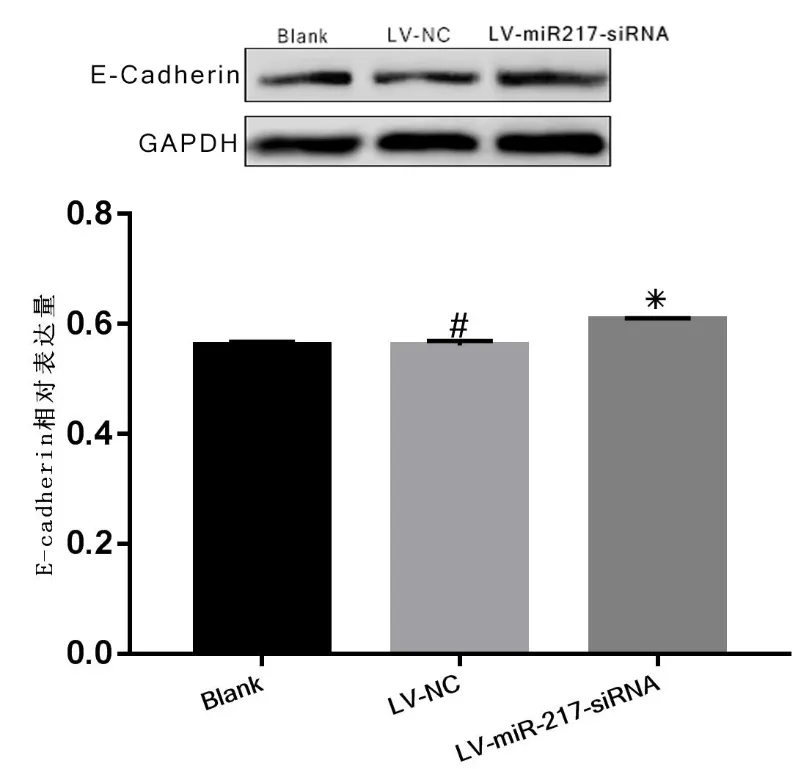
图5 外泌体miR-217 对淋巴内皮细胞E-Cadherin 表达影响
3 讨论
淋巴转移是宫颈癌主要的转移方式,但机制尚不明确。E-cad是上皮组织中细胞间粘附的关键介质,我们前期已证实E-cad在宫颈鳞癌组织中的表达低于正常宫颈组织[5],宫颈癌细胞的粘附功能降低,侵袭力和迁移能力增加[7]。我们通过生物信息学检索发现了miR-217,miR-9-5p 和miR-338-3p 可能是E-cad的上游miRNA,在阳性淋巴结中,miR-217,miR-9-5p 和miR-338-3p表达明显高于淋巴结阴性组,且miR-217表达差异最大[8-10]。miR-217是否通过E-cad调节宫颈癌转移无报道。
外泌体是细胞主动分泌的大小均一、直径30~150nm 的囊泡样小体,可携带包含miRNA在内的多种物质[11],参与调节人体生理或病理过程。肿瘤来源的外泌体可以通过参与肿瘤转移前微环境的形成,促进肿瘤发生转移[12]。本研究发现,宫颈癌Siha细胞分泌的外泌体miR-217对癌细胞的侵袭能力有影响,外泌体miR-217-siRNA可降低Siha 细胞的侵袭能力,能促进Siha细胞侵袭转移。实验中发现LVmiR- 217-siRNA 组的细胞成管数量最少,证明外泌体miR-217表达下调会显著降低HLECs成管能力。原发肿瘤周围新生的淋巴管可将肿瘤细胞及其他生物分子快速输送至区域淋巴结,最后造成淋巴结转移。我们的研究提示宫颈癌Siha细胞外泌体携带的miR-217能促进淋巴内皮细胞的成管能力。Western blot检测发现外泌体miR-217 抑制HLECs E-Cad蛋白表达。
综上,我们的研究表明,癌源性外泌体miR-217能促进宫颈癌Siha细胞淋巴管新生,其机制可能是通过miR-217抑制人淋巴内皮细胞E-Cad蛋白的表达实现的。这对于揭示癌源性外泌体在宫颈癌淋巴转移中的作用,了解宫颈癌的淋巴转移机制有重要意义,也为干预和治疗宫颈癌淋巴转移提供了新思路。
