18F-FDG PET/CT评估贝伐珠单抗联合化疗治疗晚期非小细胞肺癌的疗效研究
2021-06-28恩施土家族苗族自治州中心医院呼吸与危重症医学科湖北恩施445000
1.恩施土家族苗族自治州中心医院呼吸与危重症医学科 (湖北 恩施 445000)
2.恩施土家族苗族自治州中心医院影像科(湖北 恩施 445000)
3.恩施土家族苗族自治州中心医院肿瘤科(湖北 恩施 445000)
张明华1 税明明2,* 陈 山3覃大明2 幸梦飞3
非小细胞肺癌(non-small cell lung cancer,NSCLC)是世界范围内肺癌最常见的组织学类型,占比约80%~85%,可进一步分为鳞癌、腺癌和大细胞癌等多种亚型[1]。根据国际抗癌联盟/美国癌症联合委员会(union for international cancer control/american joint committee on cancer,UICC/AJCC)制定的第7版肺癌TNM分期系统,早期肺癌生长缓慢且扩散或转移相对较晚可选择根治性手术切除,但我国约70%患者确诊时已进展至晚期或因基础健康状态较差等原因而失去手术机会,导致患者5年生存率较低[2-3]。以铂类为基础的联合化疗是晚期NSCLC标准一线治疗方案,近年来随着对肺癌分子生物学机制认识不断加深,以血管内皮生长因子(vascular endothelial growth factor,VEGF)等为靶点的靶向治疗取得明显突破,但目前尚缺少准确灵敏的疗效评价方法[4]。PET/CT是兼有形态学和功能学特征的影像学检查方法,目前通常以18F-FDG为显像剂,在肺癌等恶性肿瘤诊断、治疗和预后评估中均具有较高价值[5]。本文主要研究18F-FDG PET/CT在评估贝伐珠单抗联合化疗治疗晚期NSCLC疗效中的应用情况和价值,现将结果报道如下。
1 资料与方法
1.1 一般资料选取2014年3月至2016年3月我院晚期NSCLC患者81例,其中男性46例,女性35例,年龄42~78岁,平均年龄(61.07±9.36)岁,临床分期Ⅲb期53例、Ⅳ期28例。
纳入标准:经病理检查结果证实为NSCLC;TNM分期Ⅲb~Ⅳ期;年龄<80岁;此前未接受抗肿瘤治疗;预计生存时间>3个月;治疗前及治疗第1和第2个周期后1周内完成18F-FDG PET/CT检查;患者及家属知晓本研究并签署同意书。
排除标准:伴严重系统性疾病;伴肺部其它病变;伴其它恶性肿瘤;伴化疗、贝伐珠单抗相关禁忌症或无法配合完成18F-FDG PET/CT检查。
1.2 方法
1.2.1 治疗方案 81例患者中47例采用GP方案,即吉西他滨(GEMZ)1250mg/m2第1天和第8天用药+顺铂(DDP)75mg/m2第1天用药;26例采用GC方案,即GEMZ1250mg/m2第1天和第8天用药+卡铂(CBP)浓度-时间曲线下面积(AUC)=5,第1天用药;另有8例患者采用DP方案即多西他赛(DTX)75m2第1天用药+DDP75mg/m2第1天用药,三种方案均以21天为一个周期。所有患者均给予贝伐珠单抗15mg/kg+0.9%生理盐水100m于每个化疗周期第1天静脉滴注,输注时间首次90min,第2次为60min,其余均为30min,随访两组治疗后3年时患者生存情况。
1.2.218F-FDG PET/CT检查 分别于两组治疗前及治疗第1和第2个周期后1周内采用Discovery STE 16排PET/CT进行和高分辨率胸部CT扫描,PET/CT检查前静脉注射18F-FDG 0.12~0.15mCi/kg,然后饮纯净水800~1000mL并休息60min左右,上机前再饮用纯净水500mL充盈胃肠道,扫描范围为颅顶至股骨上段的6~8个床位,PET应用3D模式采集数据,层厚3.75mm,矩阵128×128,每个床位时间为3min,CT扫描参数设置为管电压120kV,电流200mA,螺旋时间0.8s,矩阵512×512。扫描完成后由经验丰富的影像科医师处理并分析PET、CT及PET/CT图像,PET图像经衰减校正处理后利用CT图像选取病灶最大横截面画肿瘤边缘并在浓聚部位根据病灶形状选择感兴趣区域(ROI)计算最高标准化摄取值(SUVmax)=病灶放射浓度/(注射剂量×体质量)。
1.2.3 疗效评估 根据RECIST 1.1中标准[6]评估CT疗效,其中以病灶完全消失、淋巴结<10mm为完全缓解(CR),病灶长径减小>30为部分缓解(PR),以病灶直径治疗前后无明显变化为疾病稳定(SD),所有病灶直径增加之和>20%或出现新病灶为进展(PD),客观有效率=(CR例数+PR例数)/总例数;根据欧洲癌症研究和治疗组织(EORTC)标准[7]评估PET/CT治疗效果,以病灶18F-FDG摄取与血池本底相当为完全代谢缓解(CMR),以病灶18F-FDG峰值减少≥30%为部分代谢缓解(PMR),以病灶18F-FDG峰值增加>30%或摄取范围肉眼可见扩大或出现具有肿瘤影像的高摄取新病灶为代谢进展(PMD),以除外以上标准者为代谢稳定(SMD),代谢有效率=(CMR例数+PMR例数)/总例数×100%。
1.3 统计学方法计数资料采用率(%)形式表示,组间比较采用χ2检验,配对比较采用McNemar检验,采用一致性Kappa检验分析CT和PET/CT对NSCLC早期疗效诊断价值,采用Kaplan-Meier曲线和Log Rank法分析两组患者综合治疗后生存情况,数据分析使用SPSS 19.0软件,检验水准为α=0.05。
2 结 果
2.1 治疗第1个周期时PET/CT和CT检查结果比较治疗第1个周期时,PET/CT检查显示81例晚期NSCLC患者中CMR为0例,PMR为49例,SMD为21例,PMD为11例,代谢有效率为60.49%;CT扫描显示CR为0例、PR为45例、SD为29例、PD为7例;客观有效率为44.32%;两种检查方法一致性Kappa值为0.446,McNemar检验结果显示差异有统计学意义(P<0.05),见表1。

表1 治疗第1个周期时PET/CT和CT检查结果比较
2.2 治疗第2个周期时PET/CT和CT检查结果比较治疗第2个周期时,PET/CT检查显示CMR为12例,PMR为49例,SMD为14例,PMD为6例,代谢有效率为75.31%;CT扫描显示CR为7例、PR为49例、SD为22例、PD为3例;客观有效率为69.14%;两种检查方法一致性Kappa值为0.546,McNemar检验显示未见明显差异(P>0.05),见表2。
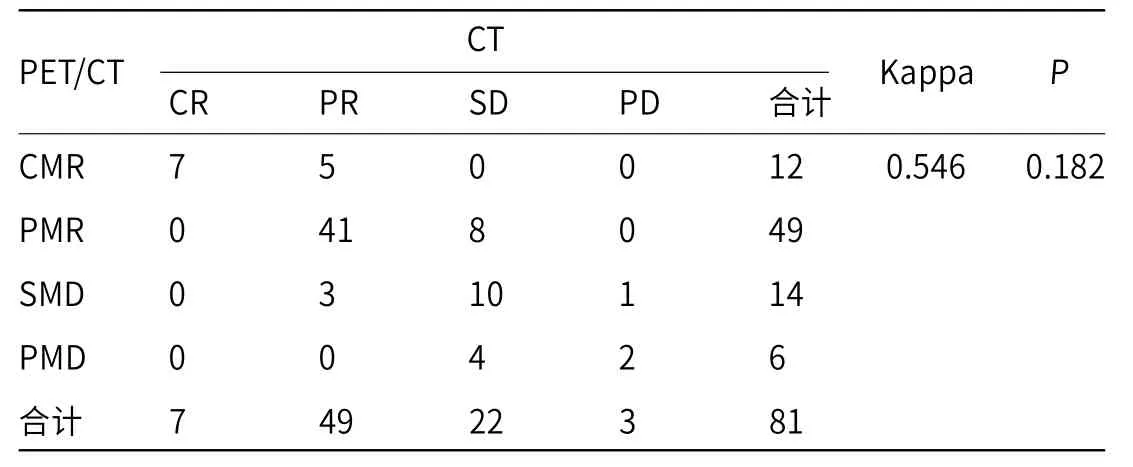
表2 治疗第2个周期时PET/CT和CT检查结果比较
2.3 治疗第1个周期时PET/CT和CT检查结果与预后的关系随访结果显示,81例晚期NSCLC患者3年生存率为34.57%,其中CMR+PMR患者中位OS为35(31.3~38.7)个月,SMD+PMD患者中位OS为26(20.6~31.4)个月,两组比较差异有统计学意义(χ2=8.867,P=0.003);CR+PR患者中位OS为34(30.9~37.1)个月,SD+PD患者中位OS为31(25.2~36.8)个月,两组比较未见明显差异(χ2=1.199,P=0.274),见图1。

图1 晚期NSCLC患者生存情况分析
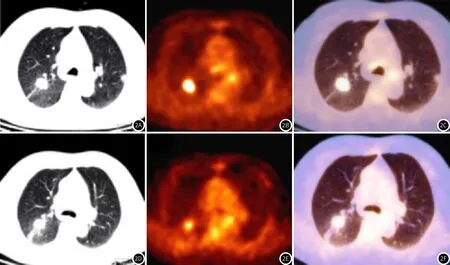
图2 NSCLC患者,女性,62岁,右上肺叶病灶治疗前及治疗1个周期后7d内对比,CT显示明显强化灶,治疗前后病灶体积无明显变化(图2A、图2C);PET显示治疗后18F-FDG摄取量明显降低(图2B、图2D),但解剖形态模糊不清,PET/CT显示可同时表现18F-FDG浓度和病灶形态特征(图2C,图2E)。
3 讨 论
晚期NSCLC患者因失去手术机会,常采用以化疗为主的综合治疗进行干预以控制病情进展,缓解患者症状并改善生活质量,现阶段常用化疗药物主要通过直接杀死肿瘤细胞发挥作用,因此可根据RECIST或WHO实体瘤评估标准,比较治疗前后病灶体积大小变化即可判断疗效[8]。贝伐珠单抗等靶向药物主要作用为抑制肿瘤细胞增殖,治疗后肿瘤细胞功能变化常先于形态改变,因此采用CT等传统影像学检查难以及时和准确反映真实治疗效果,PET/CT可从形态学和代谢水平两个方面对肿瘤进行观察分析,为评估分子靶向药物和联合化疗对晚期NSCLC患者治疗效果提供了新的思路和方向[9-10]。
肿瘤组织由于细胞增殖和生长等代谢活动旺盛,对能量需求通常明显高于正常组织,采用PET/CT检查可直观显示葡萄糖、氨基酸及核算等摄取和代谢情况,18F-FDG是目前应用最广泛的显像剂,作为葡萄糖类似物经静脉注射后可被肿瘤组织快速摄取,通过计算SUV值即可判断肿瘤代谢水平,进而反映肿瘤对所用治疗措施的反应并判断疗效,对及时调整治疗方案和改善患者预后具有重要参考价值[11]。Sharma等[12]及Usmanij等[13]均报道显示18F-FDG PET/CT对肿瘤远处转移和复发检测灵敏度较高且评价疗效及时准确。王娟等[14]研究认为综合利用晚期NSCLC患者化疗前后18F-FDG PET/CT各项参数可评估早期疗效并为化疗药物选择提供最佳参考依据。虽然现阶段18F-FDG PET/CT检查在恶性肿瘤诊断和治疗中应用广泛,但关于应用SUV变化判断疗效的临界值仍存有较多争议,EORTC推荐的标准为SUV首次化疗后降低>15%,多次化疗后降低>25%[7]。本研究采用18F-FDG PET/CT评估贝伐珠单抗联合化疗治疗晚期NSCLC临床效果显示治疗第1个周期时,81例患者中CMR为0例,PMR为49例,SMD为21例,PMD为11例,代谢有效率为60.49%;CT扫描结果显示CR为0例、PR为45例、SD为29例、PD为7例;客观有效率为44.32%;两种方法Kappa值为0.446,McNemar检验结果显示差异显著,表明18F-FDG PET/CT和CT对贝伐珠单抗联合化疗治疗晚期NSCLC疗效判断的一致性较差,两者诊断不一致的患者为24例(29.63%),其中18F-FDG PET/CT显示PMR的患者中有11例CT表现为SD,提示18F-FDG PET/CT对治疗效果的评估可能更为灵敏和及时,另外SMD患者中4例显示为PR、1例显示为PD,PMD患者中2例显示为PR、6例显示为PD,可能与肿瘤和治疗引起的局部炎症反应导致代谢水平上升而导致葡萄糖摄取增加有关,表明18F-FDG PET/CT用于恶性肿瘤疗效评估还需不断发展和完善。另外本研究比较治疗第2个周期时18F-FDG PET/CT和CT检查结果显示有效率分别为75.31%和69.14%,两者McNemar检验结果显示无明显差异,且Kappa值上升至0.546,与治疗第1个周期后相比两种检查方法有效率和一致性均大幅度提升,表明贝伐珠单抗联合化疗治疗晚期NSCLC的疗效需要较长时间观察,而18F-FDG PET/CT较CT更为灵敏和准确,其原因为PET/CT不仅可从形态学上对肿瘤病灶进行分析,还能通过检测葡萄糖代谢水平判断肿瘤细胞增殖和生长等生物学行为,故而在判断疗效和预后方面更具优势[11]。
晚期NSCLC预后情况较差,本研究随访结果显示81例晚期NSCLC患者3年生存率为34.57%,与文献报道的20%~40%相近[15]。按18F-FDG PET/CT检查结果分组进行生存情况分析显示,CMR+PMR患者中位OS为35(31.3~38.7)个月,SMD+PMD患者中位OS为26(20.6~31.4)个月,两组比较差异显著;按CT检查结果进行分组显示,CR+PR患者中位OS为34(30.9~37.1)个月,SD+PD患者中位OS为31(25.2~36.8)个月,两组间无明显差异,表明18F-FDG PET/CT对晚期NSCLC患者预后情况判断准确率较CT具有明显优势,这与该方法能准确反映肿瘤细胞代谢水平和生物学行为关系密切,但仅根据治疗效果进行预后判断尚无法满足临床需求,还需要进行更多研究探讨18F-FDG PET/CT各项参数与晚期NSCLC患者预后的关系,以使预后判断更为精确。
综上所述,18F-FDG PET/CT用于贝伐珠单抗联合化疗治疗晚期NSCLC疗效评估较CT更为及时和准确,同时还能有效判断患者预后情况,在临床治疗中具有重要参考价值。
