泛素连接酶E4B介导PM20D2、PABPC1和TACO1蛋白质的泛素化验证
2021-06-23刘香男范宇宸王亚楠武正华
刘香男, 范宇宸, 王亚楠, 陆 瑶, 赵 博, 武正华
(上海交通大学 药学院,上海 200240)
泛素(Ubiquitin,UB)通过泛素活化酶(Ubiquitin-activating enzyme,E1)、泛素结合酶(Ubiquitin-conjugating enzyme,E2)和泛素连接酶(Ubiquitin ligase enzyme,E3)传递至底物蛋白[1-2]。泛素标记的底物蛋白或被蛋白酶体降解或参与不同的细胞进程,如信号转导途径、细胞周期、DNA复制及修复等[3-4]。泛素化与肿瘤、代谢类疾病、神经退行性疾病的发病密切相关[1,3,5]。既往研究已发现人的细胞中存在2个E1,50余个E2,600余个E3[6-8]。E3和底物之间存在着复杂的交叉作用,一个E3可以将UB传递到多个底物上,同时,一个底物又可以直接或间接从多个E3上接受UB[9-10]。因此,明确底物蛋白被哪个E3识别对其功能研究具有重要意义。
实验室前期工作在HEK293细胞中建立了正交泛素转移途径(Orthogonal UB transfer,OUT)[10]。该方法在HEK293细胞中,通过转染一系列突变体(xUB、xE1、xE2、xE3)构建了一条泛素传递途径,使得xUB只能通过细胞内xE1-xE2-xE3级联反应传递并标记至底物蛋白。将细胞裂解并经过xUB上特有的标签抗体沉淀后,xUB标记的目标蛋白被富集,随后采用胰蛋白酶消化的方法,获得了一系列多肽序列。对多肽进行质谱检测,分析其中的diGly序列,确定目标蛋白是否发生了泛素化。因此,这是一种通过质谱方法寻找细胞内特定E3泛素化底物的方法。通过这种方法,已经发现泛素连接酶E4B、CHIP和E6AP在细胞中的多个潜在底物[11-12]。文中3个底物蛋白:金属蛋白酶M20家族蛋白2(Peptidase M20 domain-containing protein 2,PM20D2);多腺苷酸结合蛋白1(Polyadenylate-binding protein 1,PABPC1);细胞色素C氧化酶I翻译激活剂(Translational activator of cytochrome C oxidase I,TACO1)通过E4B进行了泛素化传递[11],但并未进一步验证。
肌肽(β-丙氨酰-组氨酸)是存在于许多脊椎动物骨骼肌中的二肽,可作为pH缓冲剂和自由基清除剂[13]。高肌肽(γ-氨基丁酰-组氨酸)是一种存在于大脑中的二肽,可作为抗氧化剂和神经递质等[14]。PM20D2属于金属蛋白酶M20家族,可清除肌肽和高肌肽在合成中产生的副产物,而不会作用于肌肽或高肌肽[15]。PABPC1有两种亚型,分别是位于细胞核中的PABPN1[16]和位于细胞质中的PABPC1[17]。其中,PABPC1主要分散在细胞质内,并集中在mRNA高浓度的位点,如应激颗粒或高翻译活性的位置。同时,PABPC1还与无义介导的mRNA降解(Nonsense-mediated mRNA decay,NMD)相关[17]。TACO1在全长细胞色素氧化酶I(COX I)的合成中起到重要作用[18]。以往针对Leigh综合征患者TACO1中携带突变基因的临床表现的研究表明,TACO1是破坏单个线粒体蛋白的翻译而引起线粒体疾病的核基因新成员,其突变与Leigh综合征相关[19]。上述3个蛋白的泛素化机制目前还不清楚。研究发现这3个蛋白都有可能是E4B的底物[11]。许多研究表明泛素连接酶E4B具有重要作用,E4B可以促进MDM2介导p53发生多聚泛素化并降解,促进癌细胞存活[20]。E4B也是调节神经系统发育的因子,可以作为神经退行性疾病治疗的靶分子[21]。本文通过对3个底物蛋白的验证及其生物学功能的了解,为揭示E4B在细胞调节中的作用以及细胞中泛素化对这3个蛋白功能的影响奠定基础。
1 材料与方法
1.1 材料
人胚肾细胞HEK293(上海中科院细胞库);E.coli感受态细胞DH5α、BL21均由本实验室保存;DMEM高糖培养基、胎牛血清、青霉素链霉素混合液(美国Gibco公司);RNA反转录试剂盒、KOD-One(日本TOYOBO公司);PCR/Gel Extraction Kit、Plasmid mini Kit(美国Omega公司);限制性核酸内切酶NheI、SalI(美国NEB公司);T4 DNA 连接酶(美国Thermo Fisher Scientific公司);Ni-NTA(美国Bio-Rad公司);Anti-flag(美国Sigma公司);鼠源二抗、兔源二抗(美国Jackson ImmunoResearch公司)。其他试剂:裂解缓冲液(50 mmol/L Tris Base,500 mmol/L NaCl,5 mmol/L Imidazole,pH 8.0);洗涤缓冲液(50 mmol/L Tris Base,500 mmol/L NaCl,20 mmol/L Imidazole,pH 8.0);洗脱缓冲液(50 mmol/L Tris Base,500 mmol/L NaCl,250 mmol/L Imidazole,pH 8.0);透析缓冲液(25 mmol/L Tris Base,150 mmol/L NaCl,0.5 mmol/L DTT,pH 8.0),TBS缓冲液(137 mmol/L NaCl,2.7 mmol/L KCl,25 mmol/L Tris-base,pH 7.4);1× TNET缓冲液(10 mmol/L Tris Base,2.7 mmol/L EDTA-2Na,50 mmol/L NaCl,1 mL 吐温-20)。
1.2 方法
1.2.1 总RNA提取和反转录
将冻存的HEK293细胞置于37 ℃水浴锅中水浴复苏,加入含10%胎牛血清、1%青霉素链霉素混合液的DMEM高糖培养基,置于37 ℃、含5% CO2的培养箱中培养。待细胞生长状态稳定且良好时,利用TRIzol法提取mRNA。测定提取的RNA浓度,反转录获得cDNA。
1.2.2 PCR获取目的基因
根据NCBI GenBank数据库查找得到的基因序列,设计PM20D2、PABPC1和TACO1的上下游引物,并在上下游引物中分别引入NheI和SalI酶切位点,引物序列如下表1。以cDNA为模板,进行PCR扩增。将PCR产物进行琼脂糖凝胶电泳分离,得到目的基因。
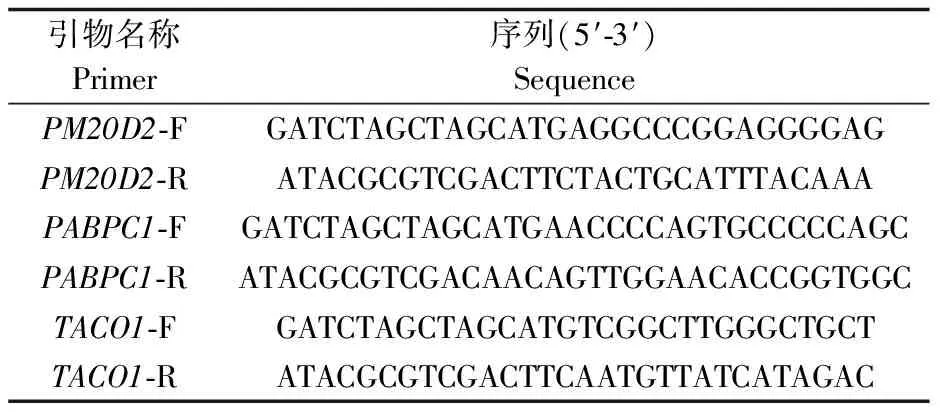
表1 目的基因引物序列
1.2.3 重组质粒构建
采用限制性内切酶NheI和SalI消化目的基因的PCR产物和pET 28a载体。使用酶切产物回收试剂盒回收目的基因,琼脂糖凝胶电泳分离并回收pET 28a载体。用T4连接酶室温连接回收后的目的基因与载体。
1.2.4 重组质粒获取及测序
取连接产物3 μL,通过化学转化的方法转入30 μL DH5α感受态细胞,加入1 mL SOC培养基,37 ℃复苏1 h,涂布于LB/Kan平板上,37 ℃过夜培养;第2天,挑取多个单克隆菌落分别接种于5 mL LB/Kan液体培养基中,37 ℃,220 r/min培养过夜;第3天,抽提质粒,测定重组质粒浓度并测序。
1.2.5 蛋白质的表达与纯化
第1天,将测序验证无误的重组质粒通过化学转化的方法转入BL21感受态细胞中,加1 mL SOC培养基,37 ℃复苏1 h,涂布于LB/Kan平板上,37 ℃过夜培养;第2天,挑取单克隆菌落于10 mL LB/Kan液体培养基中,37 ℃,220 r/min培养过夜;第3天,接种至1 L LB/Kan液体培养基中,37 ℃,220 r/min,培养至OD6000.6~0.8,加入IPTG至终浓度为1 mmol/L,16 ℃过夜诱导蛋白表达。第4天,4 ℃,6 500 r/min,离心20 min收集细胞沉淀,加入10 mL裂解液,于冰上静置30 min,充分裂解细胞。使用高压破碎仪破碎细胞,4 ℃,12 000 r/min离心15 min,收集上清液。在上清液中加入1 mL清洗过的Ni-NTA beads(实验中使用的蛋白质表达载体pET 28a带有His标签),于转盘上4 ℃结合2 h,将上述混合液加至干净的亲和纯化柱,依次用10 mL裂解液洗1次,15 mL洗涤液洗2次,最后加入4 mL洗脱液洗脱。保留流穿液和洗脱液,分别取40 μL,用10 μL 5×SDS上样缓冲液处理,99 ℃煮样10 min,并通过SDS-PAGE分离,考马斯亮蓝染色,初步确定蛋白质的表达情况。将蛋白质洗脱液装入规格为3 ku的透析袋,于1 L透析缓冲液中4 ℃透析过夜,第2 天,将透析袋转移至全新1 L透析缓冲液中,4 ℃透析4 h,收集透析完成后的蛋白质样品,测定浓度并分装,存于-80 ℃冰箱。以同样的方法表达并纯化实验所需所有蛋白质。
1.2.6 体外泛素化反应条件
体外泛素化过程中,对每个底物蛋白的体外泛素化验证设置5组实验,即实验组(第1组)包含UB、E1、E2、E3、flag-底物,MgCl2,ATP,TBS缓冲液,阴性对照组(第2组至第5组)分别不含UB、E1、E2和E3。各组分用量如下:UB 5 μmol/L,Ube1 1 μmol/L,UbcH5b 10 μmol/L,E4B 1 μmol/L,flag-底物 5 μmol/L,MgCl210 μmol/L,ATP 1.5 μmol/L。各组实验分别用TBS缓冲液补齐终体积至50 μL,室温反应2 h。
1.2.7 Western Blot
上述反应完毕后,每组实验加入12.5 μL 5× SDS上样缓冲液,混合均匀后99 ℃煮样10 min,选取10% 聚丙烯酰胺凝胶,3个底物每组实验上样20 μL,进行SDS-PAGE 分离,电泳条件为100 V 90 min。采用湿转转膜方法,转膜条件为100 V 60 min,将蛋白条带转印至NC膜,之后用5%脱脂牛奶室温封闭1 h,用纯净水将NC膜上残留的牛奶冲洗干净,anti-flag抗体孵育(pET 28a载体已经改造带有flag标签,故与底物蛋白融合表达),4 ℃过夜。第2 天,用1× TNET缓冲液洗膜3次,每次10 min,用相应的鼠源二抗室温孵育1 h,1× TNET缓冲液洗膜 3次,每次10 min,之后Odyssey双色红外荧光成像系统扫膜观察结果。
2 结果与分析
2.1 PM20D2、PABPC1和TACO1基因获取及重组质粒构建
从4皿(10 cm dish)融合度为80%~90%的HEK293细胞中提取人总RNA,进行琼脂糖凝胶电泳验证,发现总RNA呈现28 S、18 S和5 S 3条带,亮度强,表明提取的总RNA质量高,可进行反转录实验,见图1(a)。以上述总RNA作为模板,通过反转录获得cDNA,经琼脂糖凝胶电泳验证,发现cDNA条带为弥散状,见图 1(b),初步判断经反转录得到的cDNA质量较高。进而以此为模板,通过PCR方法获取3个底物基因PM20D2、PABPC1和TACO1。将PCR产物通过1%琼脂糖凝胶电泳分离和验证,发现目的基因条带浓度高且大小正确,分别为PM20D2(1 311 bp)、PABPC1(1 911 bp)和TACO1(894 bp),见图1(c)。为进一步进行重组质粒的构建,将目的基因的上下游引物中分别引入NheI和SalI酶切位点[图 1(d)],将PM20D2、PABPC1、TACO1和pET 28a载体[图1(e)]分别酶切,酶切产物回收后,利用T4连接酶分别连接底物基因与pET 28a载体。将得到的重组质粒进行测序,测序结果通过软件MegAlign比对,与NCBI提供的基因序列完全一致。结果表明:从HEK293细胞中提取的总RNA和cDNA质量高,PCR得到的3个底物基因正确,重组质粒构建成功,因此可以进行后续底物蛋白的表达和纯化。
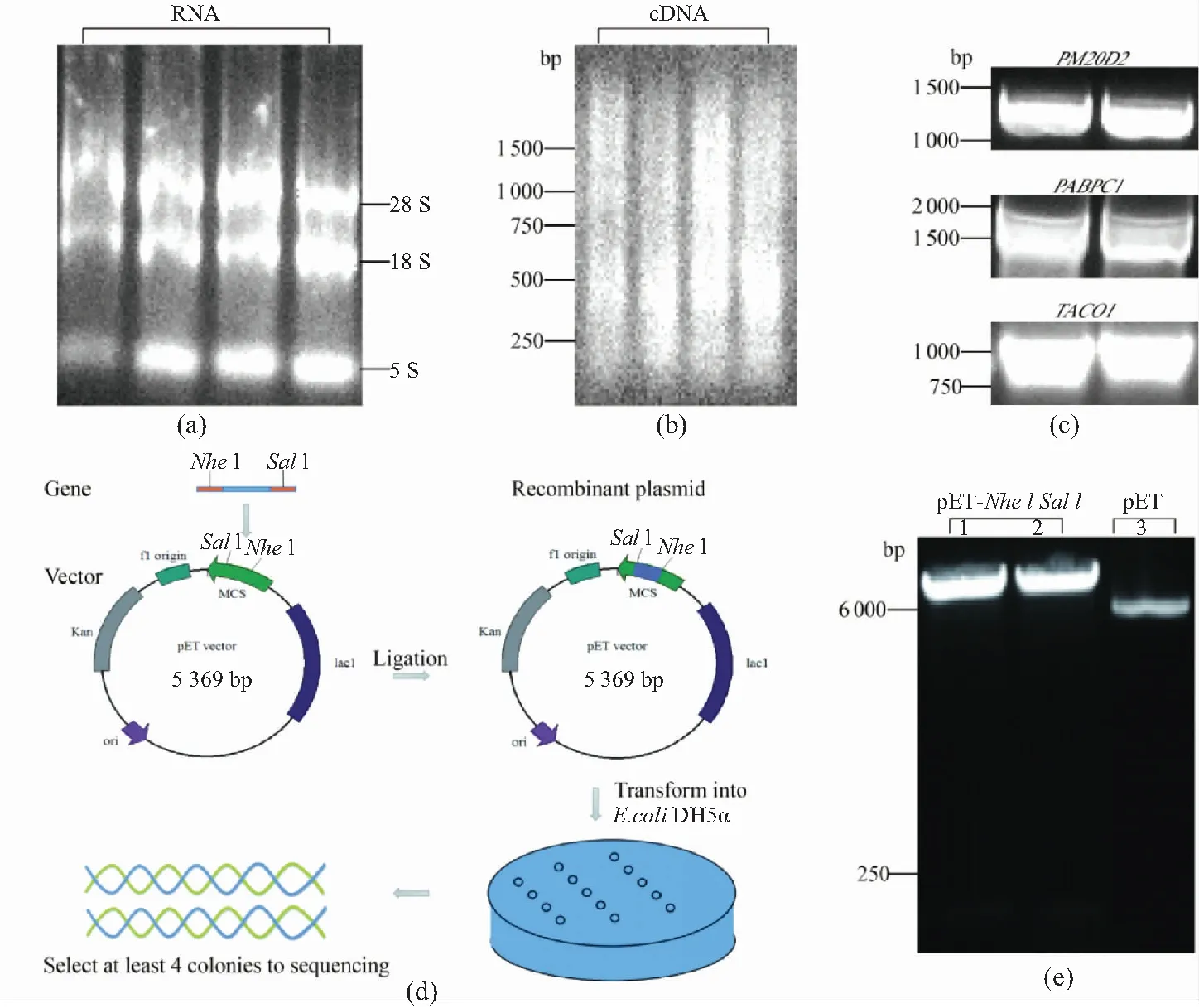
(a)4条泳道分别代表从4皿 HEK293 细胞中提取的人总RNA;(b)分别以(a)中4组RNA为模板,反转录为cDNA;(c)以(b)中3泳道的cDNA为模板,通过PCR获取目的基因,每个基因做两个复孔;(d)重组质粒构建过程;(e)酶切电泳图(1、2泳道为经Nhe I和Sal I双酶切后的pET 28a载体,3泳道为未经酶切的pET 28a载体)
2.2 蛋白质PM20D2、PABPC1、TACO1和UB、Ube1、UbcH5b、E4B的表达及纯化
选用大肠杆菌BL21表达实验所需全部蛋白质,选取镍柱亲和层析法(pET 28a载体带有His标签序列)纯化蛋白质。保留流穿液(即细菌破碎并离心后取上清液与Ni-NTA beads结合后的流出液)和蛋白洗脱液进行SDS-PAGE电泳分离,经考马斯亮蓝染色,发现底物蛋白PM20D2(47.7 ku)、PABPC1(70.6 ku)均有大量表达,TACO1(32.5 ku)表达量较低,3个底物蛋白的大小与NCBI上提供的参考值一致,见图 2(b)~(d)。进一步利用UB、Ube1、UbcH5b和E4B的重组质粒表达这4个蛋白质。结果表明蛋白质UB(8.5 ku)、UbcH5b(13.6 ku)表达量高,纯化效果好,流穿液中残余蛋白量较少,见图 2(a)。泛素活化酶Ube1(116.4 ku)和泛素连接酶E4B(146.2 ku)分子质量相对较大,表达难度较大,但均有较明显表达,分别将两个蛋白质浓缩,浓度均可达到实验所需,见图 2(a)。每升菌液最终可得到蛋白质PM20D2 3.6 mg、PABPC1 7.2 mg、TACO1 1.5 mg、UB 9.1 mg、Ube1 2.5 mg、UbcH5b 11.6 mg和E4B 2.0 mg。

(a)分别是流穿液和蛋白UB,流穿液和蛋白Ube1,流穿液和蛋白UbcH5b,流穿液和蛋白E4B;(b)流穿液和蛋白PM20D2;(c)流穿液和蛋白PABPC1;(d)流穿液和蛋白TACO1。流穿液即细菌破碎并离心后取上清液与Ni-NTA beads结合后的流出液,蛋白即经洗脱液洗脱后的含有目的蛋白的流出液
2.3 PM20D2、PABPC1和TACO1的体外泛素化验证
利用大肠杆菌表达系统表达蛋白质flag-PM20D2、flag-PABPC1和flag-TACO1(pET 28a载体已经改造带有flag标签,故与底物蛋白质融合表达),并与E4B建立体外泛素化反应。通过体外泛素化过程,验证PM20D2、PABPC1和TACO1是否为泛素连接酶E4B底物,即在ATP供能的条件下,判断UB能否通过Ube1-UbcH5b-E4B级联反应传递到底物,同时与阴性对照组(无UB、无E1、无E2、无E3)比较。结果表明:当UB通过Ube1-UbcH5b-E4B级联反应转移时,PM20D2、PABPC1和TACO1可发生多泛素化,泛素化过程中缺少UB或任一一种酶的参与,均无法有效传递UB至底物,见图3(a)、(b)和(c)。PM20D2和TACO1的多泛素化结果较为明显(1泳道),PABPC1的体外泛素化验证实验中,缺少UB、Ube1、UbcH5b和E4B(对应2、3、4、5泳道)的反应中杂带较多,但在1泳道中,UB通过Ube1-UbcH5b-E4B级联反应传递至PABPC1相比其他4条泳道效果更为明显。结果证明PM20D2、PABPC1和TACO1均是泛素连接酶E4B的底物。
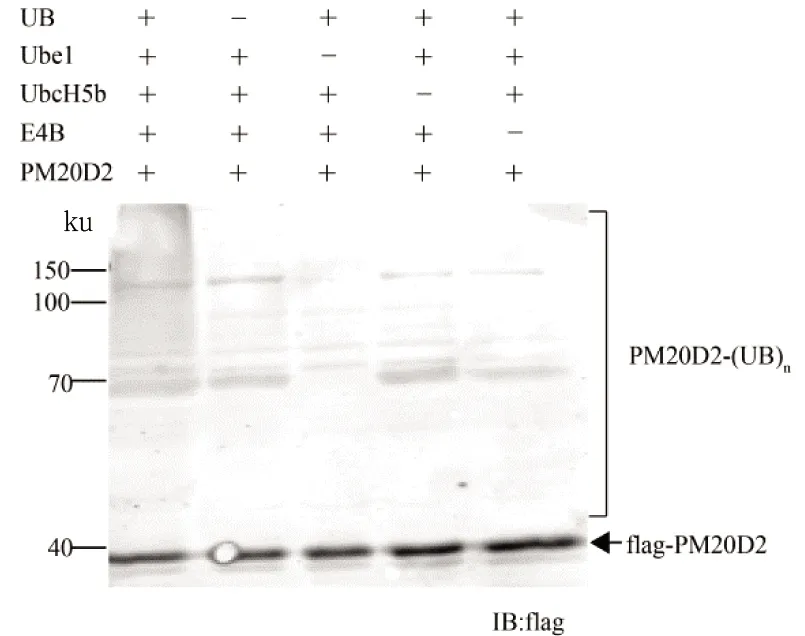
(a)
3 讨论与结论
人类基因组中编码的E3超过600个,表明其在细胞调控中起到了重要作用,但是E3多样性也使得确认其特定的直接底物困难重重[10]。实验室前期工作通过OUT途径和质谱分析方法得到泛素连接酶E4B多种潜在底物蛋白,研究选取其中3个底物进行蛋白水平泛素化验证。首先从HEK293细胞中提取人总RNA,反转录得到cDNA,进而通过PCR方法获得底物蛋白的基因序列,经测序鉴定3个底物的基因序列全部正确。因原核表达系统技术成熟、表达效率高等优点,研究通过大肠杆菌表达系统获得了电泳纯的PM20D2、PABPC1和TACO1蛋白质,以及泛素化验证过程中所需的其他蛋白质UB、E1、E2和E4B。通过3个底物的蛋白质水平泛素化验证实验,同时与缺少UB、E1、E2和E4B的阴性对照组比较,发现在ATP供能的条件下,PM20D2、PABPC1和TACO1 3个蛋白质均可被经E4B传递的UB标记,结果表明PM20D2、PABPC1和TACO1是E4B底物蛋白。PM20D2与PM20D1均属于金属蛋白酶M20家族,目前对PM20D2的研究仅认为其可优先裂解衍生自β-丙氨酸和γ-氨基丁酸的碱性二肽,起到降解异常二肽的作用[15]。而PM20D1被证实与神经退行性疾病相关[22]。实验验证PM20D2可被E4B传递的UB标记,而E4B参与修饰的底物蛋白多与神经退行性疾病密切相关[23]。因此可通过进一步实验验证PM20D2是否与同家族蛋白一样是神经退行性疾病相关蛋白。PABPC1被证明与NMD相关,PABPC1绑定到mRNA poly(A)尾巴并与eIF4G相互作用,从而稳定mRNA的环化,该结构是防止通过NMD降解mRNA所必需的[17]。NMD过程不仅会防止异常蛋白质产生,有时也会错误降解正常蛋白[24],因此未来研究中可通过泛素化来控制PABPC1的降解与否,这对于NMD行使正常功能十分重要。TACO1在肾脏中表达量最高,因此实验从人胚肾细胞中获取RNA再反转录为cDNA,进而获取目的基因,更有说服力。在目前的报道中关于TACO1蛋白功能的研究很少,仅有少量文献说明TACO1是线粒体基质蛋白[25-26]。TACO1结合mt-Co1 mRNA并与核糖体缔合,其与mt-Co1 mRNA 的瞬时结合对于刺激COX I多肽的有效翻译是必需的[26]。若TACO1蛋白丢失,影响COX I合成,进而导致细胞色素C氧化酶缺乏,引起线粒体疾病,如Leigh综合征[19]。故可进一步研究TACO1泛素化降解对线粒体疾病的调控。
研究通过体外泛素化验证,证实PM20D2、PABPC1和TACO1是E4B底物蛋白。通过对以上3个蛋白体外泛素化的验证及研究,为进一步在细胞模型和动物模型中探究其泛素化与蛋白质功能的关系奠定基础。
