RASSF4基因启动子甲基化与肿瘤关系的研究进展
2021-06-23闫亚楠陈兴珍周策凡唐景峰
闫亚楠,陈兴珍,周策凡,唐景峰
(1.湖北工业大学 生物工程与食品学院,武汉 430068;2.湖北工业大学 国家外专局/教育部细胞调控与分子药物“111”引智基地,武汉 430068)
在肿瘤形成过程中,通过检测基因组结构本身的变化,包括基因突变和染色体异常等,进而发现影响肿瘤发生发展及其相关指标改变的可能原因。此外,许多表观基因组的变化,如基因甲基化状态的改变,也与肿瘤发生发展关系密切[1]。DNA甲基化是指在DNA甲基化转移酶(DNA methyltransferases, DNMTs)的催化下,S-腺苷甲硫氨酸(S-adenosyl-L-methionine, SAM)提供的甲基被转移到相应碱基的一种DNA共价修饰方式[2]。在人类细胞基因组中DNA主要的甲基化修饰方式是CpG二核苷酸的第5位胞嘧啶处接受甲基,其中CpG二核苷酸高度聚集的DNA部位称为CpG岛,并且约有50%的启动子区域含有CpG岛[3]。但在恶性转化细胞的基因组中,约5%~10%基因启动子CpG岛的甲基化会异常增加,使得肿瘤相关基因异常表达,促使肿瘤发生发展[4]。
Ras蛋白是GDP/GTP分子开关蛋白,通常以GTP结合的激活状态或GDP结合的惰性状态存在,Ras可与下游效应蛋白相互作用,通过复杂的信号级联,促发细胞增殖、分化、运动和凋亡等多种细胞活动[5]。Ras蛋白及其下游效应因子的异常突变可激活超过30%的肿瘤发生[6]。Vavvas等[7]利用酵母双杂交技术以Ras作为诱饵,可在体外与小鼠细胞中RASSF5发生相互作用。Dammann等[8]在以人类DNA切除修复蛋白XPA诱饵的酵母双杂交筛选中发现RASSF1,与RASSF5具有高度同源性,并确定了RASSF13个不同的转录本都可编码Ras相关域(Ras-association domain, RA)。随后包含有10个成员(RASSF1~RASSF10)的Ras相关域家族(Ras-association domain family, RASSF)被发现,并根据RA结构域分布位置的不同,分为两个子类别:C端RASSF(RASSF1~6)和N端RASSF(RASSF7~10),部分成员的基因启动子甲基化与相关肿瘤关系的研究与总结已较为全面[9-10]。RASSF4在许多研究中发现其在正常组织中高表达,而在肿瘤中被甲基化而表达下调,是一种候选的肿瘤抑制因子[11]。但RASSF4启动子甲基化与肿瘤发生发展的关联及意义尚未明晰,故重点对RASSF4启动子甲基化与肿瘤关系的研究进展进行综述。
1 RASSF4生物学概况
1.1 RASSF4分子结构
RASSF4基因位于人类染色体10q11.21处,其启动子处有一个CpG岛[6,10-11]。有文献报道,RASSF4经数据库预测,可选择性剪接产生6个能翻译成蛋白质的转录本:RASSF4A~RASSF4F,其CpG岛跨越了第一个非编码的外显子(图1)[6]。其中,RASSF4A共含11个外显子,可翻译为一个321氨基酸的蛋白质[6]。RASSF4B和RASSF4C与RASSF4A相似,不同之处在于它们N端外显子的差异,RASSF4D、RASSF4E和RASSF4F的转录本由于第5号外显子被截断而变短(图1)[6]。目前针对RASSF4A及其蛋白功能的报道较为全面,因此本文主要讨论RASSF4A启动子甲基化与肿瘤的关系。
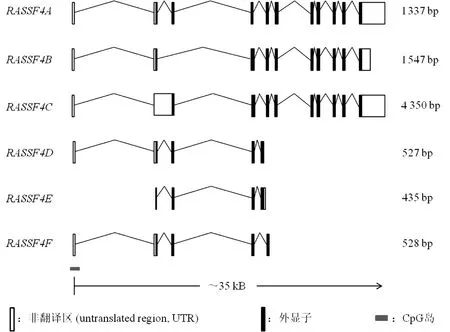
图1 RASSF4基因位点预测6个转录本解析图(改自文献[7])
RASSF4蛋白,也称为AD037,大小为36.7 ku,其位于175~262氨基酸的RA结构域能以GTP依赖性方式直接与激活的K-Ras结合,从而展现作为Ras效应器的基本功能(图2)[9-11]。RASSF4还包含了270~317氨基酸的SARAH(Salvador-RASSF-Hippo)结构域,该结构域可介导RASSF4自身或与其他蛋白质的二聚化效应[9-10],例如:RASSF4可与同样包含SARAH结构域的哺乳动物Ste20样激酶1(Mammalian Ste20-like kinase 1, MST1)发生相互作用,而MST1与肿瘤抑制、凋亡和Hippo信号级联相关(图2)[10,12]。RASSF4与RASSF1A的同源性为25%,与RASSF2的同源性高达60%[11]。同时,RASSF4缺少一些RASSF部分成员共有的特殊结构域,如:位于RASSF1A和RASSF5A中N端保守的,含锌指结构的半胱氨酸结构域(Cysteine-rich diacylglycerol/phorbol ester, DAG),也称为蛋白激酶C保守区1(Protein kinase C conserved region 1, C1)和位于RASSF1A中RA结构域前部,具有调控细胞周期检查点的ATM(Ataxia telangiectasia mutated)激酶域[6,10]。

图 2 RASSF4蛋白结构域分布图
1.2 RASSF4生物学功能及机制
1.2.1 RASSF4与细胞增殖
Michifuri等[13]发现脯氨酸丰富的小蛋白-1B(Small proline-rich protein-1B, SPRR1B)在人口腔鳞状细胞癌干细胞中高表达后抑制了RASSF4表达量,进而激活MAP激酶级联信号来促进该细胞增殖。相反的是,有团队发现在腺泡状横纹肌肉瘤细胞中可上调RASSF4,而后与MST1结合抑制MST1磷酸化,进而抑制衔接蛋白Mob激酶活化剂1(Mob kinase activator 1, MOB1)磷酸化,促进该细胞增殖[14]。这提示RASSF4在不同细胞类型中增殖的作用可能有所不同。
1.2.2 RASSF4与细胞分化
Lin等[15]报告RASSF4是一种新的中心体蛋白,是人类骨骼肌成肌细胞分化的关键成分。在分化肌管的过程中,成肌细胞通过RASSF4与MST1相结合从而促进分化,但MST1的高表达可以逆转已敲除RASSF4的成肌细胞分化,说明RASSF4与MST1协同支持骨骼肌细胞的分化。
1.2.3 RASSF4与细胞凋亡
Eckfeld等[11]报道了RASSF4过表达能够诱导293T细胞Ras依赖性凋亡,同时可以激活凋亡相关蛋白Caspase来抑制肿瘤细胞的生长。并且,该团队利用一种可以激活Ras效应器的方法,即在Ras的C端定点克隆膜定位序列CAAX(C是半胱氨酸,A通常是脂肪族氨基酸,X是任何氨基酸),然后在RASSF4的C端加入Ras-CAAX膜定位信号,发现RASSF4进一步增强促细胞凋亡的能力,同时发现RASSF4与MST1协同促进凋亡的发生。有报道,RASSF4高表达能够结合和激活MST1,进而导致JNK/c-Jun途径激活、组蛋白H2AX和H2B磷酸化增加和染色质浓缩,最终促使MM细胞凋亡[16]。
1.2.4 RASSF4其他生物学功能
最近研究表明,RASSF4具有其他潜在功能。Chen等[17]发现RASSF4可结合和活化腺苷二磷酸核糖基化因子6(Adenosine diphosphate ribosylation factor 6, ARF6),激活I型磷脂酰肌醇磷酸5-激酶(Type I phosphatidylinositol phosphate 5-kinases, PIP5KIs),提高磷脂酰肌醇-4,5-二磷酸(Phosphatidylinositol-4,5-bisphosphate, PI(4,5)P2)水平,进而调控钙库操作性钙离子通道(Store-operated calcium entry, SOCE),即促使内质网Ca2+传感器基质相互作用分子1(Stromal interaction molecule 1, STIM1)向内质网-质膜(ER-PM)转运,触发Ca2+内流,并对ER-PM的连接起着稳定作用,这提示RASSF4可调控SOCE、ER-PM连接和PI(4,5)P2所依赖的生物学过程。Zhang等[18]报道了在骨肉瘤细胞中过表达RASSF4可降低Wnt信号通路相关蛋白β-Catenin及其下游靶蛋白cyclin D1和c-Myc的表达,故推测RASSF4与Wnt信号通路存在某种联系。
2 RASSF4基因启动子甲基化与肿瘤的关系
2.1 RASSF4在肿瘤中的表达失调机制
肿瘤相关基因组结构异常和表观基因组改变是由遗传因素引起肿瘤发生的主要作用机制[1]。研究人员没有检测到RASSF4编码序列潜在失活突变位点,却发现RASSF4在人体组织(脑、心、肝、肺、胰腺、骨骼肌和胎盘)中广泛表达,但在某些肿瘤细胞系和原发肿瘤中被下调[11]。经研究,RASSF4启动子有一个CpG岛,其表达水平与CpG岛甲基化相关,如果用DNA去甲基化剂5-氮杂-2′-脱氧胞苷(5-aza-2′-deoxycytidine, 5-Aza-CdR)处理某些肿瘤细胞后甲基化发生逆转[10-11]。故表明RASSF4在多种肿瘤的重要失调机制是其启动子甲基化,但其甲基化的程度因肿瘤细胞类型的不同而有所差异。
2.2 RASSF4启动子甲基化与RCC、BC和CRC
Eckfeld等[11]通过检测CpG岛甲基化,发现在正常肾细胞中RASSF4高表达,在不发生RASSF4甲基化的RCC细胞系SKRC54与正常肾细胞相比,RASSF4表达量高达58.4%,但存在RASSF4甲基化的SKRC18和SKRC39系与正常肾细胞相比,表达量仅为4.5%和1.1%。在RCC细胞中,RASSF4启动子甲基化率为44.4%(4/9)。同时发现,存在RASSF4甲基化的T375系的原代BC细胞、T47D、HCC1419、MCF-7和HTB19的BC细胞系中,其表达量仅为正常乳腺细胞的12.8%、3.4%、1.4%、0.3%和0.3%;在BC的原代细胞和肿瘤细胞系样本中,RASSF4甲基化率分别为27.0%(10/37)和53.6%(15/28)[11]。经5-Aza-CdR处理,T74D和MCF-7中RASSF4表达量增加。研究表明在CRC细胞系SW48和DLD1中RASSF4甲基化程度高,5-Aza-CdR处理后,SW48和LoVo系相比未处理组的RASSF4的转录水平增加[11]。以上表明RASSF4在RCC、BC和CRC中可作为潜在抑癌因子。
2.3 RASSF4启动子甲基化与LC
Eckfeld等[11]发现,在正常的肺细胞中,RASSF4转录水平高达54.1%,但在有甲基化RASSF4的癌细胞系A549和H2171中,其转录水平低至9.9%和1.5%。在原发性小细胞肺癌(Primary small-cell lung carcinoma, SCLC)的原代细胞和肿瘤细胞系样本中,RASSF4启动子甲基化率分别为20.7%(6/29)和32.0%(8/25)。在非小细胞肺癌(Non-small-cell lung carcinoma, NSCLC)的原代细胞和肿瘤细胞系样本中,RASSF4启动子甲基化率分别为22.2%(6/27)和50.0%(7/14)。同样有文献指出约有40.5%(36/89)的NSCLC样本与正常肺细胞相比,RASSF4表达量下降,并且在NSCLC中H460、A549、H1299和H446系,RASSF4表达量明显降低,并且该团队推测由于RASSF4启动子甲基化而导致RASSF4表达量降低[19-20]。Liu等[21]发现在肺腺癌(Lung adenocarcinoma, LUAD)中,高甲基化/高miRNA表达组的RASSF4蛋白水平要明显低于低甲基化/低miRNA表达组,同时发现低表达的RASSF4会影响LUAD的预后。故这些研究表明在肺癌中RASSF4因甲基化而表观下调,RASSF4可作为肺癌潜在的抑癌因子。
2.4 RASSF4启动子甲基化与MM
De Smedt等[16]报道了在MM中XG-7、AMO-1和L363系的RASSF4表达水平较低,并且RASSF4表达量与CpG岛的甲基化状态呈显著反比(R=-0.89)。用5-Aza-CdR处理XG-7和AMO-1,RASSF4显著上调。在自发发育成原代MM的小鼠模型中,通过抗癌药物治疗可显著地增强RASSF4表达量,这说明过表达RASSF4可抑制MM在体内的生长,表明RASSF4可作为抑制MM生长的中枢。
2.5 RASSF4启动子甲基化与HNSCC
Steinmann等[22]发现,在HNSCC中RASSF4可发生甲基化;在原发性HNSCC患者中,只有13.0%(7/54)患者的RASSF4发生甲基化。但是复发性HNSCC患者(23.3%,7/30)的RASSF4甲基化程度高于未复发患者(0%,0/20)。在第Ⅳ期的HNSCC,有17.1%(6/35)的患者中发生RASSF4甲基化,明显高于处于第Ⅲ期患者的RASSF4甲基化水平(0%,0/7)。同时,在N3期中发现RASSF4甲基化的程度达50.0%(3/6),要比N2期HNSCC(11.5%,3/26)的甲基化程度高。这说明在复发的HNSCC、Ⅳ期和N3期的HNSCC中,有较高的RASSF4甲基化水平,RASSF4可作为HNSCC中潜在抑癌因子。
2.6 RASSF4启动子甲基化与GCA
Guo等[23]提出,在GCA的组织样本中,有51.9%(70/135)的样本显示出RASSF4表达量下降。同时,在GCA样本中检测到RASSF4的异常CpG岛甲基化,并与RASSF4表达量呈负相关(R=-0.296)。这提示RASSF4可能是GCA肿瘤发生的抑癌因子之一。
2.7 RASSF4启动子甲基化与NPC
Chow等[24]发现通过对RASSF4在NPC各细胞系中转录水平的检测,在CNE1、CNE2和HONE1系中明显降低,而在具有良好分化能力的HK1系中RASSF4表达缺失。通过检测CpG岛甲基化,在HK1中检测到RASSF4启动子区呈密集甲基化,而其他系则未显甲基化。用5-Aza-CdR处理HK1,观察到RASSF4发生去甲基化和再表达。但在检测原发性NPC中RASSF4甲基化状态时,发现只有5.0%(1/20)的样本中检测到。由于RASSF4高甲基化仅存在于HK1,故该团队推测RASSF4在分化程度较高的NPC癌系中甲基化频率高,具有癌细胞系特异性。据此推测RASSF4可能是HK1等分化程度良好的癌细胞系潜在抑癌靶点之一,但并非抑制NPC的关键靶点。
2.8 RASSF4启动子甲基化与其他肿瘤
Djos等[25]发现在所有的神经母细胞瘤(Neuroblastoma,NB)系中,均表达RASSF4,并且与RASSF其他成员相比,RASSF4表达水平最高。而且在NB中RASSF4甲基化水平低于25%,在原发性NB中一般不发生甲基化。同时该团队用5-Aza-CdR和去乙酰化酶抑制剂TSA联合处理可导致5/9的细胞中RASSF4的转录水平上调,表明RASSF4在NB中可发生表观遗传调控。但由于在不同的NB细胞系中均表达RASSF4,并且在NB中RASSF4低甲基化,所以该团队认为RASSF4不作为NB中的候选抑癌基因。有文献报道了在膀胱癌(Bladder cancer, BCa)及其邻近正常组织中均未发现RASSF4发生甲基化[26]。Richter等[27]通过检测RASSF4在嗜铬细胞瘤(Pheochromocytoma, PCC)中的甲基化程度,发现没有样本(0/19)显示其启动子区呈甲基化。有团队在甲状腺癌(Thyroid cancer, TC)细胞中未检测到甲基化的RASSF4[28]。Calvisi等[29]发现在正常肝脏中RASSF4的启动子不发生甲基化,在肝癌(Hepatocellular carcinoma, HCC)中RASSF4甲基化率为5%,其甲基化程度较低。故依据上述研究结果推测,RASSF4在NB、BCa、PCC、TC和HCC中作为候选、关键抑癌因子的可能性较小。但上述部分肿瘤的相关报道并不多,对此可进一步验证与研究。
3 逆转甲基化治疗肿瘤
由于DNA甲基化不会造成一级结构的改变,具有可逆性[2,30]。故可根据该特点,寻找可使抑癌基因去甲基化的药物,恢复抑癌蛋白在特定肿瘤的表达,为治疗肿瘤提供一种可行性。5-Aza-CdR又名地西他滨,作为一种常用有效但毒性较高的去甲基化剂,已被美国食品和药物管理局(FDA)获批上市,用于治疗由骨髓增生异常引起的综合症和恶性血液病[30]。经5-Aza-CdR处理的DNA链可共价结合于DNMTs,从而降低DNMTs酶活,这样存在于肿瘤细胞的相关抑癌因子免于甲基化,进而重新活化表达起到抑癌作用[30]。在上述研究中,BC[11]、CRC[11]、MM[16]、NPC[24]和NB[25]中的部分肿瘤系经5-Aza-CdR处理甲基化的RASSF4后可重新表达。但由于5-Aza-CdR的大剂量使用引发细胞毒害,故5-Aza-CdR和相关表观遗传修饰药剂的联合使用以提高药效,已成为研究热点[30]。此外,鸟苷地西他滨、折不拉林等DNA去甲基化剂已有条不紊地开发和临床实验[30]。所以,通过合理找寻和使用去甲基化剂药物,逆转RASSF4等相关抑癌基因的甲基化,以治疗特定肿瘤仍需深入探究。
4 总结与展望
据文献报道,RASSF4基因经预测后有6个转录本,目前研究较为全面的是RASSF4A及其蛋白,而其他转录本及对应蛋白的相关研究还有待确认与开展。并且,RASSF4作为一种潜在的肿瘤抑制因子,可调节细胞增殖、分化、凋亡等多种生理活动,但调控机制复杂,还需深入研究。RASSF4在RCC、BC、CRC、LC、MM、HNSCC、GCA和NPC(尤其是HK1等分化程度良好的癌系)的肿瘤中下调或沉默,其中启动子CpG岛异常甲基化是其表达下调或沉默的主要机制,与多种肿瘤的发生发展相关。但已研究的部分肿瘤与RASSF4启动子甲基化关系的相关报道并不多,对此可加以验证与深入研究,同时可为研究工作者探究RASSF4启动子甲基化与目前未研究的肿瘤的相关性提供思路。此外,伴随着研究的不断深入,RASSF4异常甲基化检测有望成为特定肿瘤检测的辅助手段,对逆转RASSF4及其他相关抑癌基因甲基化合适药物的寻找也有望作为治疗特定肿瘤的新方法。总之,随着更加深入地解析RASSF4因子,将为特定肿瘤的检测和治疗提供可行性。
