改良微量肉汤药敏实验应用效果分析
2021-06-22周云花赵志军苏雅静
周云花 , 赵志军, 杨 红 , 康 佳 , 苏雅静 , 乔 霞 , 于 欣
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学总医院 宁夏病原微生物重点实验室,银川 750004;3.宁夏医科大学总医院医学实验中心,银川 750004; 4.宁夏医科大学临床医学院医学检验系,银川 750004)
金黄色葡萄球菌和大肠埃希菌是医院感染最常见的病原体,与人类多种疾病相关,且对大多数抗生素表现出极高的耐药性,由此引发感染者病死率大幅上升,给临床抗感染治疗带来诸多问题[1-5]。抗生素敏感性实验是目前公认的针对细菌耐药性和敏感性的检测方法,其通过测定抗菌药物在体外抑制病原微生物生长的效力,以确定细菌对抗生素的敏感性[6]。临床现有较多抗生素敏感性实验可用于细菌药敏检测,如纸片扩散法、稀释法、抗生素浓度法、VITEK2 全自动细菌鉴定仪等,以上方法均可为临床检测细菌耐药性提供有效依据,但仍存在操作烦琐、成本高、仪器依赖性强等问题,且培养过程需要耗费大量时间实现细菌富集[7-9],从而增加临床耐药菌株感染者的病死率,影响感染者的预后。
本研究设计了一种改良微量肉汤药敏实验(荧光法),利用荧光二抗分别捕获与金黄色葡萄球菌和大肠埃希菌特异性结合的一抗,通过检测细菌是否产生荧光来判定最低抑菌浓度(minimum inhibitory concentration,MIC)。本文通过比较改良微量肉汤药敏实验(荧光法)、VITEK2 全自动细菌鉴定仪和微量肉汤稀释法检测金黄色葡萄球菌和大肠埃希菌耐药性的实验结果,验证三种方法的有效性和统一性,为临床提供一种快速药敏实验备选方法。
1 资料与方法
1.1 菌株与主要试剂
金黄色葡萄球菌ATCC29213、大肠埃希菌ATCC25922 购自上海汉尼生物技术有限公司;临床分离金黄色葡萄球菌和大肠埃希菌来自宁夏医科大学医学实验中心微生物组;LB 肉汤培养基购自中国北京索莱宝科技有限公司(货号:L1010);MH 肉汤培养基购自中国北京索莱宝科技有限公司(货号:M8556);苯唑西林、利奈唑胺、环丙沙星、青霉素、红霉素、亚胺培南、头孢曲松、哌拉西林和妥布霉素均购自中国大连美仑生物技术有限公司;山羊抗小鼠IgGH&L(FITC)购自英国 Abcam 公司(批号:6785);Lipid ALPS Poly-clonal Antibody(货号:PA1-73178)、Alexa Fluor 488 Protein Labeling Ki(t货号:A10235)、96 孔酶标板均购自美国Thermo Fisher Scientific 公司。
1.2 实验仪器
多功能微孔板监测仪购自美国BioTek 公司(型号:SYNERGY2);VITEK2 全自动细菌鉴定仪购自法国生物梅里埃股份有限公司(型号:VITEK2COMPACT60)。
1.3 方法
1.3.1 细菌培养定量 分别挑取标准菌株金黄色葡萄球菌ATCC29213、标准菌株大肠埃希菌ATCC25922、5 株临床分离金黄色葡萄球菌和5株临床分离大肠埃希菌的单个菌落于LB 肉汤培养基中摇菌过夜(37 ℃,180 r·min-1),再分别加入生物素标记的一抗捕获并于0.9%生理盐水中定量为 1×108CFU·mL-1。
1.3.2 改良微量肉汤药敏实验(荧光法) 用MH肉汤培养基分别稀释1.3.1 中定量的标准菌株和5 株临床分离的金黄色葡萄球菌、大肠埃希菌菌悬液至 1×106CFU·mL-1。在 96 孔板第 1~10 列配制 100 μL 药物浓度依次为 64、32、16、8、4、2、1、0.5、0.25 和 0.125 μg·mL-1的抗生素,再分别加入100 μL 制备好的菌悬液至终浓度为1×105CFU·mL-1,第 11 列加入 200 μL MH 肉汤培养基作阴性对照,第12 列加入200 μL 菌悬液作阳性对照[10]。接种好的药敏板置于35 ℃温箱中培养4、6、8 和 10 h 后,在接种金黄色葡萄球菌的孔内加入 5 μL 山羊抗小鼠 IgG 荧光抗体(1∶2500),在接种大肠埃希菌的孔内加入5 μL 经Alexa Fluor 488 Protein Labeling Kit 标记的Lipid ALPS Polyclonal Antibody(1∶30),35 ℃温箱继续培养30 min,利用多功能微孔板监测仪检测荧光强度值,并根据CLSIM100 文件判断确定MIC,实验重复3 次。
1.3.3 VITEK2 全自动细菌鉴定仪 将标准菌株和5 株临床分离的金黄色葡萄球菌、大肠埃希菌的纯菌落分别制成0.5 麦氏浊度的菌悬液,经充填机将菌悬液注入试卡内,封口后放入读数器恒温培养箱,根据试卡各生化反应孔中的生长变化情况,最后鉴定结果在显示器上自动显示。
1.3.4 微量肉汤稀释法 标准菌株和5 株临床分离的金黄色葡萄球菌、大肠埃希菌的微量肉汤稀释法药敏板配制流程同1.3.2;将分别接种好的药敏板置于35 ℃温箱中培养18~22 h,通过观察MH 肉汤培养基的浊度并检测OD 值,根据CLSIM100 文件判断确定MIC,实验重复3 次。
1.3.5 三种抗生素敏感性实验的MIC、检测周转时间(turn-around time,TAT)结果比较 根据上述抗生素敏感性实验结果,通过统计学方法比较其MIC 一致性与TAT 差异性。其中,金黄色葡萄球菌ATCC29213 和大肠埃希菌ATCC25922 是美国临床标准化实验室(Clinical and Laboratory Standards Institute,CLSI)和欧盟药敏实验委员会(European Committeeon Antimicrobial Susceptibility Testing,EUCAST)规定的微量肉汤稀释法药敏实验中的质控菌株,其质控范围在3个倍比浓度梯度以内。由于药敏实验影响因素很多,所以误差范围定义为3 个药物倍比浓度梯度[11-13]。因此,本文中对比VITEK2 系统、微量肉汤稀释法与改良微量肉汤药敏实验(荧光法)的MIC 也遵循此原则。
1.4 统计学方法
资料运用SPSS 16.0 软件进行统计分析,三种抗生素敏感性实验结果之间的一致性比较由Cohen’s kappa 值表示(差:k<0.20;一般:0.21<k<0.40;中等:0.41<k<0.60;较强:0.61<k<0.80;强:k≥0.81)。计量资料以均值±标准差()表示,多个样本均数比较采用单因素方差分析,两两比较采用LSD-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 三种抗生素敏感性实验检测金黄色葡萄球菌和大肠埃希菌的MIC 结果比较
在对标准菌株金黄色葡萄球菌和大肠埃希菌进行的3 次重复对比实验中,三种方法对两种菌株检测的MIC 在3 个药物浓度梯度以内的吻合率几乎为100%,且均在质控范围内。在对5 株临床分离金黄色葡萄球菌和大肠埃希菌进行的3 次重复对比实验中,三种方法对两种菌株检测的MIC 在3 个药物浓度梯度以内的吻合率也几乎为100%。结果显示,三种方法对标准菌株金黄色葡萄球菌(表1)、大肠埃希菌(表2)和临床分离金黄色葡萄球菌(表3)、大肠埃希菌(表4)检测的MIC 均未超出3 个药物倍比浓度梯度。三种方法检测结果的Cohen’s kappa 值为1.000,P=0.083。因此三种抗生素敏感性实验检测金黄色葡萄球菌和大肠埃希菌的结果高度吻合。
2.2 三种抗生素敏感性实验检测金黄色葡萄球菌和大肠埃希菌药敏的TAT 结果比较
三种药敏方法对金黄色葡萄球菌药敏实验结果显示,VITEK2 全自动细菌鉴定仪的TAT 需17 h 以上;微量肉汤稀释法的TAT 一般需要22 h左右;与这两种方法相比,改良微量肉汤药敏实验(荧光法)TAT 缩短,仅为 8~10 h(P<0.01),见图1A。三种方法对大肠埃希菌药敏TAT 实验结果显示,改良的微量肉汤药敏实验(荧光法)和VITEK2 全自动细菌鉴定仪的TAT 均为10 h 左右,而微量肉汤稀释法TAT 长达22 h 左右,三种方法的TAT 差异有统计学意义(P<0.01),见图1B。
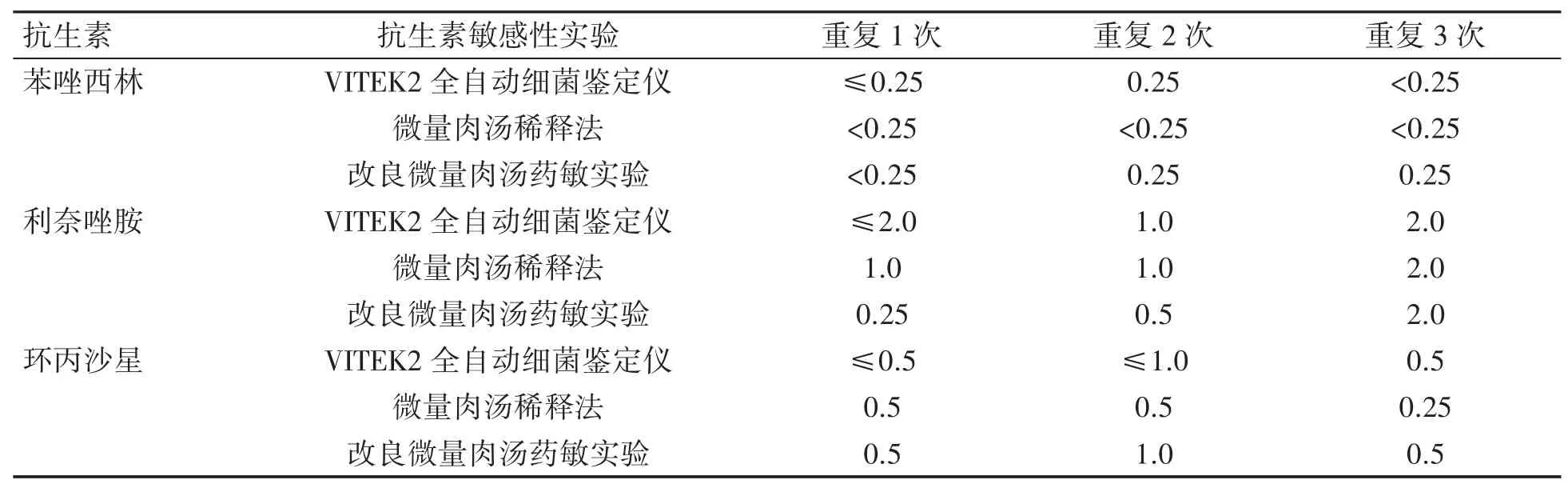
表1 三种抗生素敏感性实验检测标准菌株金黄色葡萄球菌ATCC29213 的MIC(μg·mL-1)

表2 三种抗生素敏感性实验检测标准菌株大肠埃希菌ATCC25922 的MIC(μg·mL-1)

表3 三种抗生素敏感性实验检测临床分离金黄色葡萄球菌的MIC(μg·mL-1)
3 讨论
金黄色葡萄球菌和大肠埃希菌是临床常见耐药菌株[14],且其耐药性与细菌感染导致的高发病率和高病死率密切相关。因此,快速、准确发布临床高危患者的细菌培养和抗生素敏感性实验结果,对于提高患者预后及避免易感微生物抗生素的滥用至关重要[15-17]。但目前医院常用的VITEK2 全自动细菌鉴定仪成本高,不适用于基层医疗,微量肉汤稀释法操作烦琐,且以上两种方法均是通过检测菌种与抗生素孵育后浊度判定细菌对药物的敏感性,孵育耗时长,一般需要22 h 左右[7-9]。本研究设计的一种改良微量肉汤药敏实验(荧光法),总时长仅10 h,相对VITEK2全自动细菌鉴定仪与微量肉汤稀释法耗时较短,同时该方法利用荧光抗体分别捕获与金黄色葡萄球菌和大肠埃希菌特异性结合的抗体,通过检测细菌是否产生荧光可直接、准确判定MIC。因此,改良微量肉汤药敏实验(荧光法)耗时短,结果判读更客观简便,更适用于基层医疗,可为临床医生提供及时的用药方案,有效降低患者细菌感染病死率。

表4 三种抗生素敏感性实验检测临床分离大肠埃希菌的MIC(μg·mL-1)

图1 三种抗生素敏感性实验检测细菌药敏的TAT 比较
本文使用改良微量肉汤药敏实验(荧光法)分别对金黄色葡萄球菌ATCC29213 平行进行3次苯唑西林、利奈唑胺和环丙沙星的药敏实验,对大肠埃希菌ATCC25922 平行进行3 次庆大霉素、环丙沙星和亚胺培南的药敏实验,同样对临床分离金黄色葡萄球菌进行苯唑西林、利奈唑胺、青霉素、红霉素的药敏实验,对临床分离大肠埃希菌进行亚胺培南、头孢曲松、哌拉西林、妥布霉素的药敏实验,在没有出现跳孔的情况下,通过分析细菌在含有不同抗生素的MH 肉汤中培养不同时间点后是否产生荧光来确定MIC。经检测发现,利用改良微量肉汤药敏实验(荧光法)检测上述两种菌株的MIC 与VITEK2 全自动细菌鉴定仪及微量肉汤稀释法的药敏结果一致,且尚未发现超出3 个药物倍比浓度的差异值。因此,研究认为改良微量肉汤药敏实验(荧光法)具有良好的准确性,可为临床检测细菌耐药性提供有力依据。
综上所述,改良微量肉汤药敏实验(荧光法)主要通过检测是否产生荧光判断细菌MIC,虽然药敏实验前需手工配制药敏板,但该方法具有结果判读更直接客观、耗时短等优点,在临床快速、精准选择抗生素治疗方面具有较大潜力,可为临床危重患者提供更快速、可靠的药敏结果。改良微量肉汤药敏实验(荧光法)是一种快速检测细菌耐药性的创新技术,与其他临床常规药敏方法的对比尚未见报道。后续实验中,将通过增加实验重复对比次数、临床分离菌株数进一步优化该实验的检测流程,使其能够作为常规药敏检测方法广泛应用于临床。
