尼罗罗非鱼CD209基因的克隆、表达及功能鉴定
2021-06-21罗国玲王孝谦简纪常鲁义善汤菊芬黄瑜
罗国玲 ,王孝谦 ,简纪常 ,鲁义善 ,汤菊芬 ,黄瑜*
(1.广东海洋大学 水产学院,广东 湛江 524088; 2.广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088; 3.水产经济动物病害控制广东省普通高等学校重点实验室,广东 湛江 524088)
先天免疫是免疫防御机制的第一道防线,在脊椎动物和无脊椎动物中对外来病原体具有重要的防御功能。在低等脊椎动物硬骨鱼中,先天免疫系统在保护生物体免受病原体入侵方面发挥着关键作用[1]。机体通过模式识别受体(pattern recognition receptors, PRRs)识别细菌、真菌和病毒等病原体,使自身免受病原体侵害[2],其中,Toll样受体(toll-like receptors,TLRs)、NOD样受体(NOD-like receptors,NLRs)、RIG-Ⅰ样受体(RIG-I like receptors,RLRs)和C型凝集素受体(C-type lectin receptors,CLRs)在识别病原体相关分子模式的先天免疫中起着重要的作用[3]。
CD209又称为树突状细胞特异性细胞间黏附分子3结合的非整合素(dendritic cell-specific intercellular adhesion molecule-3-grabbing nonintegrin,DC-SIGN),是模式识别受体C型凝集素家族的成员,其既能激活初始免疫反应,又能抑制免疫反应,具有正负免疫调节作用,近年来该研究较受关注[4-6]。研究者最初研究树突状细胞(dendritic cell,DC)在人类免疫缺陷病毒(HIV)感染过程中的作用时发现,CD209是树突状细胞膜上的一种C型凝集素,可以和T细胞表面的细胞间黏附分子3(ICAM-3)相互作用,介导DC细胞与T细胞的原始黏附,后来研究发现,CD209可在DC黏附迁移及炎症反应、激活初始T细胞并启动免疫应答及病原体与肿瘤逃逸等诸多方面发挥着重要作用[7-9]。CD209主要在DC和巨噬细胞的表面表达,可参与细胞相互作用的调节和模式识别[10]。目前,关于CD209的研究主要集中在人和小鼠,而对于鱼类的CD209和DCs的研究报道较少。研究表明,斑马鱼在受到钉形贝血蓝蛋白(keyhole limpet hemocyanin,KLH)或嗜水气单胞菌刺激后,通过干扰CD209的表达可以显著抑制T细胞活化、抗体(IgM)的产生和细菌免疫保护,这表明CD209在适应性免疫的启动和发展中发挥至关重要的作用[11]。此外,在病原感染后,半滑舌鳎肾脏和血液中的CD209表达显著上调,且CD209蛋白能显著促进半滑舌鳎白细胞对细菌的吞噬作用[12],这表明CD209在病原体感染过程中发挥着重要作用。
尼罗罗非鱼Oreochromisniloticus为中国重要的经济鱼类之一。近年来,随着养殖规模的不断扩大,高密度养殖和水体污染等原因导致罗非鱼疾病大规模暴发,给水产养殖业造成了巨大的经济损失[13]。尤其是近年来新发现的罗非鱼湖病毒,已对厄瓜多尔等国家的罗非鱼养殖造成了巨大损失,因此,有关罗非鱼先天免疫防御系统的研究可为病害的控制提供帮助。目前,关于CD209在尼罗罗非鱼中的作用未见报道,其在尼罗罗非鱼疾病的发生、发展中的作用机理尚不清楚,为此,本研究中对尼罗罗非鱼CD209基因(OnCD209)进行了克隆及序列分析,检测了CD209在各组织中的表达情况及无乳链球菌感染后的表达模式,并分析了CD209在细胞中的定位情况及其在细胞中过表达时对NK-κB(nuclear factor kappa-light-chain-enhancer of activated B cell)通路的影响,以期为进一步研究罗非鱼CD209的生物学功能提供理论基础。
1 材料与方法
1.1 材料
试验用健康尼罗罗非鱼(体质量为100 g±5 g)购自广东省湛江市湖光镇的某渔场。无乳链球菌是广东省水产经济动物病原生物学及流行病学重点实验室从患病尼罗罗非鱼体内分离保存的菌株(ZQ1901)。
实验室常规基因克隆相关试剂购自生工生物工程(上海)股份有限公司,RNA提取、cDNA合成及荧光定量相关试剂购自北京全式金生物公司,双荧光素酶报告基因检测试剂盒购自碧云天生物公司,引物合成和测序均由广州生工生物有限公司完成。
1.2 方法
1.2.1 试验设计及饲养管理 试验开始前,将尼罗罗非鱼于实验室条件下暂养2周,暂养于1 000 L的充氧水箱,每个水箱养殖200尾尼罗罗非鱼,水温控制在28 ℃左右,每日早晚各投喂一次饲料(恒兴罗非鱼膨化饲料106),每3日换一次水,每次排掉1/2养殖水后再注入新水,并利用虹吸法清理缸内排泄物。试验开始前,随机抽检一些尼罗罗非鱼的脾脏、头肾、肝脏等组织,验证是否含有病原微生物。对鱼体解剖取其组织前使用丁香酚麻醉处理,所有的处理均符合广东省试验动物福利相关规定。
1.2.2 尼罗罗非鱼总RNA的提取及CD209开放阅读框的克隆 采用TRIZOLUP方法提取尼罗罗非鱼脾脏总RNA,将脾脏组织置于2 mL的无RNA酶EP管中,加入1 mL的TRIZOLUP及钢珠一个,使用研磨器研磨3 min;将200 μL氯仿加入组织匀浆中,充分震荡,混合液于4 ℃下以12 000 r/min离心15 min,将分层后的上层水相转移至1.5 mL无RNA酶的EP管中;加入等体积提前预冷的异丙醇,室温静置10 min;离心后弃上清液,加入500 μL体积分数75%的乙醇,温和震荡后以8 000 r/min离心5 min,弃上清液,室温下晾干10 min,然后加入无RNA酶的水溶解RNA样品,使用超微量生物检测仪检测其浓度,并用琼脂凝胶电泳检测提取的RNA质量。使用全式金公司的反转录试剂盒进行第一链cDNA的合成,产物于-20 ℃下保存待用。
使用Prime 5.0设计一对引物(CD209-F: ATGAGTGTCGAGTACCATGCATCC,CD209-R: CTACATCTCACAGATCCAGTTTTGTTC),以脾脏的第一链cDNA为模板,进行CD209开放阅读框(Open reading frame,ORF)片段的克隆。PCR反应体系(共20 μL):Ex Taq 酶10 μL,cDNA模板1 μL,CD209-F/R各1 μL,ddH2O 7 μL。PCR反应程序:95 ℃预变性5 min;95 ℃下循环变性30 s,60 ℃下退火复性30 s,72 ℃下延伸50 s,共进行35个循环;最后再在72 ℃下延伸5 min。通过琼脂凝胶电泳检测PCR产物条带大小与理论值是否相符,然后对PCR产物进行纯化,将纯化后的PCR产物转入pMD-18T克隆载体,涂板挑菌后进行菌落PCR检测,挑取阳性克隆送至广州生工生物有限公司进行测序。
1.2.3OnCD209序列分析 测序结果采用DNAMAN进行拼接,用美国生物技术信息中心(NCBI)Blast在线程序进行序列比对。用ORF Finder程序(http://www.ncbi.nlm.nih.gov/orffinder/)分析OnCD209潜在的开放阅读框架。利用在线软件ExPASy-ProtParam工具(https://web.expasy. org/protparam/)对氨基酸序列、分子量和理论pI进行预测。使用在线程序ExPASY (http://ca.expasy.org)和SMART(http://smart.embl-heidelberg.de)获得氨基酸序列和结构域信息,在NCBI的资源库中对多个物种的CD209蛋白进行选择,然后采用ClustalX 2.0、GeneDoc和DNAMAN进行多重序列比对分析,采用MEGA 5.0软件构建系统发育树。
1.2.4OnCD209基因的组织表达 从实验室暂养的健康尼罗罗非鱼中随机抽取5尾,于无菌条件下进行解剖,分别取肝脏、脾脏、头肾、鳃、肠道、胸腺、皮肤、肌肉、血液和脑10个组织,分别放入无RNA酶的2 mL EP管中进行组织研磨后,提取RNA并反转录成cDNA,方法同“1.2.2节”。采用RT-qPCR法检测10个组织CD209基因的表达情况,设计一对荧光定量引物(qCD209-F: TGTTTACTCCTCTTGGCTGGTG,qCD209-R: AGCT- TATCTGCGTATCCCGTTT)。PCR反应体系(共10 μL):Mix 5.0 μL,ddH2O 3.5 μL,cDNA模板 0.5 μL,qCD209-F/R各0.5 μL。反应程序为:95 ℃下预变性30 s;95 ℃下循环变性15 s,60 ℃下退火复性15 s,72 ℃下延伸20 s,共进行30个循环。对每份样品的CD209和β-actin表达量进行检测,每个样品设置3个重复,采用2-ΔΔCT法计算基因相对表达量[14]。
1.2.5 无乳链球菌刺激后OnCD209基因的组织表达 采用RT-qPCR法(使用罗氏Light Cycler 96实时荧光定量PCR仪)检测注射无乳链球菌后OnCD209基因的表达量。病原刺激如下:将-80 ℃下保存的无乳链球菌解冻后取出1.5 mL接种于100 mL的BHI培养基中,于37 ℃条件下培养至OD600 nm为1.0后,收集于离心管内,用PBS悬浮细菌浓度至1×107CFU/mL,而后吸取100 μL菌液对尼罗罗非鱼进行腹腔注射。在注射后0、6、12、24、48、72、96 h采集组织样本,并进行RNA提取和cDNA合成,方法同“1.2.2节”。然后以合成的cDNA为模板,分别对所提取的组织样品进行RT-qPCR检测,反应体系和反应程序同“1.2.4节”。对每份样品CD209和β-actin表达量进行检测,每个样品设置3个重复。
1.2.6OnCD209在293T细胞中的亚细胞定位 设计一对引物(CD209-pEGFP-N1-F:CCGGAATTCTATGAGTGTCGAGTACCATG,CD209-pEGFP-N1-R:CGGGGTACCCTACATCTCACAGATCCAG),以尼罗罗非鱼的脾脏cDNA为模板进行基因克隆,PCR产物纯化后,使用相同的限制性快切酶对PCR产物及pEGFP-N1进行双酶切处理,酶切产物纯化后使用T4连接酶进行产物与载体连接,然后转入DH5α感受态细胞中,涂板挑菌,将阳性菌落送至广州生工生物有限公司进行测序,测序正确的菌液进行去内毒素质粒提取。
将293T细胞接种于12孔细胞培养板内,当细胞增殖至密度为80%~90%时,根据Lip3 000使用说明书,将构建好的CD209-pEGFP-N1或pEGFP-N1表达载体转染至细胞内。将酒精浸润的圆形盖玻片于火上烤至干燥后放入12孔板内,使用胰酶对转染24 h的细胞进行消化处理后,加入培养基混合物(10%的胎牛血清、1%的青霉素链霉素混合液及M199培养基)悬浮细胞并转入含盖玻片的细胞培养板内,试验设3个重复。培养5 h后,使用体积分数4%的多聚甲醛固定细胞,30 min后吸取固定液并加入PBS洗涤,取出盖玻片反盖于滴有1~2滴含DAPI封片剂的载玻片上。封片完毕后于荧光显微镜下观察拍照。
1.2.7 双荧光素酶活性分析 设计一对引物(CD209-pcDNA3.1-F:CCGGAATTCGCCACCATGAGTGTCGAGTACCATG,CD209-pcDNA3.1-R:CCCAAGCTTCATCTCACAGATCCAG),构建OnCD209-pcDNA3.1过表达载体,方法同“1.2.6节”。将293T细胞接种于12孔板内,按照Lip3000使用说明书将启动子报告质粒(200 ng)、内参质粒PRL-TK(4 ng)及CD209-pcDNA 3.1或pcDNA 3.1质粒(250 ng)共转染至细胞内,24 h后收取细胞培养物,试验设3个重复。使用碧云天生物公司的双荧光素酶报告基因检测系统检测萤火虫荧光素酶与海肾荧光素酶活性。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 17.0软件进行最小显著性差异(LSD)检验,显著性水平设为0.05。
2 结果与分析
2.1 OnCD209基因的克隆及其推导的氨基酸序列
利用聚合酶链式反应扩增了尼罗罗非鱼CD209基因的ORF区(图1),命名为OnCD209(GenBank登录号:XP_003448039.1)。OnCD209基因的ORF区片段长度为1 383 bp,编码460个氨基酸,预测蛋白相对分子质量为53 270,理论等电点为5.04。用SMART保守结构域在线软件预测该蛋白为一个跨膜蛋白,该蛋白存在一个C型凝集素结构域(C-type lectin domain,CTLD)(图2)。用SignalP 4.1预测该蛋白的氨基酸序列第1~29位为CD209的信号肽区。用TMHMM 2.0预测该蛋白在N端1~42氨基酸残基之间对应一个胞内区,在43~65氨基酸残基之间为一个跨膜区,在66~460氨基酸残基之间对应一个胞外区(图1)。用PSITE预测该蛋白存在8个糖基化位点,1个糖胺聚糖附着位点,2个cAMP和cgmp依赖的蛋白激酶磷酸化位点,8个磷酸化位点,11个酪蛋白激酶Ⅱ磷酸化位点,2个酪氨酸激酶磷酸化位点,5个酰基化位点,1个Prenyl基团结合位点(CAAX box),6个微体C端定位信号,1个C型凝集素域信号和9个亮氨酸拉链模式。

加粗部分为起始密码子(ATG)和终止密码子(TAG);加下划线部分为C型凝集素结构域。

图2 尼罗罗非鱼CD209保守结构域预测
2.2 OnCD209氨基酸同源性比较及系统进化分析
OnCD209氨基酸序列与其他已知脊椎动物的CD209、CD209-like及C型凝集素的多重比对显示,其均具有一个C型凝集素保守结构域,经BlastX比对显示,尼罗罗非鱼CD209与斑马鱼DaniorerioC型凝集素家族4成员M(C-type lectin domain family 4 member M)的氨基酸序列一致性最高(90.34%),与高等脊椎动物人、猕猴、牛、猪的CD209一致性较低(14.86%~20.04%)(图3)。进化树分析显示,尼罗罗非鱼CD209氨基酸序列与田纹狮子鱼LiparistanakaeCD209聚为一大支,亲缘关系最近,且鱼类的CD209聚为一支,高等哺乳动物的CD209聚为另一支(图4)。

方框示C型凝集素保守结构域。

图4 尼罗罗非鱼CD209氨基酸序列聚类分析
2.3 OnCD209基因的组织表达
使用实时荧光定量PCR法检测了健康尼罗罗非鱼组织中的CD209基因表达情况。从图5可见:OnCD209 mRNA在所有组织中均被检测到,其中,在脑中微量表达,在血液、皮肤和肌肉中高表达,在头肾和肠道中较高表达,而在鳃、肝脏、脾脏和胸腺中的表达水平相似,血液、皮肤、肌肉、头肾、肠道、鳃、肝脏、脾脏和胸腺中CD209基因的表达量分别为脑中的8.57、8.37、8.04、4.18、3.58、2.38、2.27、1.59、1.42倍。

*表示与脑组织的表达量相比有显著性差异(P<0.05)。
2.4 无乳链球菌刺激后OnCD209基因的组织表达
为了分析细菌感染对CD209基因表达的影响,用无乳链球菌感染尼罗罗非鱼,检测了被感染6、12、24、48、72、96 h后尼罗罗非鱼肝脏、脾脏、头肾和肠道中CD209基因的表达情况。结果显示,罗非鱼肝脏和头肾中CD209的表达量均在6、72、96 h时显著上调(P<0.05),脾脏中的表达量在6 h和72 h时显著上调(P<0.05),肠道中的表达量在6、48、72 h时显著上调(P<0.05),在肝脏、头肾、脾脏和肠道中的最高表达量分别为对照组的1.26、2.43、1.33和5.83倍(图6)。
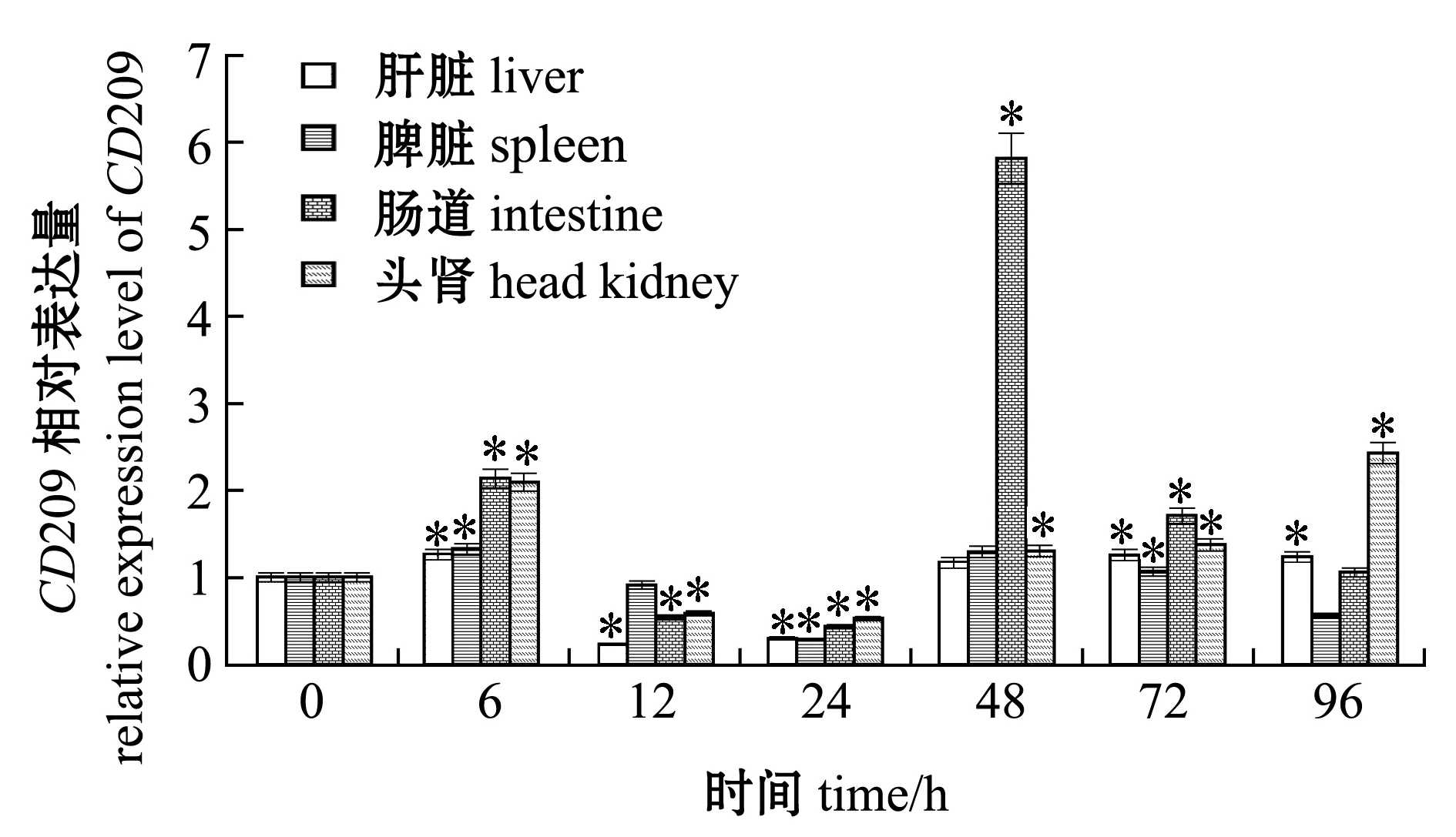
*表示与0 h的表达量相比有显著性差异(P<0.05)。
2.5 OnCD209基因的亚细胞定位分析
将构建的绿色荧光标签载体OnCD209-pEGFP-N1与空载pEGFP-N1分别转染入293T细胞,经DAPI染色后结果如图7所示,pEGFP-N1均匀地分布于整个细胞内,而OnCD209-pEGFP-N1主要分布于胞膜上,与预测结果相符合。

A1和B1分别为OnCD209-pEGFP-N1、pEGFP-N1细胞核DAPI染色;A2和B2分别为OnCD209-pEGFP-N1、pEGFP-N1的绿色荧光蛋白;A3和B3为细胞核与绿色荧光蛋白叠加。
2.6 过表达OnCD209基因对NF-κB活性的影响
使用细胞转染和双荧光素酶报告基因检测系统研究了OnCD209在信号转导中的作用,结果显示,在293T细胞中过表达OnCD209基因能增强NF-κB通路的活性(图8)。
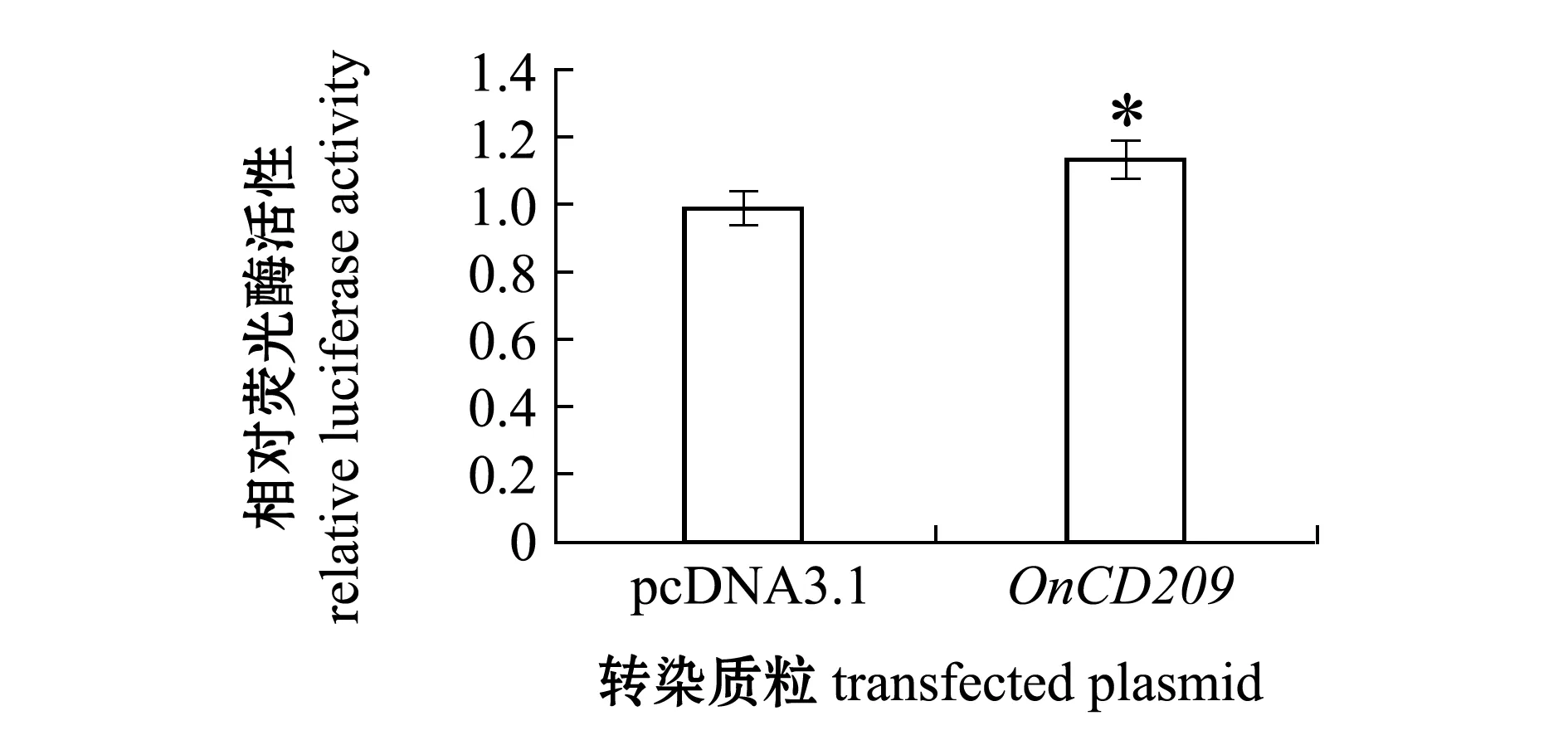
*表示组间有显著性差异(P<0.05)。
3 讨论
3.1 OnCD209分子结构分析
CD209(DC-SIGN)是C型凝集素受体家族的重要成员之一,是先天免疫中识别和清除病原体的关键分子[15],在人类中,CD209主要在促炎性细胞因子的巨噬细胞群上表达,在激活炎症免疫反应中发挥重要的作用[16-17]。CD209在人类、灵长动物及小鼠中的同源物已被鉴定出来,然而在鱼类的研究中了解较少。为了深入了解鱼类CD209基因,本研究中首次获得了尼罗罗非鱼CD209的开放阅读框序列,其片段长度为1 383 bp,可编码461个氨基酸,预测OnCD209是一个含有胞浆外区、跨膜区和胞内区的跨膜蛋白,在其胞浆外区含有一个C型凝集素特有的CTLD。氨基酸多重序列比对结果表明,尼罗罗非鱼CD209氨基酸序列与半滑舌鳎、人和小鼠的CD209亚型具有中等一致性,为33%~35%[18]。然而,本研究中尼罗罗非鱼CD209氨基酸序列与人、猕猴等高等哺乳动物的CD209氨基酸序列一致性不高,仅为14.86%~20.04%,这表明CD209在高等与低等脊椎动物间功能比较分化,相对不保守。系统进化分析表明,CD209氨基酸序列在高低等脊椎动物进化上联系密切,尼罗罗非鱼CD209与田纹狮子鱼聚为一支,而与斑马鱼等同为低等脊椎动物的物种聚为不同分支,这表明CD209在进化上也相对不保守。
3.2 OnCD209基因的组织表达分析
本研究表明,OnCD209基因在所有受检的组织中均有分布,在血液、皮肤和肌肉中表达量较高,其次是头肾、肠道,在脑中表达量最低。血液内的血循环是复杂的固有免疫和适应性免疫反应的交汇场所,而固有免疫反应是机体防御致病原入侵血循环的第一道防线,但血液固有免疫反应必须得到精确适当的调控才能消灭病原菌[19-20],同CD209基因在半滑舌鳎中的表达模式相似[12],CD209基因在尼罗罗非鱼的脑组织中有表达,推测CD209参与了血液固有免疫反应的调节。而众所周知,皮肤是鱼类黏膜免疫系统的第一道屏障,极易感染[21],且OnCD209基因在肌肉组织中也大量表达,表明其在免疫和非免疫组织中均有潜在的作用。
3.3 无乳链球菌感染后OnCD209基因的表达变化
本研究表明,无乳链球菌侵染后,CD209在尼罗罗非鱼肝脏、脾脏、头肾和肠道中的表达模式具有相似的变化趋势,均在6 h时表达量明显上调,在12 h和24 h时表达量明显下调,之后在48 h时表明量再次上调,其中,表达量显著性下调可能是无乳链球菌感染12 h和24 h时造成了尼罗罗非鱼机体紊乱,使CD209表达受到抑制。肝脏具有非特异性吞噬的免疫功能[22],且CD209主要表达于巨噬细胞表面,本研究中尼罗罗非鱼肝脏中CD209表达量在感染后显著上调,可能是CD209参与了巨噬细胞的吞噬作用;无乳链球菌感染后,在尼罗罗非鱼脾脏和头肾中也能观察到CD209表达量显著上调,这可能是因为脾脏和头肾是鱼类的两个主要造血器官,也是无乳链球菌攻击的主要靶器官[23];肠道是属于黏膜免疫系统的组成之一,是执行局部特异性免疫功能的主要场所[24],OnCD209在肠道中显著上调,表明其在鱼体抵御病原体的入侵过程中发挥重要作用。以上结果表明,OnCD209可能参与了鱼体抗细菌感染的免疫途径。
3.4 OnCD209基因的亚细胞定位分析
研究表明,哺乳动物的CD209是一种特异表达于树突状细胞和巨噬细胞表面的跨膜蛋白[25-26],主要于细胞膜表面表达。本研究中将OnCD209-pEGFP-N1重组质粒转染293T细胞,发现其主要定位于细胞膜中,这与前人的研究结果相同,表明同哺乳动物的CD209相同,尼罗罗非鱼的CD209也在细胞膜中发挥其免疫调控作用。
3.5 OnCD209基因对NF-κB信号通路的影响
NF-κB是一种蛋白复合物,参与调控DNA的转录、细胞因子的产生及细胞的存活[27]。NF-κB信号通路在免疫和炎症中起到重要作用,能够通过细胞因子、黏附因子、酶、受体等多个方式参与炎症反应[28-29]。树突状细胞上表达的不同的模式识别受体,能识别入侵的病原体,导致细胞内信号传导过程的激活,从而激活适应性免疫。已有研究表明,CD209(DC-SIGN)与不同甘露糖表达的病原体,如结核分枝杆菌和HIV-1相互作用,被CD209识别后,会触发Raf-1依赖的信号通路,调节TLR诱导的NF-κB信号的激活[30]。本研究中,通过转染OnCD209真核表达质粒至293T细胞内,并采用双荧光素酶报告系统检测了尼罗罗非鱼CD209对NF-κB信号通路的影响,结果表明,293T细胞内过表达时OnCD209基因对NF-κB通路活性有显著上调作用,这与前人研究结果相符。
4 结论
1)本研究中成功克隆了尼罗罗非鱼CD209基因的ORF序列,预测CD209蛋白具有一个保守的C型凝集素结构域,且在不同物种间相对不保守。
2)在健康尼罗罗非鱼的各个组织中均能检测到OnCD209 mRNA,其中,血液中CD209 mRNA表达量最高。
3)OnCD209在无乳链球菌感染后的体内表达呈现先上调后下调再上调的表达模式,表明OnCD209可能参与了抗细菌感染的免疫途径。
4)OnCD209定位于细胞膜,且在293T细胞中过表达时能显著增强NF-κB的活性。
