富血小板血浆可减轻大鼠急性心肌缺血-再灌注损伤
2021-06-16王德奖徐颖怡杨雪雯何铭垣张智勇
王德奖 ,李 挺 ,徐颖怡 ,杨雪雯 ,何铭垣 ,张智勇 ,吴 炜,燕 翼
广州医科大学1附属第三医院心血管内科,2再生医学与3D打印转化研究中心,广东 广州 510150;3南方医院器官衰竭防治国家重点实验室,广东 广州 510515;4南方医科大学病理生理学教研室//广东省医学休克微循环重点实验室,广东 广州510515
冠心病是世界范围内困扰人类健康的最高发心血管疾病,目前临床上最有效的治疗策略是通过溶栓或经皮冠状动脉介入治疗恢复对缺血心肌的再灌注,以减轻急性心肌缺血性损伤[1]。然而心肌再灌注本身会导致进一步的心肌细胞死亡,这种现象被称为心肌再灌注损伤[2-3]。尽管随着经皮冠状动脉介入治疗技术的进步以及抗血小板、抗血栓药物的发展,心肌再灌注过程不断改善,但目前尚无有效的预防心肌再灌注损伤的治疗方法。
PRP 最初称为浓缩血小板,其历史可以追溯到1970年代[4]。血小板中富含多种细胞因子,包括转化生长因子-β(TGF-β),血小板衍生生长因子(PDGF),胰岛素样生长因子(IGF),成纤维细胞生长因子(FGF),表皮生长因子(EGF),血管内皮生长因子(VEGF)和内皮细胞生长因子(ECGF)等,这些细胞因子在细胞增殖、趋化性、细胞分化和血管生成中起重要作用[4-5]。已证明PRP在肌腱和肌肉修复中发挥积极作用,增强血管生成,并诱导修复细胞向注射部位迁移[6-9]。基于PRP对骨骼肌组织的强大修复作用,我们推测PRP是否对心肌再灌注损伤同样具有保护作用。已有文章报道PRP在大动物心肌梗死模型中,可以促进血管生成,减缓心脏重塑和改善心功能的作用[10],但尚未发现PRP与急性再灌注损伤治疗的相关报道。AMP依赖的蛋白激酶(AMPK)已经有许多研究发现与减轻心肌缺血-再灌注损伤密切相关[11-12],而VEGF又与AMPK的激活有关[13],同时PDGF、VEGF、FGF和EGF又可以减轻心脏缺血相关损伤[13-16],考虑到PRP中存在的大量生长因子,我们认为二者可能存在潜在的联系。
基于PRP的诸多优点,本研究分别对离体心肌细胞进行缺氧/复氧(H/R)处理、并采用大鼠建立急性缺血-再灌注损伤模型,通过比较生理盐水和PRP的治疗效果及产生的分子生物学效应,解析PRP对缺血心肌组织可能的保护机制。
1 材料和方法
1.1 实验动物
SPF级健康成年SD大鼠50只,雄性,体质量180~220 g,购自广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002。购回后每5只饲于1笼,让动物自由摄食、饮水,12 h/12 h明暗交替环境,温度20~22 ℃,湿度50%~60%,适应3 d 后进行试验。本研究经广州医科大学附属第三医院动物伦理委员会批准。
1.2 试剂及仪器
BCA试剂盒(Bioworld);CCK-8试剂盒(Dojindo);PDGF-BB 和TGF-β1 Elisa 试剂盒(CUSABIO);10%CaCl2、0.25%胰蛋白酶、0.2%胶原酶II、DNA 酶均(北京 索莱宝);PE-CD86 抗体、FITC-CD206 抗体均(BioLegend);大鼠肌钙蛋白I(Elabscience);AMPKα抗体、Phospho-AMPKα Thr172抗体、β-actin抗体和二抗(CST);Sarcomeric Alpha Actinin 抗体和Donkey Anti-Rabbit IgG H&L(Alexa Fluor®647)抗 体 自(Abcam)。
1.3 PRP的制备
将10只雄性SD大鼠按50 mg/kg腹腔注射戊巴比妥钠溶液麻醉。用含3.8%柠檬酸钠的真空管采集腹主动脉血,全血/柠檬酸比为9∶1,然后离心3次。第1次1000g离心15 min。将稀薄的红细胞层及以上的部分转移到另一个离心管中,然后在300g的条件下离心5 min。将红细胞上方的上清液小心地转移到另一个离心管中,这一步将去除大部分红细胞,提高PRP的纯度。最后1次1200 g,10 min离心,保留底部PRP,按全血/PRP=10/1 的比例去除多余的上清液(platelet-poor plasma,PPP),将全血、上清和PRP 送入检验科进行血小板计数,SD大鼠全血血小板计数为560×109±35×109/mL,PPP计数为(30±5)×109/mL。利用PPP将PRP中的血小板颗粒统一稀释至(3000±35)×109/mL,室温下用10%CaCl2激活4 h 后,用0.22 μm 过滤嘴过滤,分装-80 ℃保存。
1.4 PDGF-BB和TGF-β1的测定
血小板被激活后,α颗粒中的各种生长因子和细胞因子被释放。为了确定我们制备的PRP的有效性,我们使用了酶联免疫吸附试剂盒检测了大鼠全血和激活后PRP中PDGF-BB和TGF-β1的浓度。
1.5 心肌细胞的分离
如前所述,从1~3 d大的SD大鼠的心室中制备新生大鼠心肌细胞的原代培养物[17]。从新生大鼠中无菌取出心室组织,切碎,然后在37 ℃的振荡浴中用混合蛋白酶(0.25%胰蛋白酶,0.2%胶原酶II,100 μg/mL DNA酶I和D-Hanks溶液)消化。第1次消化后释放细胞,然后将消化后的细胞添加到补充有10%胎牛血清的相同体积的Dulbecco改良的Eagle培养基(DMEM)中,直至收集所有细胞。通过以1200 r/min离心5 min来沉淀细胞,并重悬于补充有10%胎牛血清的DMEM中。最后,将分离的细胞置于含有95%空气和5%CO2的培养板中,并在37 ℃下培养1 h 15 min以排除非心肌细胞。然后收集悬浮细胞,并以1×105/孔接种于96孔板和3×106/孔接种于6孔板上,并保持在与上述相同的培养条件。2 d后在以下实验中使用心肌细胞。
1.6 心肌细胞缺氧/复氧方案和分组
将培养的心肌细胞进行H/R以模拟体内心肌缺血-再灌注损伤。为了诱导缺氧,将心肌细胞培养基替换为不含胎牛血清的无糖培养基,然后转移到95%N2和5%CO2的三气培养箱中(Thermo Fisher)。缺氧3 h后,向培养皿中加入不同体积含量的PRP(1%、5%、10%、20%),Control组为生理盐水,并转移至装有95%空气和5%CO2的常氧培养箱中进行12 h的复氧。
1.7 细胞活力/细胞增殖测定
根据制造商所提供的CCK8说明书检测各组细胞活力。向96孔板的每个孔中加入10 μL CCK-8溶液,然后在37 ℃下孵育2 h。使用酶标仪在450 nm波长处测量各孔的光密度。
1.8 心肌细胞的免疫荧光
在不同组中处理后,将细胞用PBS洗涤两次。然后使用4%多聚甲醛固定15 min。再次用PBS洗涤后,将溶解在包含0.3%Triton X-100和10%山羊血清的复合物中的一抗Sarcomeric Alpha Actinin(1∶800)于4 ℃过夜。再次洗涤细胞,并在室温下用二抗-驴抗兔Alexa Fluor 647(1∶500)处理30 min。为了观察细胞核,最后将固定的细胞与4',6-diamidino-2-phenylindole(DAPI)孵育10 min。
1.9 蛋白质印迹
用BCA 试剂盒对细胞裂解液进行定量,然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将其印迹在硝酸纤维素膜上。将膜与抗体AMPKα、Phospho-AMPKα Thr172和β-actin 4度过夜孵育,第二天洗膜后和二抗室温孵育1 h,再次洗膜后在ChemiDoc MP采集系统(Bio-Rad)上用Clarity Western ECL底物进行化学发光检测。
1.10 划痕实验
大鼠主动脉内皮细胞系(RAOECs)购自美国模式培养物集存库(ATCC),以1×106/孔的密度接种于6孔板中。贴壁8 h后,使用200 μL枪头尖端产生细胞单层划痕。用Zeiss倒置显微镜观察拍照,每3 h拍照1次,观察12 h。使用非迁移面积除以基线面积之比来计算迁移效果。
1.11 动物缺血-再灌注模型建立及分组
大鼠用戊巴比妥钠(40 mg/kg)麻醉后气管插管,机械通气,左胸骨旁切开显露心脏,左冠状动脉前降支(LAD)区域进针,在缝线上放置圈套,收紧圈套,造成局部心肌缺血30 min,恢复再灌注后,立刻在结扎区周围4个部位注射100 μL 的生理盐水(Control 组)或PRP(PRP组)。1 d后后各组取6只大鼠使用戊巴比妥钠麻醉处死,收集心脏及血液上清,剩余大鼠于1周后进行心功能检测。
1.12 TTC染色
在再灌注24 h后,将大鼠麻醉通过腹主动脉采集血液后,取下心脏并用生理盐水灌流冲洗心脏内血液,之后将心脏组织连续切成4~5片,厚度为1 mm,将其与1%2,3,5-三苯基四唑氯化物(TTC)37 ℃水浴20 min,然后在4%多聚甲醛中固定,翌日行体视显微镜拍照。
1.13 肌钙蛋白I(Troponin I)测定
再灌注24 h候后收集Control组和PRP组动物的血清,通过酶联免疫法测量肌钙蛋白I的浓度。
1.14 超声心动图评估左心室结构和功能
使用Vevo 2100 高分辨率体内成像系统(Visual Sonics,Toronto,ON,Canada)在心肌缺血造模前获得超声心动图图像。缺血-再灌注损伤1周后,再次进行超声测量和分析。
1.15 组织病理学染色
超声心动图评估后处死大鼠,依次用生理盐水和10%多聚甲醛清洗心脏后,将心脏置于10%多聚甲醛溶液中室温固定24 h。石蜡包埋心脏组织,切成4 μm切片,苏木精-伊红(HE)染色。
1.16 流式细胞术
RAW264.7细胞(购自ATCC)缺氧3 h后,加入生理盐水或1%体积PRP 复氧培养24 h,按照标准方案进行免疫染色,并使用1%牛血清白蛋白(BSA)阻断非特异性抗体结合。PE-CD86(1∶100,BioLegend,105007)和FITC-CD206(1∶100,BioLegend,141703)用于标记M1 和M2 亚群。使用Accuri C6 流式细胞仪(BD Biosciences)分析细胞,每个样品至少分析10 000个细胞。使用BDAccuri C6 Plus软件分析结果。
1.17 统计学分析
使用SPSS 19.0统计学软件进行统计学分析,组间比较采用成组t检验,多组间比较采用单因素方差分析,箱线图表示整体数据,其他图形数据用均数±标准差表示,P<0.05认为差异有统计学意义。图片的采集和处理 使 用Graph Pad Prism5.0、Image Pro Plus6.0 及MetaMorph7.1.3.0软件。
2 结果
2.1 PRP中PDGF-BB和TGF-β1浓度显著高于全血浓度
酶联免疫吸附实验结果显示PRP中PDGF-BB和TGF-β1的浓度显著高于全血(图1A、B,P<0.01),PRP的有效成分及浓度符合实验条件要求[4]。

图1 大鼠PRP和全血中相关因子的浓度Fig.1 Concentrations of PDGF-BB(A)and TGF-β1(B)in rat PRP and whole blood(n=6).**P<0.01.
2.2 PRP显著减少H/R造成的心肌死亡,效应与AMPK的活性增强相关
体外利用H/R模拟体内缺血再灌住损伤,细胞活力检测发现,与Control组相比,PRP显著减少了复氧损伤造成的心肌细胞死亡。我们发现1%体积PRP时心肌细胞活力最高(图2A)。同时对心肌细胞进行了免疫荧光染色(图2B),结果显示PRP 组存活细胞显著多于Control组(177.2±7.43vs69±4.95,P<0.001,图2C)。我们提取了两组心肌细胞的蛋白,并检测AMPK及其磷酸化水平,结果显示在AMPK的表达上两组无明显差异,而PRP组检测到AMPK发生了磷酸化,Control组却并未检测到明显磷酸化反应的发生(图2D)。
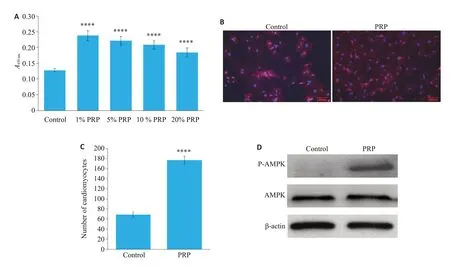
图2 PRP对缺氧-复氧心肌细胞活力的影响Fig.2 Effect of PRP on viability of cardiomyocytes with hypoxia/reoxygenation injury.A:Viability of the cardiomyocytes treated with different proportions of PRP for 12 h after 3 h of hypoxia,with saline as the control(n=4).B:Immunofluorescence staining of the cardiomyocytes treated with saline or 1%PRP(blue shows DAPI staining and red sarcomeric α-actinin).C:Quantitative analysis of the cardiomyocytes (in 5 randomly selected fields of view).D:Western blotting for detectingAMPK and its phosphorylation in the cardiomyocytes.****P<0.001 vs control group.
2.3 PRP促进RAOECs的增殖与迁移
RAOECs以8000/孔接种于96孔板,过夜后第2天分别给予生理盐水(Control组)和1%体积的PRP(PRP组),12 h后检测细胞活力,与Control组相比PRP处理组的RAOECs显著增殖(图3A,P<0.001)。同时划痕实验发现PRP处理组的RAOECs在12 h明显迁移(图3B、C,P<0.001)。

图3 PRP对RAOECs增殖和迁移运动的影响Fig.3 Effects of PRP on proliferation and migration of RAOECs.A:Viability of the endothelial cells treated with saline or PRP for 12 h(n=4).B,C:Migration test of the endothelial cells(n=5).****P<0.0001 vs control group.
2.4 PRP治疗减轻冠脉缺血-再灌注大鼠的心肌损伤和梗死面积
冠脉前降支缺血-再灌注24 h后,收集Control组和PRP组的血清,检测肌钙蛋白I的表达水平。结果发现PRP 组的肌钙蛋白I 的浓度明显低于Control 组(P<0.001,图4A)。心脏TTC染色显示PRP组梗死面积明显低于Control组(P<0.001,图4B、C)。
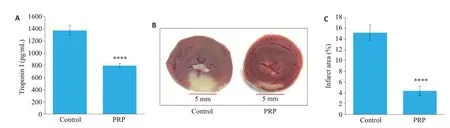
图4 PRP对缺血-再灌注损伤动物肌钙蛋白I和梗死面积的影响Fig.4 Concentration of troponin I and cardiac infarct size in the rats.A:Serum troponin I level in the control group and PRP group at 24 h after reperfusion (n=5).B:TTC staining of the cardiac tissues in the control group and PRP group at 24 h after reperfusion.C:Quantification of the infarct size(percentage of the infarct area in the entire heart section)(n=6).****P<0.001 vs control group.
2.5 PRP治疗明显改善心肌缺血-再灌注损伤动物的心功能
分别术前和术后1周检测大鼠心功能,与术前相比,术后EF 明显减低,LVIDs 和LVIDd 均明显扩大,动物心功能明显下降。术后1周,相比于Control组,PRP治疗组心功能显著改善。射血分数(EF)(P<0.001,图5B)、左室收缩末期内径(LVIDs)(P<0.001,图5C)、左室舒张末期内径(LVIDd)(P=0.009,图5D)均显著改善。

图5 PRP对心肌缺血-再灌注损伤大鼠心功能的影响Fig.5 Effect of PRP on left ventricular function in rats after myocardial-ischemia reperfusion.The cardiac function of rats was measured before operation and one week after reperfusion,Representative M-mode echocardiography (A),EF (B),LVIDs (C)and LVIDd(D)at 1week(n=8).****P<0.001 or ***P<0.001 vs Baseline group,**P<0.01.
2.6 PRP通过调控巨噬细胞M1/M2型极化,减轻再灌注损伤心肌的急性炎症反应
动物HE染色(图6A)显示,对照组心肌细胞明显肿大,排列杂乱,部分心肌纤维出现断裂,可见明显大片的炎性细胞浸润;而PRP组心肌细胞略肿大,排列稍杂乱,心肌纤维断裂较对照组明显减少,炎性细胞浸润面积显著减小。
我们使用了RAW264.7细胞检测不同刺激条件下M1/M2巨噬细胞的极化情况。结果显示H/R后生理盐水处理组M1型巨噬细胞(CD86)显著增加,而相比于生理盐水处理组,PRP处理组M1型巨噬细胞明显减少(4.425±0.602vs7.6±0.804,P=0.002,图6B、D)。同时检测M2型巨噬细胞(CD206)发现,单纯生理盐水处理后M2 型巨噬细胞数目较少,而PRP 处理后M2 型巨噬细胞显著增多(2.65±0.342vs0.65±0.208,P<0.001,图6C、E)。PRP处理组M1/M2比值较对照组明显降低。

图6 PRP对炎症免疫调节机制的影响Fig.6 Immunomodulatory effects of PRP on polarization of the macrophages.A:HE staining of the macrophages at 1 week.B,C:Flow cytometry of M1 and M2 macrophages,respectively.D,E:Quantitative histogram of M1 and M2 macrophages,respectively(n=4).****P<0.001 OR***P<0.001 or**P<0.01 vs No H/R group.
3 讨论
再灌注损伤一直是急性冠脉综合征治疗中亟待解决的临床难题,有证据表明,心肌通过合成和响应多种应激诱导的生长因子和细胞因子来适应局部缺血/再灌注,识别这些因子构建的炎症内环境稳态机制可能为限制缺血/再灌注损伤开辟新的途径[18-19]。
在细胞H/R实验试验中,PRP明显减少了复氧所导致的心肌细胞死亡,而动物实验也再次证实了这个观点。PRP主要成分是多种生长因子,我们检测了PRP中PDGF-BB和TGF-β1的水平,结果发现浓度远高于全血,这些增高的生长/炎症因子可能对再灌注损伤心肌发挥了重要的保护作用。有学者发现在PDGF-AB和-BB配体在微血管和心肌细胞存活、内皮修复、血管稳定性、炎症抑制以及心肌细胞收缩功能中起关键作用[20-21]。而TGF-β1在心肌梗死后愈合发挥关键作用,TGF-β1可以通过经典(Smad3)和非经典(ERK1/2和Akt)信号通路阻止模拟缺血-再灌注引起的心脏成纤维细胞凋亡[23],也有文章报道TGF-β1不利于远期预后,考虑心脏是多种细胞集合的器官,我们认为在再灌注损伤所造成非心肌细胞的死亡也是不利的,应该尽可能减少再灌注时心脏组织的损伤和凋亡,对于TGF-β1可能存在远期不良,需要构建慢性模型进一步研究。我们虽只测量了PRP中PDGF-BB和TGF-β1,但PRP中生长因子远不止这些,FGF、VEGF和EGF也都大量存在[24]且与再灌注损伤密切相关,这些因子同样可以减轻心脏缺血-再灌注损伤[13,15-16,25]。
此外,本研究还检测了心肌细胞中AMPK及其磷酸化水平。结果发现PRP组发生了AMPK的磷酸化现象。众所周知AMPK与能量代谢密切相关,已经有实验报道心肌缺血再灌注时AMPK激活可以减少心肌细胞凋亡[26],在AMPK敲除小鼠心脏进行缺血-再灌注后细胞凋亡和功能障碍增加[27],这也说明了PRP保护作用可能与AMPK 激活有关。同时AMPK 的激活导致eNOS磷酸化并产生NO[28],NO具有多种多种心血管保护效应。本研究也发现经PRP处理组RAOECs增殖和迁移都显著增强,内皮细胞与血管形成密切相关,缺血部位血管密度增高不仅可以改善远期心功能,也可以减轻纤维细胞引发的不良重塑。
缺血-再灌注模型构建1周后,PRP组相比于生理盐水组心功能显著改善,HE染色显示生理盐水组存在大片的炎性细胞浸润,而PRP组炎性细胞浸润明显减少。受伤组织的修复取决于炎症免疫调节的程度和进程,特别是对炎症损伤的抑制作用。该过程伴随着恢复组织完整性的间充质细胞的活化。促炎信号的抑制不是一个被动过程,而是需要诱导抑制分子和激活抑制途径[29]。在受损组织中,过度活跃、持续或空间扩张的炎症反应会导致更严重的损伤和功能障碍,受损心脏的炎症抑制缺陷可能会产生灾难性的后果,包括心肌细胞的丧失、收缩功能的抑制、基质降解所致的房室扩张、组织分解增加,以及将纤维化改变扩展到了最初的梗塞范围之外[30]。炎症反应的抑制受损,过度活跃的炎症信号导致心肌梗死后左心室扩张增加[31-32]。有证据表明,巨噬细胞的吞噬活性对于调节其表型和抑制炎症反应具有重要意义。巨噬细胞对凋亡细胞的有效清除(称为胞吐)激活了促分解信号,这可能有助于炎症向修复的转变。巨噬细胞中酪氨酸蛋白激酶Mer的诱导似乎对心肌细胞胞吐和随后抑制梗死后炎症反应具有重要意义[33]。MI型巨噬细胞主要在炎症初期产生大量促炎因子TNF-α、IL-12及iNOS,而过度的炎症反应对于心肌修复是不利的,需要及时抑制M1细胞从而向增殖期过度[30],此时M2型巨噬细胞很好抑制了炎症,减少炎症所导致不良结果[34-35]。本研究发现PRP处理后炎性细胞浸润面积和M1巨噬细胞减少,而M2型巨噬细胞增多,这种巨噬细胞介导的免疫调节作用是PRP组心功能改善的原因之一。
总之,本研究发现PRP对于急性缺血-再灌注损伤心肌具有保护作用,这与AMPK的激活和M1/M2型巨噬细胞极化可能有关。考虑到PRP自体来源的安全性,这或许会为心肌缺血-再灌注治疗提供新的思路。但本研究也存在一定局限性,由于PRP成分混杂,我们并未具体确定哪些生长因子发挥了主要作用,以及在AMPK激活之外其他可能存在的心肌保护通路,这些问题我们都会在接下来进一步探索。
