靶向卵巢癌细胞的miR-16/多肽纳米递释系统的制备及其功能验证
2021-06-16黎权辉岑柏宏陈佳扬陈章浦庞建新付卫明季爱民
黎权辉 ,岑柏宏 ,黄 文 ,陈佳扬 ,陈章浦 ,庞建新 ,付卫明,贺 帅,季爱民
1南方医科大学药学院,广东 广州 510515;2广州医科大学附属肿瘤医院放疗科,广东 广州 510095;3南方医科大学附属南海医院药剂科,广东 佛山 528200;4南方医科大学珠江医院药学部,广东 广州510282
MicroRNA是一类长度为20~24个核苷酸的非编码单链RNA分子,由内源基因编码,在进化上高度保守,在动植物体内参与转录后基因表达调控[1-2]。已有大量研究表明,miRNA在多种癌症组织中有异常表达,通过调控肿瘤相关信号通路,影响肿瘤的发生、发展过程[3-5]。其中,miR-16被证明可分别通过调控Smad3与MYCN的表达,抑制脊索瘤细胞以及神经细胞瘤的增殖与侵袭[6-7],也可通过下调Wnt/β-catenin信号通路,抑制人卵巢癌细胞的增殖、侵袭与转移[8]。此外,研究发现多种miRNA具有逆转肿瘤耐药性的作用[9-11],如miR-16可逆转人卵巢癌细胞和胃癌细胞的顺铂耐药性,也可增强神经胶质瘤细胞对放化疗的敏感性[12-14]。除此以外,有研究发现在前列腺癌细胞以及恶性胸膜间皮瘤细胞中过表达miR-16后,均可阻断细胞中PD-L1的表达,同时增强细胞对放疗的敏感性[15-16]。综上所述,miR-16分子具有极高的肿瘤治疗转化前景。但miRNA分子安全、有效的肿瘤靶向给药系统的缺乏是其进一步应用于临床治疗的关键问题。
卵巢癌是致死率最高,预后最差的妇科恶性肿瘤。顺铂是治疗卵巢癌的主要化疗药物,但癌细胞极易出现耐药性,导致卵巢癌患者预后不良,其5 年生存率仅有30%。因此,寻找有效增强卵巢癌细胞顺铂敏感性的方法是目前急需解决的问题之一[17]。针对miRNA分子给药与卵巢癌细胞顺铂耐药的难题,本研究将利用miR-16能够增强顺铂敏感性的特点,使用二硫键连接两段R9(9个精氨酸基团)并加入cRGD肽段,使之与miR-16自组装形成靶向卵巢癌的miRNA/多肽纳米递释系统,该纳米递释系统拟实现miRNA稳定载药、肿瘤细胞靶向并发挥miRNA的生物学功能的目的,为miRNA的临床应用奠定基础。
1 材料和方法
1.1 材料
细胞培养所需的胎牛血清、Mccoy's 5A培养基等(Gibco)。miR-16 mimic 以及其逆转录试剂盒、茎环qRT-PCR试剂盒等(锐博生物)。cRGD-R9-SS-R9、R9-SS-R9多肽由安徽国平药业有限公司合成。Western blot 所需抗体(Proteintech)。CCK-8 试剂盒(同仁化学)。SK-OV-3细胞(中国科学院上海细胞库)。细胞凋亡检测试剂盒(德为生物)。顺铂(sigma aldrich)。蛋白定量试剂盒(碧云天)。
1.2 仪器
Zetasizer 纳米粒度电位仪(马尔文仪器有限公司);共聚焦高内涵成像分析系统(美谷分子);LightCycler480(罗氏);多功能成像分析系统(Protein Simple);生物安全柜(青岛海尔特种电器有限公司);流式细胞仪(BD FACSCanto II);离心机(北京博劢行仪器有限公司);琼脂糖凝胶电泳系统(Bio-Rad)。
1.3 方法
1.3.1 纳米粒的合成 在生物安全柜内取高压后的无菌DEPC水1000 μL加入到R9-SS-R9、cRGD-R9-SS-R9多肽粉末中轻轻混匀,充分溶解。取无菌DEPC水750 μL到miR-16 mimic管中,轻轻混匀充分溶解。取32 μL的多肽液加入268 μL的无菌DEPC水稀释,加入到含有300 μL miR-16 mimic溶液的2 mL离心管中轻轻混匀,用封口胶封闭离心管管口后,将离心管放置于37 ℃恒温箱中孵育1 h,过程中务必确保离心管稳定。1 h后于离心管中加入400 μL的无菌DEPC水,即制得以多肽-RNA重量比为5∶1,RNA浓度为2000 nmol/L的多肽/miR-16纳米粒分子,置于4 ℃保存。其余重量配比形成的纳米粒,按相应倍数将多肽液与无菌DEPC水混合稀释即可。
其中,has-miR-16序列为:正义链:5'-3'CCAAUA UUUACGUGCUGCUA;反义链:5'-3'UAGCAGCAC GUAAAUAUUGGCG
1.3.2 纳米粒的表征 利用琼脂糖凝胶电泳法检测各重量比合成的纳米粒包裹是否完全,并设置血清对照组、miRNA对照组以及纳米粒+血清组验证纳米粒在血清中经24、48、72 h后的稳定性。血清、miRNA对照组中分别仅含血清与miRNA溶液,纳米粒+血清组中纳米粒与血清以体积1∶1比例混合。利用马尔文仪器检测各重量比合成的纳米粒粒径、分散度以及电位。选择所形成的纳米粒粒径、分散度以及电位适宜,多肽用量较少的重量配比作为实验条件。最后,在透射电镜下观测纳米粒的形态。
1.3.3 CCK-8检测包裹siNC的多肽材料细胞毒性 在SK-OV-3细胞正常传代24 h后,消化细胞并进行细胞计数,按每孔4000个细胞接种于96孔板中。待细胞汇合度约为50%时(约接种24 h后),去除完全培养基,用PBS洗2遍后进行转染。转染分组如下:空白组、阴性对照组以及实验组。空白组中无细胞培养;阴性对照组中加入细胞培养但无纳米粒转染;实验组中加入细胞培养且分别加入单纯多肽材料、R9-SS-R9/siNC与cRGD-R9-SS-R9/siNC 纳米粒,按siRNA 终浓度分为200 nmol/L以及400 nmol/L转染组(单纯多肽材料组按siRNA 终浓度为400 nmol/L 时的多肽用量加入)。所有组均设置6个复孔。转染24 h后加入DMEM完全培养基100 μL。转染48 h后,去除转染液,用PBS洗2遍后于各孔加入含10 μL CCK-8溶液的Mccoy's 5A培养基200 μL,继续于细胞培养箱培养1.5 h后,取出96孔板于酶标仪检测450 nm处吸光度。并以(A450nm实验组-A450nm 空白对照组)/(A450nm阴性对照组-A450nm空白对照组)公式计算出细胞相对存活率。
siNC序列为对细胞转录无影响的小核酸分子,序列为:
正义链:5'-3'CGUGAUUGCGAGACUCUGA;
反义链:5'-3'UCAGAGUCUCGCAAUCACGUU.
1.3.4 使用流式细胞术检测SK-OV-3细胞对纳米粒的相对摄取量 预先使用流式细胞术检测SK-OV-3细胞表面αvβ3整合素受体表达量。取处于对数生长期的SK-OV-3细胞,消化后进行细胞计数,取1×104个细胞,加入PSB溶液洗1遍后加入5 μL整合素αvβ3抗体,轻轻吹打混匀,另取同样数量细胞不加抗体作为空白对照组。将细胞置于4 ℃避光孵育30 min后,用PBS溶液清洗细胞2遍,用0.1 mL PBS溶液重悬后在流式细胞仪上检测FITC荧光强度,用未孵育抗体的空白组细胞作为对照,在Flowjo软件上进行分析。
制备多肽/siNC-cy5纳米粒进行转染,实验分组为空白对照组、siNC-cy5 对照组、R9-SS-R9/siNC-cy5、cRGD-R9-SS-R9/siNC-cy5,每组设置RNA 终浓度为200 nmol/L、400 nmol/L。转染6 h去除培养液,消化各组细胞,加入PBS洗3遍后上机检测cy5荧光。以空白对照组荧光强度的1%进行对比,得出其余各组相对细胞摄取率。
1.3.5 活细胞成像实验观察纳米粒的细胞摄取 实验分组为:空白组、siNC-cy5对照组、R9-SS-R9/siNC-cy5、cRGD-R9-SS-R9/siNC-cy5。接种细胞于24 孔板中,在细胞汇合度达到50%时去除培养基,用PBS 洗2遍,纳米粒组中加入60 μL纳米粒与240 μL Opti-MEM培养基,siNC-cy5 对照组中加入siNC-cy5 溶液28 μL与Opti-MEM 培养基272 μL,使各组中RNA 浓度为400 nmol/L,空白组加入300 μL Opti-MEM 培养基。转染1、3、6 h后,去除转染液,用PBS洗2遍后于每孔加入预先配备的Lysotracker Green DND-26 溶液300 μL(浓度为50 nmol/L),于37 ℃恒温孵育5 min后取出,去除探针液,加入PBS洗2遍后于每孔加入300 μL Hoechst33342染色液,于37 ℃恒温染色20 min。去除染色液,用PBS 洗3 遍,每孔中加入300 μL 无酚红DMEM培养基封片并上机成像。
1.3.6 茎环qRT-PCR在RNA水平验证miR-16的转染效率 制备多肽/miR-16纳米粒以及多肽/siNC纳米粒进行转染,实验分组为空白组、R9-SS-R9/siNC、cRGDR9-SS-R9/siNC、R9-SS-R9/miR-16以及cRGD-R9-SSR9/miR-16,RNA终浓度为400 nmol/L。转染24 h后换液,换液48 h后用Trizol(Invitrogen)试剂按说明书方法提取细胞总RNA,用锐博公司的miRNA逆转录及PCR试剂盒按说明书方法完成对miR-16以及U6的逆转录与PCR并上机检测。以U6为内参水平进行对比分析,数据结果处理以变化倍率2-ΔΔCt表示。
1.3.7 Western blot法检测SK-OV-3细胞Bcl-2、Chk-1蛋白表达水平 实验分组同1.3.6,细胞转染后24 h换液,换液48 h后提取细胞总蛋白并按照蛋白定量试剂盒方法进行蛋白定量。进行Western blot实验:按30 μg为蛋白上样量,SDS-PAGE 电泳分离蛋白,将凝胶上的蛋白用湿法转移到PVDF 膜上,用5%牛血清白蛋白封闭PVDF 膜上不含目的蛋白的结合位点,用TBST 洗膜10 min后加入相应Bcl-2(1∶1000)、Chk-1(1∶1000)以及GAPDH(1∶1000)一抗,4 ℃孵育过夜后,用TBST洗膜3×10 min,加入对应的二抗(1∶2000),孵育2 h 后用TBST洗膜3×10 min,上机显影。
1.3.8 流式细胞术检测SKOV3细胞凋亡 实验分组为空白对照组、R9-SS-R9/siNC、cRGD-R9-SS-R9/siNC、R9-SS-R9/miR-16以及cRGD-R9-SS-R9/miR-16,各组又分别设置加入顺铂组与无顺铂组,RNA 终浓度为400 nmol/L。于转染24 h后换液,转染48 h后于顺铂组中加入顺铂溶液,使顺铂终浓度为4 μg/mL。于转染72 h后消化细胞,加入PBS洗2遍后收集细胞,加入300 μL结合液以及5 μLAnnexin V-FIITC,避光孵育15 min后加入10 μL PI染液,立即上机检测。
1.4 统计学分析
采用SPSS 20.0统计软件分析,数据均以均数±标准差表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 多肽的合成
cRGD-R9-ss-R9以及R9-ss-R9多肽委托安徽国平药业有限公司合成(图1)。R9-SS-R9多肽序列的理论分子质量为3164.81,MS实测分子质量为3164.25(图2A)。cRGD-R9-SS-R9多肽序列的理论分子质量为4379.96,MS实测分子质量为4378.50(图2B)。根据MS结果显示,理论分子质量与实测分子质量基本一致。通过HPLC方法测定R9-SS-R9与cRGD-R9-SS-R9多肽段纯度。结果显示R9-SS-R9肽段纯度为95.01%,保留时间为8.3 min(图3A)。cRGD-R9-SS-R9 肽段纯度为95.66%,保留时间为11.7 min(图3B)。

图2 MS法鉴定多肽分子Fig.2 Identification of polypeptide by MS.A:R9-SS-R9,measured mass is 3164.25(target mass is 3164.81).B:cRGD-R9-SS-R9,measured mass is 4378.50(target mass is 4379.96).
2.2 纳米粒的表征
琼脂糖凝胶电泳显示,各重量比所制备的纳米粒均包裹完全,无核酸漏出(图4)。血清稳定性实验显示多肽/miR-16纳米粒在血清中放置72 h后仍保持稳定,无核酸漏出(图5)。马尔文粒径电位仪检测显示(图6),各重量比所制备的纳米粒粒径均在100~200 nm间,分散度约为0.1,电位均为40~45 mV间。透射电镜下拍摄得到清晰、完整的纳米粒图像,捕捉的纳米粒粒径约为125 nm,与马尔文仪器检测相符(图7)。
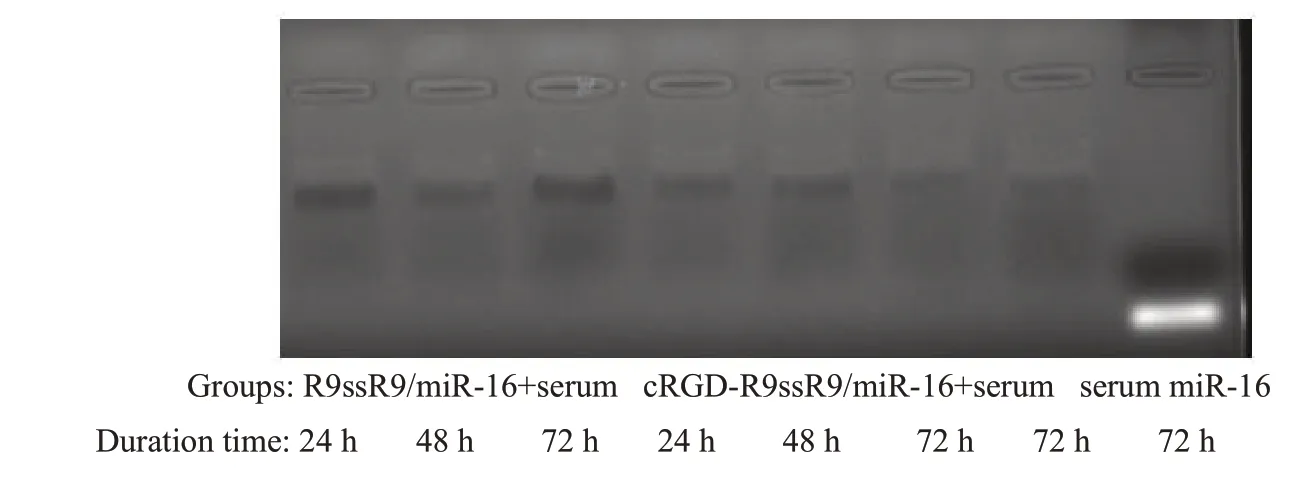
图5 琼脂糖凝胶电泳检测纳米粒在血清中的稳定性Fig.5 Stability of the nanoparticles in serum detected by agarose gel electrophoresis.

图6 纳米粒的粒径、分散指数与电位Fig.6 Particle size,PDI and potential of nanoparticles.A:Particle size of nanoparticles.B:PDI of nanoparticles.C:Potential of nanoparticles.

图7 透射电镜观测纳米粒形态Fig.7 Nanoparticle morphology observed by TEM.A:R9-SSR9/miR-16 nanoparticle(Original magnification:×15 000).B:cRGD-R9-SS-R9/miR-16 nanoparticle.Beam Current:120 kV(×20 000).Scale bars=200 nm.
2.3 多肽材料对SK-OV-3细胞的毒性作用
CCK-8 法验证多肽/siNC 纳米粒对SK-OV-3 细胞的毒性作用。两种多肽结构形成的纳米粒在200、400 nmol/L浓度下转染48 h后,各实验组细胞相对存活率均接近90%,细胞活性无显著差异(图8)。
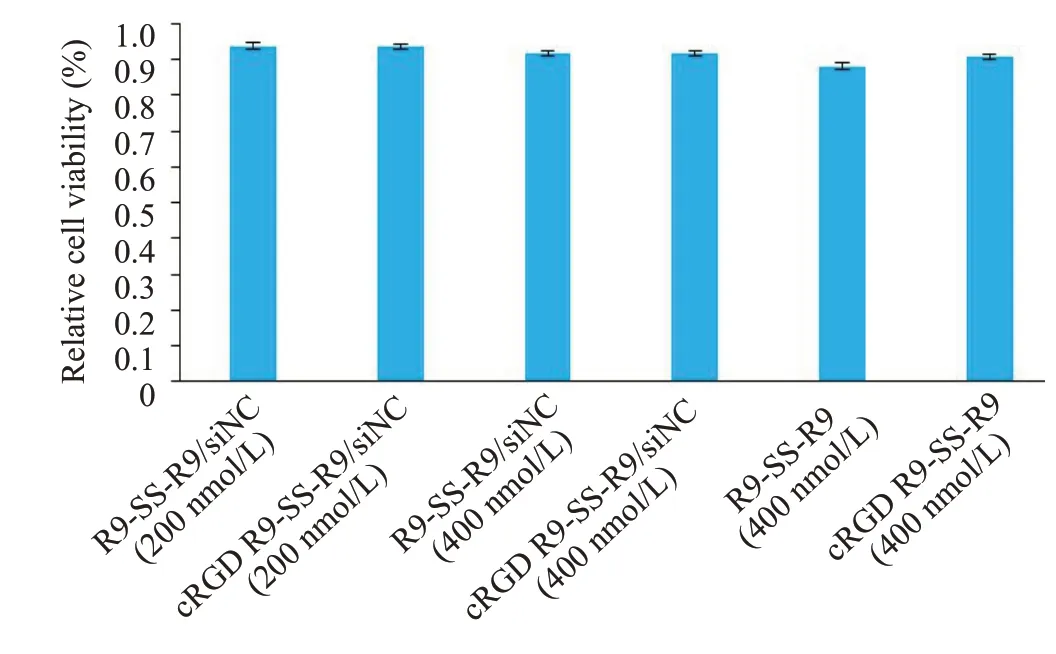
图8 转染各纳米粒48 h后SK-OV-3细胞相对存活率Fig.8 Relative survival rate of SK-OV-3 cells after transfection nanoparticles for 48 h(n=6,Mean±SD).
2.4 SK-OV-3细胞对纳米粒的相对摄取量
流式细胞术检测SK-OV-3细胞表面αvβ3整合素受体表达量,SK-OV-3细胞表面αvβ3整合素受体表达量为49.2%(图9)。流式细胞术检测SK-OV-3对纳米粒的摄取,实验结果如图10所示。400 nmol/L浓度下cRGDR9-SS-R9/siNC-cy5纳米粒相对摄取率高于对照组相对摄取率,达到(85±2.8)%,比R9-SS-R9/siNC-cy5组相对摄取率高20%,差异有统计学意义(P=0.02)。

图9 SK-OV-3细胞表面αvβ3受体表达水平Fig.9 Expression of αvβ3 receptor on SK-OV-3 cell surface.
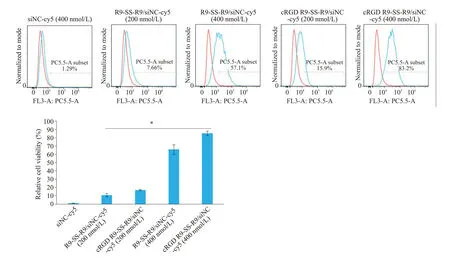
图10 流式细胞术检测SK-OV-3细胞对纳米粒的摄取Fig.10 Cellular uptake of the nanoparticles detected by flow cytometry.*P<0.05.
2.5 纳米粒在SK-OV-3细胞中的活细胞成像
利用共聚焦高内涵成像系统拍摄转染多肽/siNC-cy5纳米粒后SK-OV-3细胞中纳米粒的分布,结果如图11所示。显示绿色荧光为溶酶体,红色荧光为纳米粒,蓝色荧光为细胞核仁。空白组与阴性对照组于1、3、6 h时间点皆无红色荧光。而实验组中R9-SS-R9/siNC-cy5与cRGD-R9-SS-R9/siNC-cy5纳米粒组随着时间的增加,图像中的红色荧光占比越来越多并分布在蓝色荧光附近。横向对比同一时间点实验组的图像,cRGD-R9-SS-R9/siNC-cy5纳米粒组图像中红色荧光强度均大于R9-SS-R9/siNC-cy5纳米粒组。
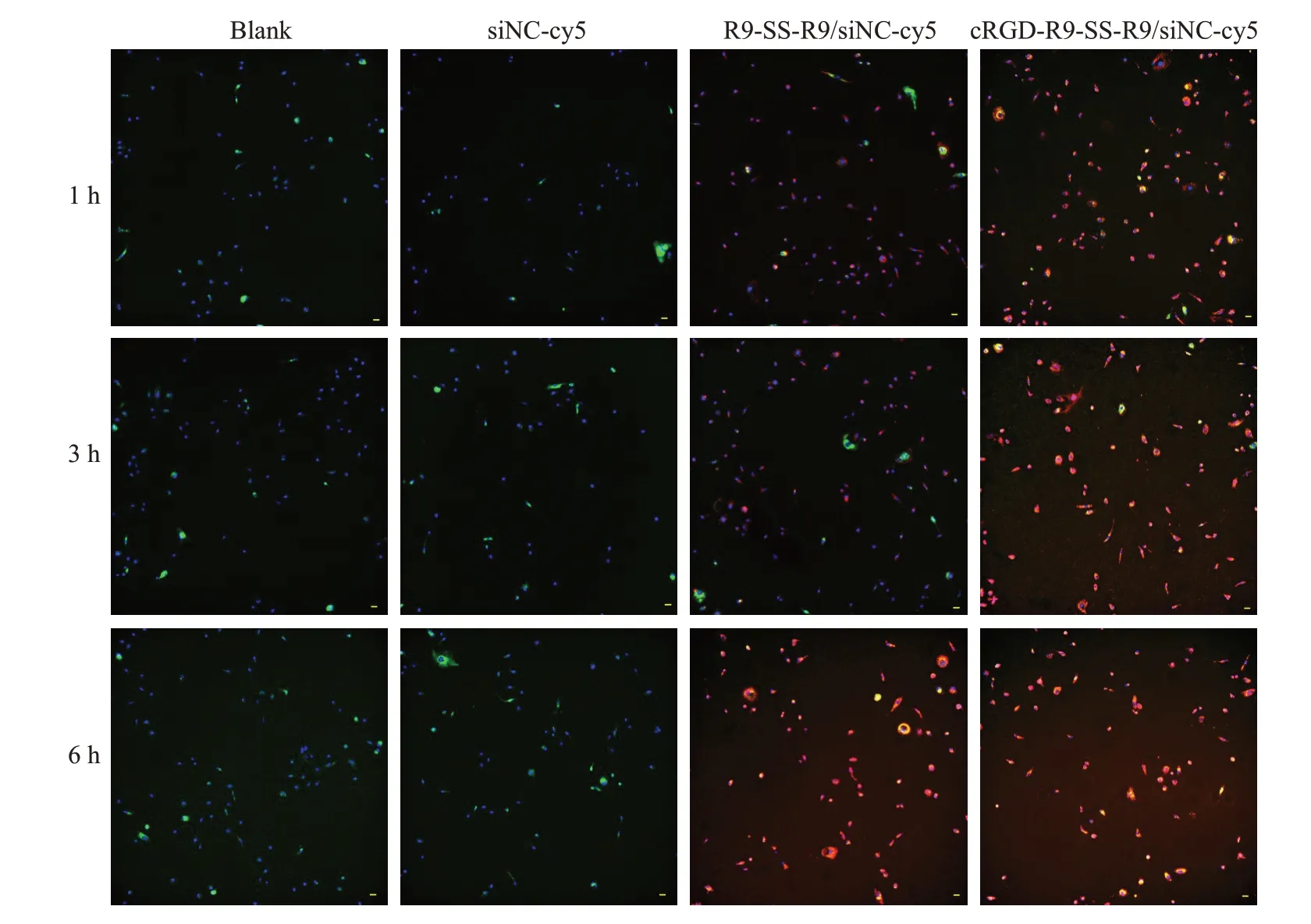
图11 共聚焦高内涵成像系统检测纳米粒摄取及在细胞内分布Fig.11 Uptake and distribution in SK-OV-3 cells detected by CLSM(×60).Scale bars=10 μm.
2.6 SK-OV-3细胞中转染多肽/miR-16纳米粒后miR-16表达量
利用茎环qRT-PCR技术检测SK-OV-3细胞中转染多肽/miR-16纳米粒后miR-16表达量的变化,以U6为内参,结果如图12所示。转染多肽/miR-16纳米粒后,SK-OV-3细胞中miR-16的表达量显著提高(P<0.001),表达量约为空白对照组的160倍。
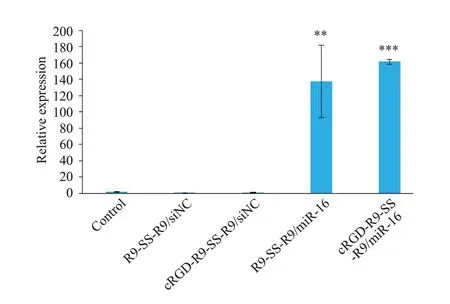
图12 茎环qRT-PCR检测SK-OV-3细胞转染后miR-16相对表达量Fig.12 Relative expression of miR-16 by bulge-loop qRTPCR(n=3,Mean±SD),**P<0.01,***P<0.001 vs control.
2.7 SK-OV-3细胞转染多肽/miR-16纳米粒后细胞内Bcl-2、Chk-1蛋白表达变化
在转染72 h后,与对照组相比,cRGD-R9-SS-R9/miR-16纳米粒组SK-OV-3细胞中Bcl-2及Chk-1蛋白表达均大幅减少P值分别为0.005及0.009,R9-SS-R9/miR-16纳米粒组的细胞中Bcl-2及Chk-1蛋白表达无显著差异(图13)。
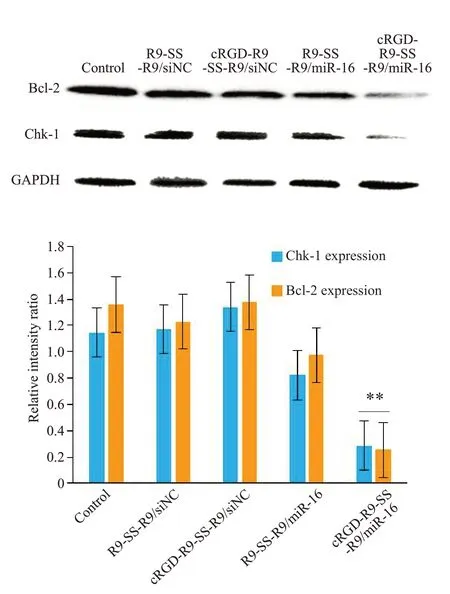
图13 SK-OV-3细胞中Bcl-2、Chk-1以及GAPDH蛋白的表达情况Fig.13 Expression of Bcl-2,Chk-1 and GAPDH protein in SK-OV-3 cells(n=3,Mean±SD).**P<0.01 vs control.
2.8 SK-OV-3细胞转染多肽/miR-16纳米粒并联用顺铂后细胞凋亡的变化
利用流式细胞术检测SK-OV-3 细胞转染多肽/miR-16纳米粒,同时设置联用顺铂以及无顺铂组,检测细胞凋亡的变化,比较纳米粒对细胞的促凋亡作用以及增强细胞对顺铂敏感性的作用。结果如图14 所示,cRGD-R9-SS-R9/miR-16 组细胞凋亡率约为32.5%,control组细胞凋亡率约为11.5%,二者具有显著性差异(P=0.003)。转染cRGD-R9-SS-R9/miR-16纳米粒后,联用顺铂组细胞凋亡比无顺铂细胞组凋亡率增加29.9%,而空白对照组联用顺铂后,细胞凋亡率仅增加3.6%,二者具有显著差异(P<0.001)。

图14 流式细胞术检测细胞凋亡Fig.14 Cell apoptosis detected by flow cytometry (n=3, Mean±SD),**P<0.01 vs control,***P<0.001 vs cRGD-R9-SS-R9/miR-16.
3 讨论
MicroRNA与其他生物大分子一样,实现生物体内给药是成药的一大难题。核酸药物的给药主要面临难以透过细胞磷脂双分子层、易被血液及组织中核糖核酸酶降解、易经网状内皮系统清除、具有一定免疫原性以及易被转运至溶酶体降解等难题[18-19]。MRX34 与MesomiR-1是最先进行临床试验且应用于肿瘤治疗的miRNA分子药物,二者分别利用脂质体以及微细胞包裹miRNA 分子完成给药,但这两项临床试验皆因引起受试者不同程度的免疫反应而被终止[20-22],表明这样的给药系统对人体具有较强的毒性。而具有良好的包载特性,能通过实体瘤的高通透性和滞留效应渗透进入肿瘤组织的纳米递释系统成为近年研究热点[23-24]。Sun等[25]在壳聚糖上加入了能提高细胞膜穿透性的精氨酸与能提高pH缓冲能力的组氨酸基团H6R6,构建了H6R6-CS/siRNA纳米粒。虽然H6R6结构增强了细胞对药物分子的摄取,但该纳米粒在有效载药浓度下对细胞的毒性与lipo2000相近,加药48 h后细胞相对存活率仅有约60%[25]。Li等[26]构建了聚乳酸-羟基乙酸共聚物-聚乙烯亚胺(PLGA-PEI)结构包裹miR-221抑制分子(miR-221 inhibitor)形成纳米粒,在肝癌细胞中完成给药,但研究中缺乏纳米粒结构的毒性实验。作为对比,Zhang等[27]构建了同样带有PEI结构的R11-SS-PEI包裹miR-145来实现在前列腺癌细胞中的给药,但在加入该纳米粒结构48 h后,细胞相对存活率约为70%。而Yichao等[28]则借鉴了Elbakry[29]研究团队构建的“逐层组装”(Layer-by-layer)金纳米粒结构,包裹miR-326分子实现在肝癌细胞中的给药,但该研究同样缺乏纳米粒结构的毒性试验,且由逐层组装方法的合成工序复杂,不利于该给药系统进一步临床应用。相较之下本课题的纳米粒结构制备方法简易,对细胞毒性更小,在加入空白纳米粒或单纯多肽材料48 h后细胞活性并无显著性变化,且细胞摄取率达到约85%,解决了纳米材料细胞毒性与细胞摄取间的平衡问题。
环状精氨酸-甘氨酸-天冬氨酸序列(cRGD)由于其αvβ3整合素受体特异靶向性,已被广泛应用于各种给药系统当中。但将cRGD序列应用到靶向肿瘤完成给药的研究却很少,其中Gu等[30]将cRGD序列连接在聚酪氨酸多肽上,包裹多柔比星完成在结直肠癌动物模型的给药;Wang等[31]则将cRGD与叶酸自组装形成的纳米粒用于卵巢癌治疗,发现该纳米粒具有良好的抑制血管生成作用,这些研究表明cRGD具有良好的肿瘤靶向性。但目前尚十分缺乏将该序列应用于miRNA肿瘤靶向给药的有效研究,Shun-ichi Wada等人是目前唯一将cRGD序列应用到miRNA肿瘤给药领域的研究团队,他们将cRGD与一系列阳离子型多肽以及α-螺旋多肽结合用于包裹siRNA 以及miRNA 给药[32],该实验虽然成功完成核酸分子的载药以及证实药物分子可被细胞充分摄取,但缺乏多肽材料合成的空白纳米粒对细胞的毒性实验以及对载药纳米粒分子的生物学功能验证。
细胞穿透肽是一类可偶联在纳米粒子或化合物上,具有促进细胞摄取作用的短肽,R9多肽即是其中的一员[33]。Zhang等[34]构建了cRGD-R9-PEG-PEI-胆固醇(rrPPC)的siRNA给药系统,用于包载STAT3 siRNA完成在结肠癌细胞中的给药。虽然该结构已连接PEG以及胆固醇以增加其生物相容性,但细胞毒性实验显示,加药后细胞相对存活率也仅有约60%,这限制了该结构的进一步应用。
本研究构建cRGD-R9-SS-R9/miR-16给药分子,利用cRGD对细胞表面αvβ3受体高表达的肿瘤细胞靶向性以及介由细胞内吞的促药物细胞摄取作用,同时利用R9具有的细胞穿透肽特性,双途径增加纳米粒的细胞摄取率以及完成肿瘤靶向。利用R9阳离子型多肽具有的吸质子作用引发“质子海绵效应”[34],实现内体膜的穿孔、破坏甚至破裂,使纳米粒分子释放到细胞质中。其后完成了对纳米粒分子的表征与毒性实验,结果显示纳米粒粒径为115.2±0.4 nm、均一性良好、电位适宜,加药48 h后细胞相对存活率约90%,同时纳米粒结构在血清中放置72 h后结构稳定。在纳米粒给药48 h后,卵巢癌细胞中miR-16分子表达上调,从流式细胞术以及活细胞成像结果中看出,连接了cRGD序列的纳米粒组细胞相对摄取率更高,达到约85%。而细胞凋亡结果显示,cRGD-R9-SS-R9/miR-16纳米粒促进卵巢癌细胞凋亡并显著增强了细胞对顺铂的敏感性(P<0.01)。有充分研究表明,Bcl-2以及Chk-1是影响细胞凋亡以及细胞顺铂耐药的关键[35-36],cRGD-R9-SS-R9/miR-16纳米粒减少了卵巢癌细胞中Bcl-2以及Chk-1蛋白的表达,提示该纳米粒可通过下调Bcl-2与Chk-1信号通路实现抗肿瘤细胞增殖以及增强细胞顺铂敏感性的作用。
与此前国内外相关研究对比,本文设计构建了一个全新的cRGD-R9-SS-R9/miRNA肿瘤靶向纳米递释系统,其合成方法简单,舍弃了聚乙烯亚胺等聚合物结构,大大降低了纳米粒的细胞毒性,同时加入了两段R9多肽以及连接cRGD 序列保证了纳米粒的细胞摄取效率。该肿瘤靶向纳米递释系统未见国内外文献报道,具有创新性。其增加了miR-16分子用于治疗卵巢癌及增强顺铂敏感的可能,为miRNA分子用于临床治疗奠定了基础,并具有一定的普适性,可在miRNA、小干扰RNA(siRNA)和长链非编码RNA(lncRNA)的给药上得到应用。
