白玉菇酸性磷酸酯酶的分离纯化及酶学性质研究
2021-06-15张蕾张航
张蕾 张航
摘要 [目的]對白玉菇酸性磷酸酯酶进行分离纯化,并研究其酶学性质。[方法]以白玉菇为材料提取酸性磷酸酯酶(ACPase,EC.3.1.3.2),进一步将原酶液盐析、层析2种常用的蛋白纯化技术,分离得到酸性磷酸酯酶,并对该酶的酶学性质进行研究。[结果]该酶分子量约为70 kD,水解对硝基苯磷酸二钠(pNPP)最适pH为4.5,等电点为5.5,最适温度为40 ℃,该酶在50 ℃时有热激活效应;紫外吸收光谱测定结果表明,酶有2个吸收峰,分别在220和280 nm处;耐热时间表明在40 ℃下耐热保温40 min后,酶活力为最大活力的60.79%,并在保温20 min时酶活力最大,50 ℃时酶活力随着保温时间的延长而降低,保温20 min后,酶活力下降为最初酶活力的20.77%;Hg2+、Pb2+、Ag+、Cd2+ 4种金属离子对酶活性均有抑制作用,Ag+抑制作用最强。酶的动力学参数Km为0.031 mmol/L、Vmax为0.204 mmol/(L·min)、酶反应初速度为18.66×10-3 μmol/L。[结论] 酸性磷酸酯酶的活性受温度、pH、金属离子等外界条件的影响,因此在栽培过程中需要控制环境温度及培养基酸碱度等条件。
关键词 白玉菇;酸性磷酸酯酶;分离纯化;动力学特性;酶活性
中图分类号 Q814 文献标识码 A
文章编号 0517-6611(2021)10-0004-04
doi:10.3969/j.issn.0517-6611.2021.10.002
开放科学(资源服务)标识码(OSID):
Separation and Purification of Acid Phosphatese and Enzymic Properties of White Hypsizygus marmoreus
ZHANG Lei1,ZHANG Hang2 (1.Xuhui High School,Shanghai 200030;2.Shanghai Hongqiao International Airport Company,Shanghai 200230)
Abstract [Objective] To isolate and purify the acid phosphatase from white Hypsizygus marmoreus and study its enzymatic properties.[Method] The acid phosphatase (ACPase,EC.3.1.3.2) was extracted from white Hypsizygus marmoreus as the material,and the original enzyme solution was further salted out and chromatographed through two commonly used protein purification techniques to isolate the acid phosphatase,and the enzymatic properties of the enzyme were studied.[Result] The molecular mass of the enzyme was 70 kD,the optimum pH of ACPase was 4.5 when pNPP was used as substrate,isoelectric point was 5.5,and the optimum temperature was 40 ℃,and could be activated at 50 ℃.The results of UV absorption spectroscopy showed that the enzyme had two absorption peaks at 220 and 280 nm respectively.The heat-resisting time showed that after heat-resisting at 40 ℃ for 40 min,the enzyme activity was 60.79% of the maximum activity,and the enzyme activity was the largest at 20 min.At 50 ℃,the enzyme activity decreased with the extension of the incubation time.After 20 minutes of incubation,the enzyme activity decreased to 20.77% of the original enzyme activity.The four metal ions of Hg2+,Pb2+,Ag+,Cd2+ had inhibitory effects on enzyme activity,and Ag+ had the strongest inhibitory effect.The enzyme kinetic parameters Km was 0.031 mmol/L,Vmax was 0.204 mmol/(L·min),and the initial reaction rate of the enzyme was 18.66×10-3 μmol/L.[Conclusion] The activity of acid phosphatase is affected by external conditions such as temperature,pH,metal ions,etc.Therefore,it is necessary to control the environment temperature and the pH of the medium during the cultivation process.
Key words White Hypsizygus marmoreus;ACPase;Separation and purification;Kinetic characteristics; Enzyme activity
白玉菇(white Hypsizygus marmoreus)属于伞菌目、口蘑科、白蘑属,是一种珍稀食用菌,富含有多种维生素、矿物质等营养物质,经常食用能够改善人体的新陈代谢,降低胆固醇[1-2]。白玉菇在我国已经得到了广泛栽培。酸性磷酸酯酶(ACPase)广泛分布于动物和植物中,是生物磷代谢的重要酶类,除了参与磷脂的代谢外,还参与代谢调节、能量转化等重要生命活动[3]。ACPase参与植物的磷代谢,在细胞调节过程中起着重要的作用[4]。白玉菇的生长环境尤其是环境中的金属离子可导致酶活力的变化,进而影响白玉菇的生长发育。目前国内对白玉菇活性物质研究主要集中于多糖的研究,对ACPase的研究鲜有报道[5-7]。该试验以白玉菇为试验材料,分离纯化ACPase,并对其酶学性质进行研究,为白玉菇的栽培提供理论参考。
1 材料与方法
1.1 酸性磷酸酯酶的制备 将白玉菇称重后,按1∶2.0(W∶V)加入预冷的20 mmol/L pH 5.0 NaAc-HAc缓冲液于匀浆机中充分破碎,然后将匀浆液过滤,再将过滤后的滤液离心(10 000 r/min,20 min,4 ℃)得到的上清液即为粗酶液。取上清加入固体硫酸铵至饱和度为40%,4 ℃,静止30 min,离心(10 000 r/min,20 min,4 ℃),弃沉淀。收集上清液加硫酸铵至饱和度为60%,离心(10 000 r/min,20 min,4 ℃)弃上清,收集沉淀。用20 mmol/L pH 5.0 NaAc-HAc缓冲液悬浮沉淀,4 ℃,12 000 r/min离心10 min,去除未溶解的部分蛋白,留取上清。去除杂蛋白后的酶液用超滤浓缩的方法浓缩到少量体积后再利用SephadexG-200柱(1.0 cm×100 cm)层析纯化,20 mmol/L pH 5.0 NaAc-HAc缓冲液洗脱,流速0.5 mL/min。每管收集2 mL,合并有酶活的部分。
纯化后的样品采用SDS-PAGE凝胶电泳方法进行酶蛋白纯度分析和相对分子质量的测定。分离胶质量浓度为10%,浓缩胶质量浓度为3%。
1.2 酶学特性
1.2.1 酶活力的测定。参照杨立红等[8-9]方法,酶活力测定反应总体积为5 mL含3 mL 20 mmol/L pH 5.0 NaAc-HAc 缓冲液、1 mL 10 mmol/L MgSO4和1 mL 5 mmol/L的底物对硝基苯磷酸二钠(PNPP),在37 ℃下,预热5 min,加100 μL酶液,反应10 min,加2.5 mL 200 mmol/L NaOH溶液终止反应,以去离子水代替酶液作为对照。
1.2.2 酶的最适pH、最适温度的测定。酶活力反应体系同“1.2.1”,pH 3.5~ 6.0,室温下测定酶活力。 最适温度测定同最适pH测定方法,设置7个温度,分别为30、35、40、45、50、55、60 ℃。
1.2.3 酶等电点(pI)的测定。该试验在测定酶的等电点时,从pH 3.0~6.0每间隔0.5个数值设置7个pH,以便了解等电点的大致范围。分别取不同pH酶反应缓冲体系5 mL,加100 μL酶液,测波长280 nm下的吸光度,吸光度最大时沉淀最多,该pH即为酶的等电点。
1.2.4 酶促反应初速度、米氏常数的测定。
在“1.2.1”活力测定体系中,在2、4、6、8、10、15、20、25、30 min分别测定反应速度,以反应产物浓度对时间作图,可得出反应初速度。改变底物浓度(5~30 mmol/L),按照lineweaver-Burk作图法进行计算,得出米氏常数Km和最大反应速度Vmax。
1.2.5 酶的紫外吸收光谱的测定。取适量酶液,于200~320 nm 处测吸光度,绘出紫外吸光图谱。
1.2.6 重金属离子对ACPase活力的影响。
参照杨立红等[8]方法,在4 mL反应体系中,加入3 mL 20 mmol/L pH 5.0的HAc-NaAc 缓冲液、1 mL 5 mmol/L 的 PNPP 溶液,再分别加入重金属离子Hg2+、Pb2+、Ag+和Cd2+的盐溶液,使金属离子终浓度分别为0、50、100、200、300、400、500 μmol/L,于37 ℃恒温水浴中预热5 min 后,加入100 μL 酶液,37 ℃反应10 min 后加入2.5 mL 200 mmol/L 的 NaOH 溶液终止反应,测定420 nm 处的吸光度。
2 结果与分析
2.1 ACPase的分离纯化
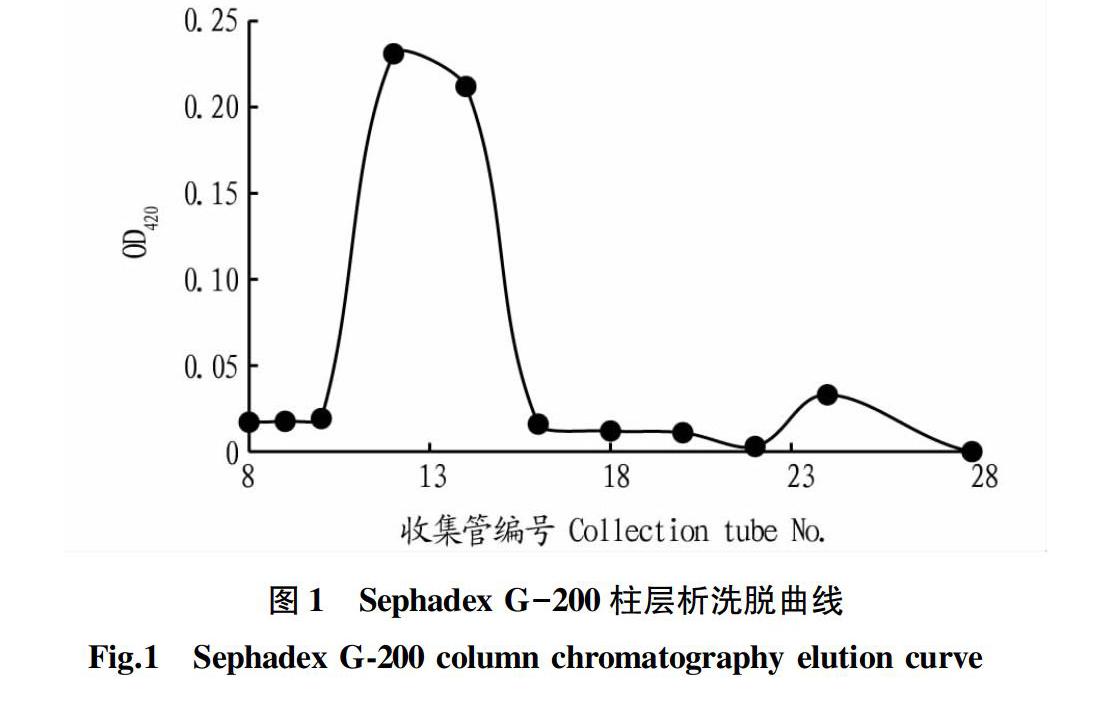
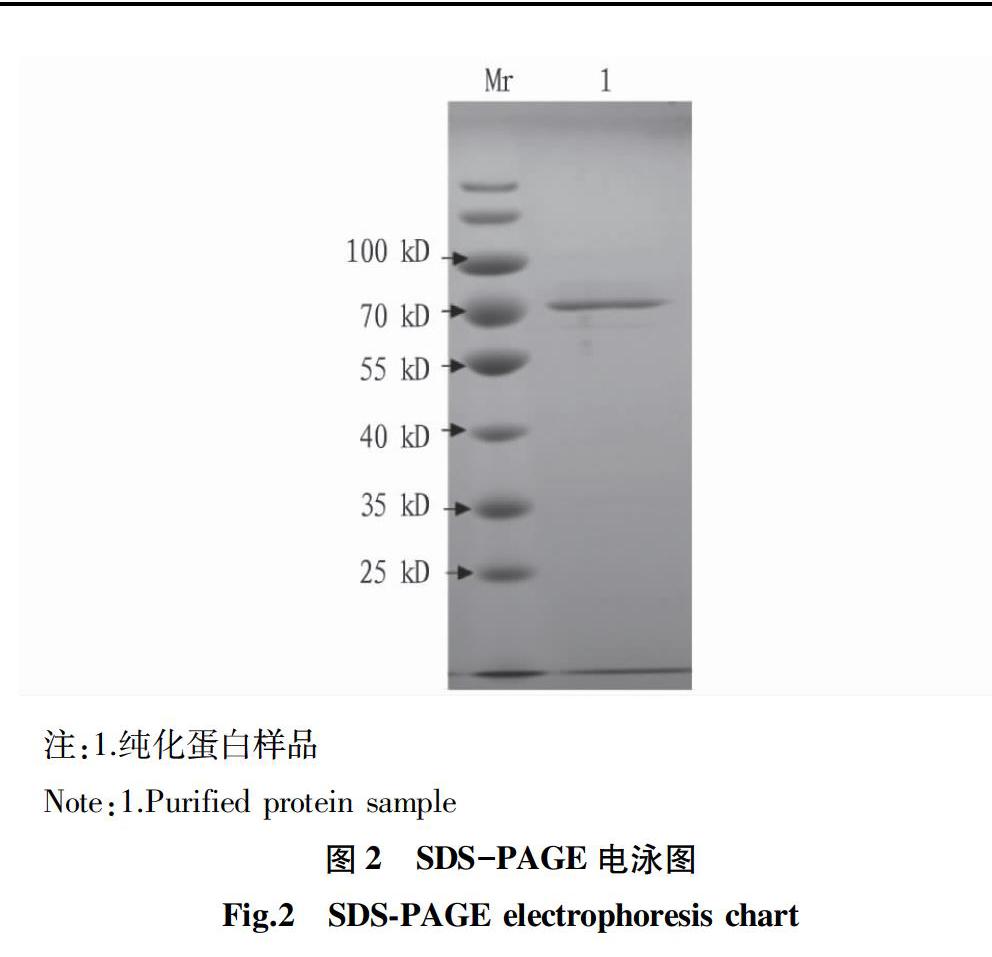
将匀浆、盐析后的粗酶液上样于Sephadex G-200层析柱,如图1所示在第12管时出现酶活力峰,第15管后酶的活力显著降低。合并12~15管洗脱液,合并浓缩后SDS-PAGE纯度检测及相对分子质量测定结果如图2,利用Quantity one软件進行蛋白纯度分析,纯度约为95%。与蛋白Marker比对,分子量约为70 kD,这与杨立红等[10]纯化的大致相当。
2.2 酶学特性
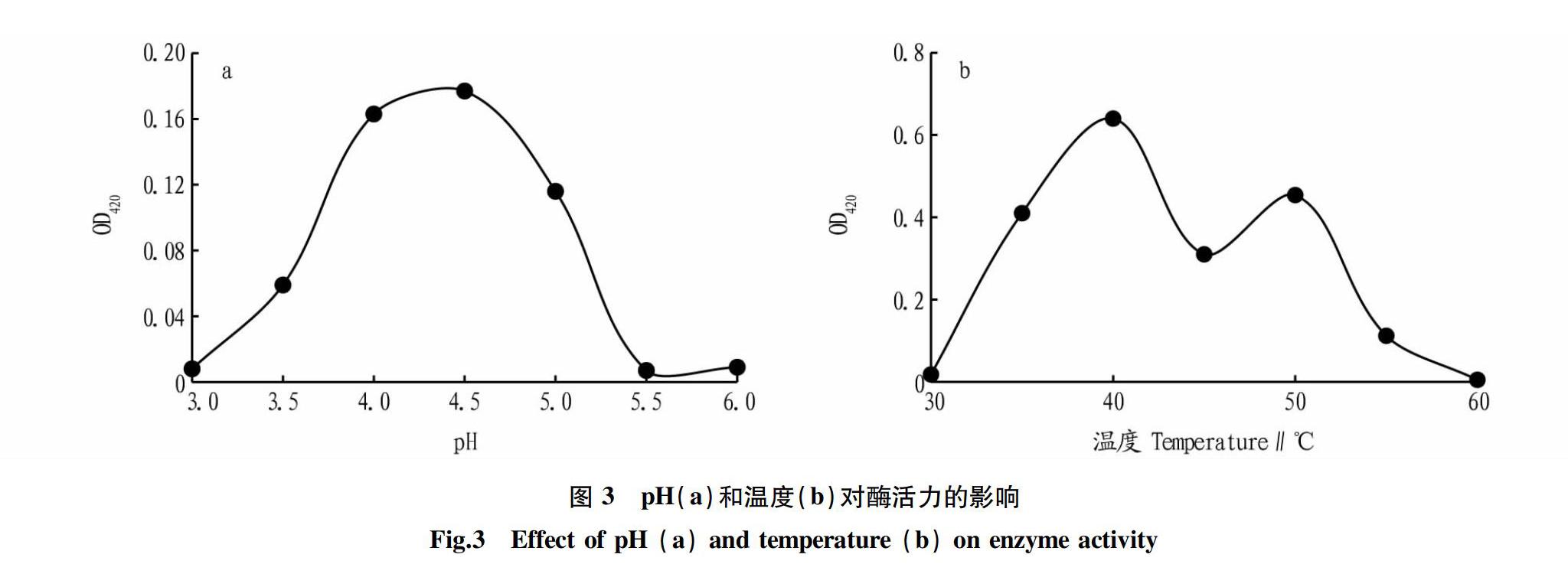
2.2.1 酶的最适pH、最适温度及耐热性的测定。图3a表明ACPase的最适pH为4.5,在最适pH条件下,测定不同温度下ACPase的活性,图3b显示ACPase的最适温度为40 ℃;当温度上升至50 ℃时,酶的活性均再次升高,推测该酶有热激活现象。
酶在最适温度下孵育35 min,20 min时活性最大(图4a),50 ℃保温20 min,酶活性显著下降,保温20 min时活力下降为最大活力的20.77%(图4b)。
2.2.2 酶促反应初速度、米氏常数的测定。由图5计算出酶反应初速度为0.186 6 μmoL/min。基于lineweaver-Burk双倒数曲线,以对硝基苯磷酸二钠(PNPP)为反应底物,分别对ACPase的米氏常数Km 和最大反应速度Vmax进行分析,如图6所示,ACPase的Km值和Vmax的值分别为0.031 mmol/L和0.204 mmol/(L·min)。
2.2.3 酶的等电点测定。从白玉菇ACPase等电点测定结果(图7)可以看出,在pH 5.5时ACPase的吸光度达到最大值,因此得出白玉菇ACPase等电点为5.5。
2.2.4 酶的紫外吸收光谱的测定。从白玉菇ACPase的紫外吸收光谱测定结果(图8)可以看出,白玉菇ACPase的紫外吸收峰在220和280 nm波长处,与蛋白质的紫外吸收光谱相符。
2.2.5 重金属离子对酶活力的影响。重金属离子对ACPase影响结果如图9所示,该试验所验证的重金属离子中,Ag+对酶活性的影响有明显的抑制作用,浓度为100 μmol/L时,相对酶活性为36.33%;Hg2+、Pb2+和Cd2+对酶活性的影响也均有抑制作用,其中Pb2+的抑制作用最弱。这与其他来源的ACPase试验结果有所不同,杨立红等[8]对刺身ACPase的研究发现,Hg2+ 对酶的活性抑制作用最强,其次为Ag+。进一步表明不同来源的ACPase的酶学性质存在差异性。
3 讨论与结论
ACPase是非绝对专一性的磷酸酯酶,具有多种同工酶,不同的环境条件会诱发出新的同工酶[11]。该试验通过盐析、层析过滤等方法得到相对纯度较高的ACPase,并对其酶学性质进行了研究。
ACPase性質的研究对阐明其在细胞中的功能十分重要。尽管对植物组织、水产鱼类的研究已有报道,但对白玉菇中ACPase的研究鲜有报道。木豆中ACPase的最适pH为4.0,刺身中ACPase的最适pH为4.4,仙人掌中ACPase最适pH为4.4,而该试验中白玉菇ACPase最适pH为4.5,与木豆和刺身的最适pH接近[8,12-13]。该研究中测得白玉菇ACPase的Km值为0.031 mmol/L,草鱼中ACPase的Km值为3.56 mmol/L[14],刺身ACPase的Km值为0.081 6 mmol/L[8]。该研究得出白玉菇ACPase最适温度为40 ℃,低于麦胚芽、仙人掌中ACPase的最适温度[12-13],在测定酶的最适温度中发现,在温度上升至50 ℃时,酶的活性再次升高,推测白玉菇ACPase可能有热激活现象,杨立红等[8,14]对斑玉蕈、草鱼和刺参的ACPase研究中也发现了热激活现象,但热激活温度不同,草鱼和斑玉蕈均为60 ℃,刺参为70 ℃。说明不同来源的ACPase酶学特征存在差异。
该试验体外检测了不同重金属离子对ACPase活性的影响,发现重金属离子Hg2+、Pb2+、Ag+和Cd2+对ACPase酶活性均有明显的抑制作用。这与陈素丽等[4,8,10,14]的研究结果一致。该试验白玉菇粗酶液经Sephadex G-200层析柱纯化后出现3个活力峰,杨杰等[15]已报道ACPase通常存在多种同工酶,因此推断白玉菇中ACPase可能存在3种同工酶。该试验只对酶活力高的酶进行了研究。该酶以不同的同工酶存在于不同生物中,导致了该酶的酶学特征存在差异,这也是生物不断进化为适应不同物种生长和代谢所需要的结果。重金属离子能使大多数酶活力受到抑制,推测可能重金属离
子与酶的活性部位结合,使酶的构象发生改变,进而影响酶的活性。因此,在栽培环境中要严格金属离子的含量,为高产栽培创建优质条件。
参考文献
[1] 孙丹丹,和焕香,王刚,等.不同品系真姬菇子实体营养成分和活性成分比较[J].食品研究与开发,2019,40(22):6-10.
[2] 林路秀,李顺兴,李林燕,等.食用菌中微量元素分析及营养价值与食品安全评价[J].分析科学学报,2015,31(6):835-838.
[3] 董登峰,杨杰,江立庚,等.大豆磷酸烯醇式丙酮酸磷酸酯酶研究Ⅲ、非专一性酸性磷酸酯酶的纯化与特性[J].广西植物,2005,25(5):472-476.
[4] 陈素丽,陈清西,丘文杰,等.金属离子对长毛对虾酸性磷酸酶的影响[J].台湾海峡,1998,17(1):96-99.
[5] 霍宗庆,徐婉晴,刘言娟.响应面法优化白玉菇多糖的提取工艺[J].食品工业科技,2017,38(22):145-149.
[6] GUL MUNEER(黄福).杏鲍菇、平菇及白玉菇碱提多糖的分离纯化及结构分析[D].长春:东北师范大学,2016.
[7] 刘海兵,王斌,张腾霄.十四种常见食用菌中糖类物质含量比较分析[J].内江科技,2017,38(10):81-82.
[8] 杨立红,孙振兴,王晓洁,等.刺参酸性磷酸酯酶的分离纯化及部分性质研究[J].食品科学,2008,29(10):440-443.
[9] GREINER R,ALMINGER M L.Purification and characterization of a phytate-degrading enzyme from germinated oat (Avena sativa)[J].Journal of the science of food and agriculture,1999,79(11):1453-1460.
[10] 杨立红,高兴喜,缪静,等.斑玉蕈酸性磷酸酯酶的酶学性质研究[J].菌物学报,2011,30(5):744-752.
[11] 田江,廖红,王秀荣,等.磷胁迫诱导大豆叶片酸性磷酸酶同工酶的表达[J].植物学报:英文版,2003,45(9):1037-1042.
[12] KALITA T,AMBASHT P K.Immobilization and characterization of acid phosphatase from wheat germ (Type I) in agarose gel[J].Journal of proteins and proteomics,2019,10(4):291-297.
[13] CHAFIK A,ESSAMADI A,CELIK S Y,et al.A novel acid phosphatase from cactus (Opuntia megacantha Salm-Dyck) cladodes:Purification and biochemical characterization of the enzyme[J].International journal of biological macromolecules,2020,160:991-999.
[14] 杨立红,肖波,王晓洁,等.草鱼酸性磷酸酯酶的性质及金属离子对其活性的影响[J].中国水产科学,2010,17(5):969-976.
[15] 杨杰,董登峰,王永峰.木豆种子酸性磷酸酯酶AcPase I的部分纯化和动力学特性[J].广西农业科学,2007,38(4):386-390.
