百香果炭疽病菌生物学特性及室内药剂筛选
2021-06-15冉飞陈佳莫飞旭樊荣尹显慧龙友华吴小毛
冉飞 陈佳 莫飞旭 樊荣 尹显慧 龙友华 吴小毛
摘 要:为明确百香果炭疽病菌(Colletotrichum karstii)的生物学特性,并筛选出防治效果较好的杀菌剂,采用生长速率法探究该病菌的生物学特性及9种杀菌剂对该病菌的室内毒力。结果表明:该病菌适宜在萨氏(SDAY)培养基上生长,适宜pH为6~9,适宜生长温度为20~30 ℃,最适温度为25 ℃,可高效利用蔗糖与甘氨酸;室内毒力测定发现9种杀菌剂对该病菌菌丝生长均有一定的抑制作用,其中75%肟菌·戊唑醇WG的抑制效果最好,EC50为0.0667 mg/L,其次为18.7%丙环·嘧菌酯SE、42.4%唑醚·氟酰胺SC、25%吡唑醚菌酯SC、50%咪鮮胺锰盐WP,EC50值分别为0.3335、0.4567、0.4630、0.8187 mg/L。
关键词:百香果;喀斯特炭疽菌;生物学特性;毒力测定
中图分类号:S436.67 文献标识码:A
Biological Characteristics of the Pathogen and Fungicides Screening in Laboratory for Anthracnose of Passiflora edulia Sims
RAN Fei1,2, CHEN Jia1,2, MO Feixu1, FAN Rong1,2, YIN Xianhui1,2, LONG Youhua1,2*, WU Xiaomao1,2
1. Institute of Crop Protection, Guizhou University, Guiyang, Guizhou 550025, China; 2. Engineering and Technology Research Center of Kiwifruit, Guizhou University, Guiyang, Guizhou 550025, China
Abstract: The experiment was conducted in order to clarify the biological characteristics of Colletotrichum karstii and screen fungicides with better prevention and control. The mycelial growth rate method was applied to explore the biological characteristics of the pathogen and the laboratory toxicity of 9 fungicides to the pathogen. Results indicated that the pathogen was suitable for growth on the SDAY medium with the optimum pH of 6 to 9 and the suitable growth temperature of 20 to 30 ℃, preferably 25 ℃. Besides, it could efficiently utilize sucrose and glycine. Laboratory toxicity test revealed that 9 fungicides had a certain inhibitory effect on the growth of the mycelium of the pathogen. Among them, 75% trifloxystrobin·tebuconazole WG was the most effective with an EC50 of 0.0667 mg/L, followed by procyclidine·azoxystrobin 18.7% SE, fluxapyroxad·pyraclostrobin 42.4% SC, pyraclostrobin 25% SC, prochloraz-manga nese chloride complex 50% WP with an EC50 of 0.3335, 0.4567, 0.4630, 0.8187 mg/L, respectively.
Keywords: Passiflora edulia Sims; Colletotrichum karstii; biological characteristics; toxicity tests
DOI: 10.3969/j.issn.1000-2561.2021.04.025
百香果又称鸡蛋果、西番莲、热情果,属西番莲科西番莲属[1],其原产于巴西,适应性强,经济价值高,在我国广西、台湾、福建、海南、贵州、云南等地均有种植[2]。百香果的果汁味道鲜美、芳香怡人,具有极高的营养、保健和商品价值,享有“果汁之王”的美誉[3-5],除此之外,其种子、皮、根、茎、叶等部位的提取物具有抗氧化、抗炎、抗癌和降血压等功效[6-8]。目前,我国主要栽培品种有紫果、黄果和二者的杂交种[9],贵州因气候和海拔的影响多种植紫果,现已列入脱贫致富主要产业[10]。随着百香果种植面积的不断扩大,加之管理不当、技术欠缺等,百香果面临病毒病、炭疽病、茎基腐病和蚜虫等病虫害危害,严重影响百香果产业的健康发展[11]。
笔者于2018年调查发现贵州贞丰县百香果受炭疽病危害严重,果实发病后呈向内凹陷的褐色至黑褐色不规则或近圆形病斑,通过形态观察结合多基因序列分析明确其致病菌为喀斯特炭疽菌(Colletotrichum karstii),是一种引起百香果炭疽病的新致病菌[12]。国内外对百香果炭疽病的研究主要集中于病原菌的鉴定,Bravo等[13]在1993年发现危害哥伦比亚百香果果实的炭疽病致病菌为Glomerella cingulata,2000年Wolcan等[14]明确发生于阿根廷百香果上的炭疽病同样是由G. cingulata所引起,2002年Peres等[15]发现侵染巴西百香果的炭疽病菌为C. gloeosporioides,2010年Tarnowski等[16]确定危害佛罗里达紫果和黄果的炭疽病菌有C. boninense、C. capsici和Glomerella sp.,2017年Du等[17]对福建百香果炭疽病进行了研究,明确其致病菌为C. brevisporum。但针对百香果炭疽病菌的生物学特性及药剂筛选方面的研究较少,仅谢美华等[18]对云南紫果西番莲叶片上的炭疽菌属进行了部分生物学特性测定及室内毒力试验,发现炭疽菌属最适生长温度为15~20 ℃,最适pH为8~9,最适培养基为PDA,最佳利用碳源为葡萄糖、氮源为硝酸钠,并发现福美双具有较好的抑菌效果。目前国内外对C. karstii的生物学特性及室内毒力研究还处于空白。而长期以来,化学防治一直作为有效控制植物病害的重要手段,甚至在病害大发生时期为唯一有效的防治措施[19]。为此,本研究采用菌丝生长速率法探明百香果喀斯特炭疽菌的生物学特性,同时测定9种常用化学杀菌剂对该病菌的室内毒力,以明确病菌生长习性并筛选出高效低毒化学杀菌剂,旨在为百香果炭疽病有效防治及高产、高品质提供一定的技术支撑。
1 材料与方法
1.1 材料
供试菌种:喀斯特炭疽菌(Colletotrichum karstii),经贵州大学作物保护研究所分离鉴定为一种百香果炭疽病菌,并保存于实验室。
培养基:马铃薯葡萄糖琼脂(PDA)培养基、燕麦琼脂(OA)培养基[20];察氏(Czapek)培养基[21];玉米琼脂(CMA)培养基、萨氏(SDAY)培养基、牛肉膏蛋白胨琼脂(NA)培养基、水琼脂(WA)培养基、高氏1号培养基[22]。
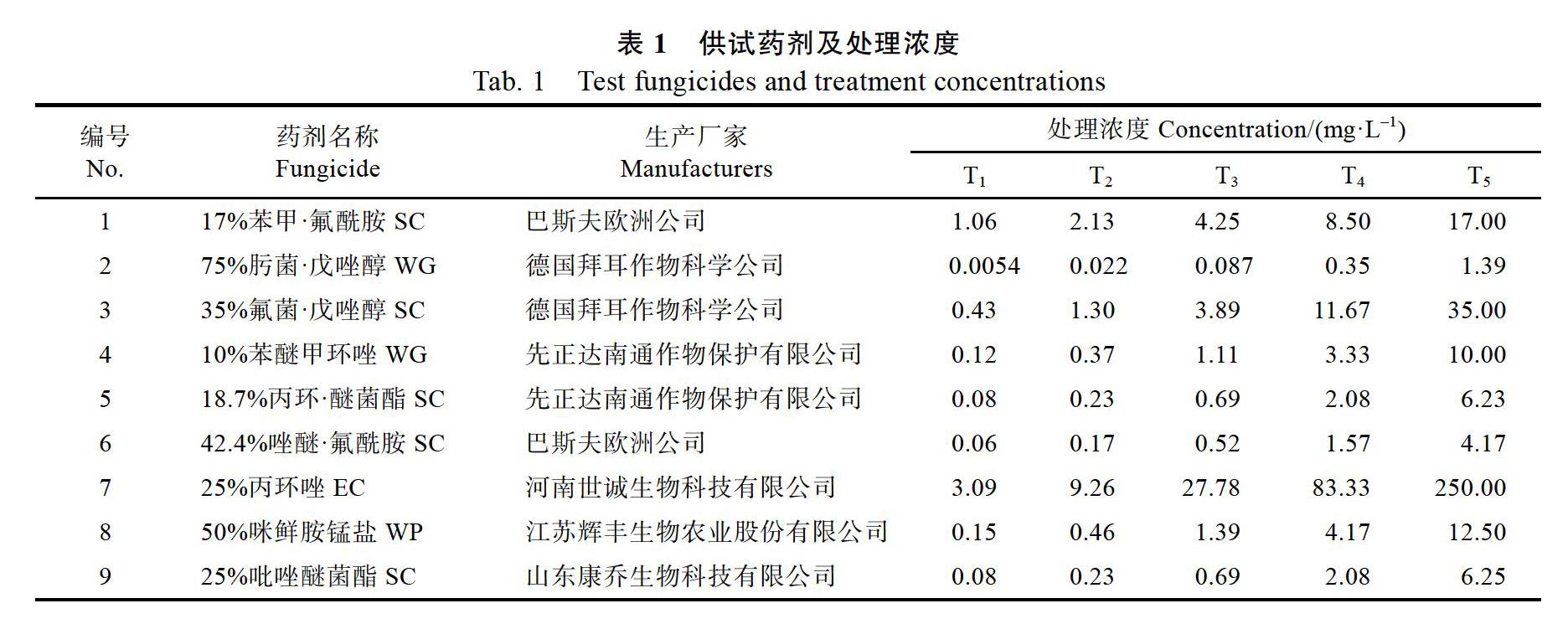
供試药剂:见表1。
1.2 方法
1.2.1 病原菌生物学特性测定 (1)温度对病原菌菌丝生长的影响。取0.5 cm适龄菌饼转接于PDA培养基中央,分别置于10、15、20、25、30、35、40 ℃下暗培养,培养6 d后采用十字交叉法测量菌落直径[23]。每处理4个皿,重复3次。
(2)pH对病原菌菌丝生长的影响。将菌丝块分别接种于利用1 mol/L HCl和1 mol/L NaOH调节pH为4、5、6、7、8、9、10、11的PDA培养基上,于25 ℃恒温培养箱中暗培养[24]。处理及观察方法同1.2.1-(1)。
(3)光照对病原菌菌丝生长的影响。将含菌PDA平板分别置于全黑暗、全光照和黑暗光照交替(12 h/12 h)3种不同光照条件下,25 ℃恒温培养[25]。处理及观察方法同1.2.1-(1)。
(4)不同碳源、氮源对病原菌菌丝生长的影响。以Czapek培养基为基础培养基,将培养基中的蔗糖分别替换成等量的淀粉、麦芽糖、乳糖、葡萄糖和果糖,制成不同碳源的培养基,采取同样的方法将培养基中的硝酸钠替换成等量的蛋白胨、牛肉膏、酵母膏、硫酸胺、氯化胺、尿素和甘氨酸,制成不同氮源的培养基,分别以缺碳和缺氮培养基为对照(CK)[26]。再将活化菌饼接于不同碳源、氮源培养基中央,25 ℃暗培养。处理及观察方法同1.2.1-(1)。
(5)培养基对病原菌菌丝生长的影响。将活化0.5 cm菌饼分别转接于Czapek、PDA、CMA、OA、NA、SDAY、WA和高氏1号培养基中,25 ℃暗培养。处理及观察方法同1.2.1-(1)。
1.2.2 病原菌室内药剂筛选 采用菌丝生长速率法测定杀菌剂的室内抑菌活性[27]。在无菌操作条件下,用无菌水将供试药剂配成5个有效浓度梯度(表1),待灭菌PDA培养基冷却至55 ℃左右,用10 mL量杯量取9 mL于9 cm平板中,再用1 mL移液枪吸取不同浓度的供试药剂于平板中振荡均匀,以清水为对照,每个处理浓度设置3次重复,待冷却凝固。将活化适龄菌落用0.5 cm无菌打孔器打取菌饼,用灭菌接种针转接到培养基中央,封口膜密封,并置于25 ℃恒温下暗培养8 d后,采用十字交叉法测量不同处理浓度的菌落直径,计算抑菌率。
1.3 数据处理
采用Excel 2010和DPS 7.05软件进行数据处理,并利用Duncans新复极差法进行单因素方差分析。
2 结果与分析
2.1 病原菌生物学特性
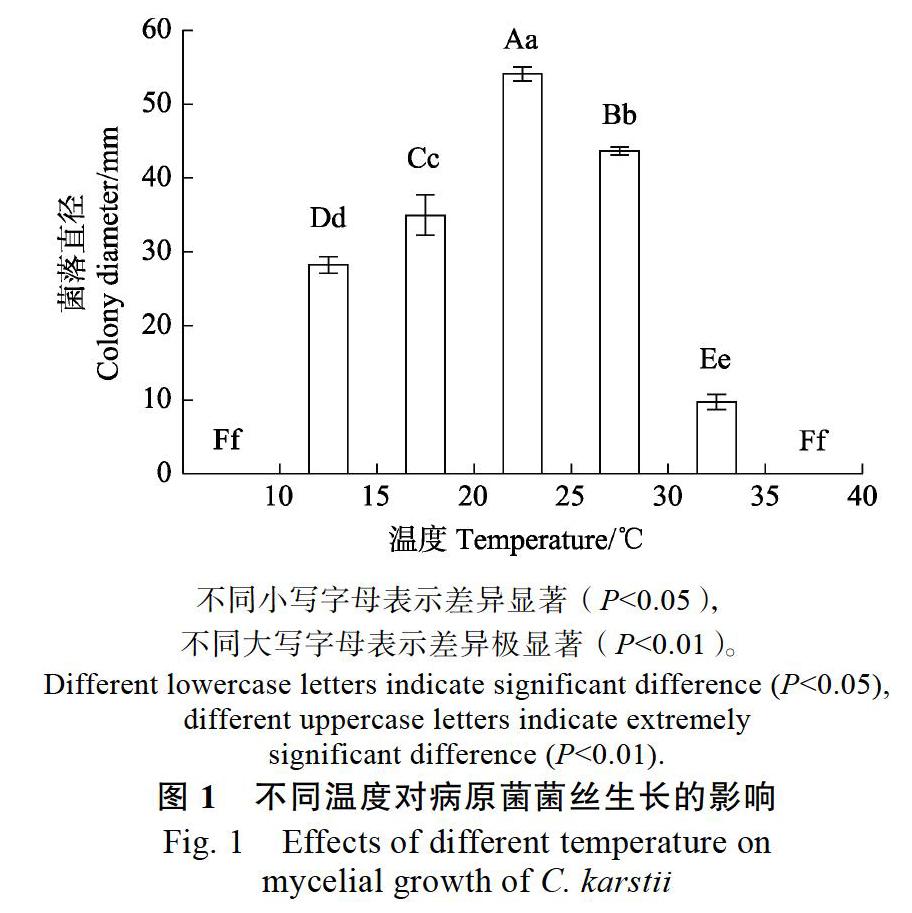
2.1.1 不同温度对病原菌菌丝生长的影响 病原菌在15~35 ℃下均能有效生长,生长趋势为先升高后下降,在25 ℃下菌丝生长最快,培养6 d菌落直径为54.10 mm。病原菌在低于15 ℃和高于35 ℃下生长缓慢,在温度为10 ℃和40 ℃时甚至停止生长(图1)。由此可知,该病原菌适宜生长不同小写字母表示差异显著(P<0.05),温度为20~30 ℃,最适生长温度为25 ℃,不耐低温和高温。
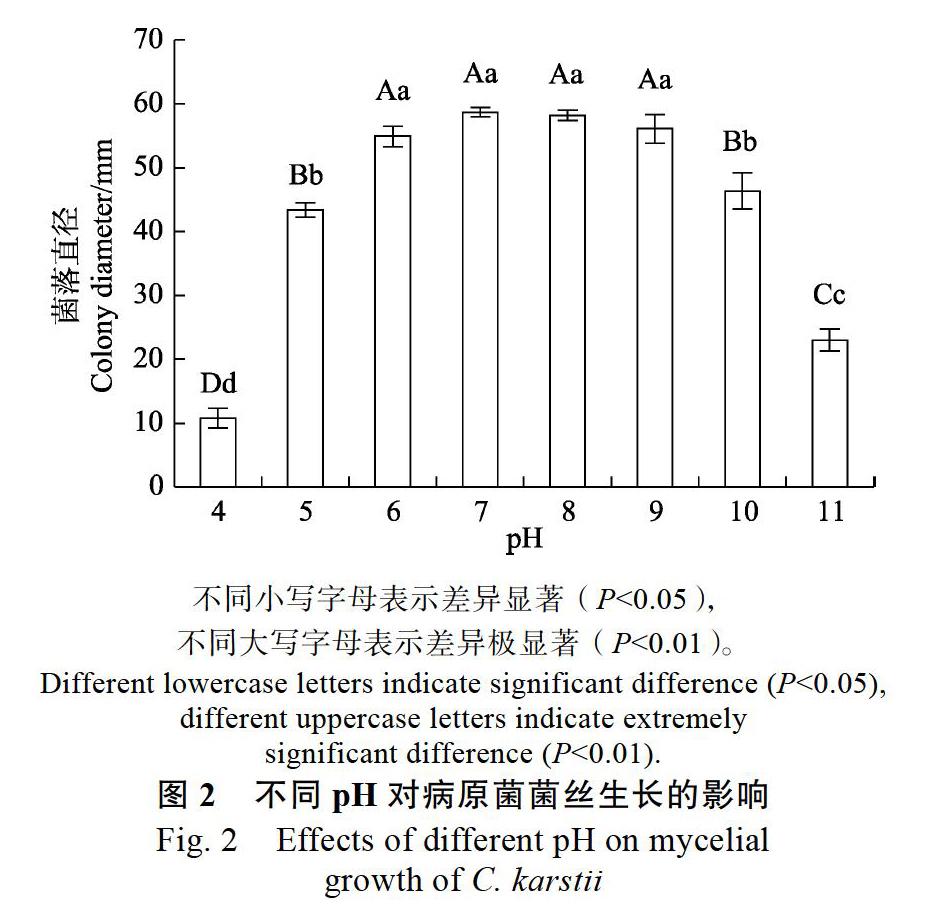
2.1.2 不同pH对病原菌菌丝生长的影响 病原菌在8个不同pH环境下均能生长,菌落生长速度不同,整体呈先升高后下降的趋势。在pH为6~9范围内,病原菌生长趋于缓慢,菌丝较发达,培养6 d菌落直径为54.93~58.73 mm,极显著(P<0.01)高于其余酸碱环境,而在pH小于5和大于10的条件下不适宜菌丝生长,由此表明该病原菌喜中性或偏碱性环境(图2)。
2.1.3 不同光照对病原菌菌丝生长的影响 不同光照培养对病原菌菌丝生长的影响结果见图3。由图3可知,病原菌在全黑暗、黑暗光照交替和全光照处理下均能较好地生长,培养6 d菌落直径分别为55.07、56.17、54.03 mm,相互之间无显著差异(P>0.05),表明该病原菌对光照不敏感。
2.1.4 不同碳源对病原菌菌丝生长的影响 病原菌在供试6种碳源中均能有效生长,且生长速度具有明显差异。在以蔗糖、葡萄糖和麦芽糖为碳源的培养基中菌落生长速率较快,极显著高于缺碳源的对照,可作为培养该病菌较好的碳源。其中又以蔗糖为碳源的培养基菌落生长最快,菌丝发达,培养6 d观察菌落直径为52.20 mm,为病原菌最佳供试碳源(图4)。
2.1.5 不同氮源对病原菌菌丝生长的影响 由图5可知,病原菌在以甘氨酸为氮源的培养基中菌丝生长最快,培养相同时间菌落平均直径为60.17 mm,极显著高于其他不同氮源培养基,菌丝茂密,为病原菌高效利用氮源。在以酵母膏、硝酸钠和蛋白胨为氮源的培养基中菌落生长较快,与不加任何氮源的对照无显著差异,菌丝较为发达。而以尿素、牛肉膏、硫酸铵及氯化铵为氮源的培养基中菌丝生长缓慢,均极显著低于对照组,且菌丝极为稀薄,不适宜病原菌生长。
2.1.6 不同培养基对病原菌菌丝生长的影响 病原菌在8种不同培养基中生长情况明显不同(图6),在SDAY培养基中生长速率最快,菌丝紧密、发达,培养6 d菌落直径达62.23 mm,显著高于其余处理,为病原菌最适生长培养基。其次为OA培养基、高氏1号培养基和Czapek培养基,相互之间无显著差异,菌落直径分别为55.53、55.33、54.03 mm。病菌在CMA培养基和WA培养基上生长最为缓慢,菌丝极为稀疏,不适宜病原菌培养。
2.2 不同杀菌剂对病原菌的室内毒力测定
不同杀菌剂对百香果炭疽病菌菌丝生长的影响存在差异(表2)。其中,以75%肟菌·戊唑醇WG的毒力最强,EC50为0.0667 mg/L。18.7%丙环·嘧菌酯SE、42.4%唑醚·氟酰胺SC、25%吡唑醚菌酯SC和50%咪鲜胺锰盐WP对百香果炭疽病菌也有较好的抑菌活性,EC50分别为0.3335、0.4567、0.4630、0.8187 mg/L。35%氟菌·戊唑醇SC、10%苯醚甲环唑WG和17%苯甲·氟酰胺SC对百香果炭疽病菌的抑制效果相对较差,EC50均大于1.0 mg/L。在供试的9种杀菌剂中,25%丙环唑EC对该病菌的毒力效果最差,其EC50值高达为67.5018 mg/L。
3 讨论
病原菌的生物学特性是监控病害发生的前提条件[28-29]。目前关于C. karstii的生物学特性研究国内外尚未见报道。本研究结果表明,C. karstii适宜在20~30 ℃下生长,最适生长温度为25 ℃,这与余贤美等[28]报道的同种属的柿树炭疽病菌(C. horri)结果一致;病原菌对供试的6种碳源和8种氮源均能有效利用,最佳碳源为蔗糖,最佳氮源为甘氨酸,该病菌对碳源蔗糖的高效利用与刘倩丽等[30]对檀香炭疽病菌(C. fructicola)的研究结果相吻合;病原菌对酸碱环境适应性较广,在pH为4~11范围内均能生长,最适生长pH为6~9,喜中性或偏碱性环境,此结果与谢美华等[18]报道的紫果西番莲炭疽病菌(Colletotrichum sp.)适宜生长pH范围基本一致;该病原菌对光照要求并不严格,在全黑暗、黑暗光照交替和全光照3种不同培养条件下生长速率无显著差异,与赵杰等[31]对无花果炭疽病菌(C. gloeosporioides)的研究结果相符;病原菌可在PDA、Czapek、SDAY等多种培养基上生长,在SDAY培养基上生长最好,菌丝发达,该结果与前人[18, 32]相关研究结果不同,这可能与种间差异或不同寄主植物等因素有关。
化学药剂防治是植物炭疽病有效防控的重要手段,对于该病害的防治研究已有相关报道,杨成德等[33]研究发现,75%肟菌·戊唑醇WG和50%咪鲜胺锰盐WP对马铃薯炭疽病菌的防治效果较好,EC50分别为5.00 μg/mL和6.50 μg/mL;王妮等[34]研究表明,25%咪鲜胺EC和30%吡唑醚菌酯SC对辣椒炭疽病菌的抑制作用最强,EC50值分别为0.25 mg/L和0.72 mg/L;肖敏等[35]对节瓜炭疽病菌进行室内毒力测定发现,50%咪鲜胺锰盐WP和250 g/L嘧菌酯SC的毒力较好,EC50分别为0.0009、0.0127 μg/mL;谢美华等[18]研究表明,福美双对紫果西番莲炭疽菌具有较强的抑制效果。本研究采用菌丝生长速率法测定9种常用化学药剂对百香果喀斯特炭疽菌的室内毒力,结果显示75%肟菌·戊唑醇WG、42.4%唑醚·氟酰胺SC、18.7%丙环·嘧菌酯SE、25%吡唑醚菌酯SC和50%咪鲜胺锰盐WP室内毒力较强,其EC50值均小于1 mg/L,分别为0.0667、0.3335、0.4567、0.4630、0.8187 mg/L,可作为田间防治百香果炭疽病的首选杀菌剂。
本研究采用菌丝生长速率法研究常用化学杀菌剂对百香果炭疽病菌的室内毒力,是杀菌剂与病原菌菌丝直接接触时产生的效果,但田间防治效果不仅与此因素有关,还与病原菌的孢子[36]、杀菌剂的特性[37]、寄主植物的生长环境[38]等因素有关。因此,在后续研究中可进一步进行田间防效试验,研究杀菌剂与病原菌孢子的作用关系,为百香果炭疽病防治提供一定的科学理论依据。
参考文献
[1]焦 楠, 朱 宁, 程春振, 等. 西番莲TeMV和CMV双重RT-PCR检测体系的建立及应用[J]. 果树学报, 2019, 36(7): 947-953.
[2]严佳文, 袁启凤, 解 璞, 等. 利用小RNA测序技术检测贵州西番莲病毒[J]. 热带作物学报, 2019, 40(8): 1577- 1584.
[3]李程勋, 李爱萍, 徐晓俞, 等. 百香果果皮精油提取及香气成分分析[J]. 福建农业学报, 2019, 34(4): 495-501.
[4]Juliane Viganó, Coutinho J P, Souza D S, et al. Exploring the selectivity of supercritical CO2 to obtain nonpolar fractions of passion fruit bagasse extracts[J]. Journal of Supercritical Fluids, 2016, 110: 1-10.
[5]陈正培, 吴婉莹, 张 银, 等. 百香果果浆内生细菌的分离鉴定及生长条件的研究[J]. 中国酿造, 2019, 38(8): 46-49.
[6]Yuan T Z, Kao C L, Li W J, et al. Chemical constituents of leaves of passiflora edulis[J]. Chemistry of Natural Compounds, 2017, 53(6): 1165-1166.
[7]劉纯友, 殷朝敏, 黄永春, 等. 百香果皮多糖的分离纯化、结构特性及生物活性研究进展[J]. 食品工业科技, 2018, 39(8): 335-340, 351.
[8]许凤清, 范卫卫, 字成庭, 等. 紫果西番莲茎叶中3个新苷类化合物[J]. 有机化学, 2018, 38(2): 526-530.
[9]贺银菊, 杨再波, 彭莘媚, 等. 响应面优化紫果西番莲多糖提取工艺及抗氧化活性研究[J]. 食品研究与开发, 2020, 41(4): 38-44.
[10]田 丰, 陈家润. 贞丰县鲁容乡百香果产业发展现状及前景探讨[J]. 南方农业, 2018, 12(28): 90-92.
[11]彭 琴, 黄 崭, 喻 卉, 等. 鲁容乡百香果产业发展现状及展望[J]. 耕作与栽培, 2018(4): 57-59, 51.
[12]冉 飞, 高 强, 龙友华, 等. 贵州百香果炭疽病病原鉴定[J/OL]. 植物病理学报: 1-6[2020-04-03]. https://doi. org/10.13926/j.cnki.apps.000433.
[13]Bravo N, Bejarano C, Pineda L B. Anthracnose of passion fruit in the Valley of Cauca[J]. Ascolfi Informa, 1993, 2(8): 10-11.
[14]Wolcan S, Larran S. First report of anthracnose caused by Glomerella cingulata on passion fruit in Argentina[J]. Plant Disease, 2000, 84(6): 706-706.
[15]Peres N A R, Kuramae E E, Dias M S C, et al. Identification and characterization of Colletotrichum spp. affecting fruit after harvest in Brazil[J]. Journal of Phytopathology, 2002, 150(3): 128-134.
[16]Tarnowski T L B, Ploetz R C. First report of Colletotrichum boninense, C. capsici, and a Glomerella sp. as causes of postharvest anthracnose of passion fruit in Florida[J]. Plant Disease, 2010, 94(6): 786-786.
[17]Du Y X, Shi N N, Chen W L, et al. Identification of Colletotrichum brevisporum causing anthracnose on passion fruit[J]. Canadian Journal of Plant Pathology, 2017, 39(4): 527-532.
[18]谢美华, 杨金奎, 李雪玲, 等. 紫果西番莲炭疽病病原菌鉴定及生物学特性研究[J]. 西南农业学报, 2017, 30(6): 1358-1363.
[19]陈宏州, 杨红福, 姚克兵, 等. 水稻恶苗病病原菌鉴定及室内药剂毒力测定[J]. 植物保护学报, 2018, 45(6): 1356-1366.
[20]胡艳红, 崔林开, 郭金利, 等. 花生焦斑病菌的鉴定及生物学特性分析[J]. 植物保护学报, 2020, 47(1): 221-222.
[21]吴希禹, 付永平, 李 玉. 香菇蛛网病病原菌树状枝葡霉生物学特性[J]. 菌物学报, 2019, 38(5): 646-657.
[22]方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998.
[23]田守波, 朱为民, 朱龙英, 等. 番茄棒孢叶斑病病原鉴定及生物学特性研究[J]. 植物保护, 2020, 46(3): 157-162, 166.
[24]安小丽, 武 娴, 任亚峰, 等. 茶叶斑病病原菌茶拟盘多毛孢(Pseudopestalotiopsis theae)鉴定及生物学特性[J]. 中国植保导刊, 2020, 40(1): 12-19, 47.
[25]温晓蕾, 齐慧霞, 孙伟明, 等. 北苍术枝枯病病原菌(Fusarium equiseti)的鉴定及其生物学特性研究[J]. 中国农业科技导报, 2020, 22(5): 115-121.
[26]吴如慧, 李增平, 陈礼浪. 木麻黄茎腐病病原菌的鉴定及其生物学特性测定[J]. 热带作物学报, 2019, 40(2): 334-340.
[27]吴文能, 张 起, 雷霁卿, 等. “贵长”猕猴桃软腐病病原菌分离鉴定及抑菌药剂筛选[J]. 北方园艺, 2018(16): 7-54.
[28]余贤美, 侯长明, 王 洁, 等. 柿树炭疽病菌的生物学特性及其抑菌药剂筛选[J]. 中国南方果树, 2018, 47(2): 114-119.
[29]郑肖兰, 贺春萍, 高亚男, 等. 咖啡炭疽病菌生物学特性及其毒力测定[J]. 热带农业科学, 2015, 35(12): 94-98.
[30]刘倩丽, 周国英, 刘成锋, 等. 檀香炭疽病病原鉴定及其生物学特性研究[J]. 热带作物学报, 2014, 35(11): 2266-2273.
[31]赵 杰, 支月娥, 赵宝明, 等. 无花果炭疽病菌生物学特性及药剂的毒力测定[J]. 北方园艺, 2016(14): 126-129.
[32]李国光, 田瑞华, 赵 磊, 等. 辣椒炭疽病病原菌生物学特性及其拮抗菌防效研究[J]. 农产品加工, 2018(7): 11-15.
[33]杨成德, 姜红霞, 陈秀蓉, 等. 甘肃省马铃薯炭疽病的鉴定及室内药剂筛选[J]. 植物保护, 2012, 38(6): 127-133.
[34]王 妮, 尹显慧, 彭丽娟, 等. 辣椒炭疽病病原鉴定及其杀菌剂毒力测定[J]. 植物保护, 2019, 45(4): 216-223.
[35]肖 敏, 曾向萍, 严婉荣, 等. 八种药剂对节瓜炭疽病菌的毒力测定与田间防效[J]. 北方园艺, 2017(23): 16-22.
[36]宋慧云, 段志豪, 张伟豪, 等. 宫粉羊蹄甲炭疽病病原鑒定及其药剂筛选[J]. 南方农业学报, 2018, 49(10): 1975-1981.
[37]单体江, 宋慧云, 段志豪, 等. 短萼仪花炭疽病病原鉴定及其药剂筛选[J]. 中国植保导刊, 2019, 39(2): 5-11.
[38]杨友联, 刘永翔, 刘作易. 水果采后炭疽病病原鉴定[J]. 西南农业学报, 2014, 27(3): 1114-1123.
责任编辑:谢龙莲
