胶红酵母(Rhodotorula mucilaginosa)对梨果采后青霉病、灰霉病的控制效果
2015-09-10束兆林杨红福陈红州等
束兆林 杨红福 陈红州等

摘要: 研究胶红酵母对梨果采后贮存过程中青霉菌、灰霉菌的控制效果,采用生长速率法分别测定了胶红酵母对这2种霉菌的室内抑菌毒力。测定结果表明:胶红酵母对青霉菌、灰霉菌的LD50分别为2 560万、2 940万CFU/mL,LD95分别为156亿、251亿CFU/mL。由结果看出,胶红酵母浓度越高,抑菌效果越好。
关键词: 胶红酵母;梨果;青霉菌;灰霉菌;毒力测定
中图分类号:S436.612.1+9 文献标志码:A
文章编号:1002-1302(2015)08-0110-02
水果在采摘、运销、储藏过程中因腐烂造成的损失是巨大的,也是全球关注的问题 [1]。梨是我国主栽水果之一,营养价值很高,但是由于梨果实含水量大、表皮脆弱、内含物丰富,采摘贮存过程中主要易受青霉、灰霉等植物病原真菌的侵染 [1-2],在贮存时容易腐烂、变质等。因此,要大范围流通梨果,储运保鲜问题日益突出。长期以来,世界对水果病害包括采后病害的控制主要依赖于化学杀菌剂。随着人们生活水平不断提高,人们对食品安全的要求越来越强烈,因此研究并开发新的水果采后防腐途径,采用生物防治显得具有重要意义。梨果采收后容易受到青霉菌及灰霉菌的侵染造成烂果,许多酵母品种作为一类拮抗微生物,对果蔬采后青霉菌、灰霉菌等引起的病害都具有明显的防治作用。从柠檬果实表面分离得到的汉逊德巴利酵母(Debaryomyces hansenii),在11℃或22℃条件下,能够抑制青霉病菌时间长达21 d [3];假丝酵母对苹果采后灰霉病的防治也具有很好的效果,并且发现Ca 2+对这种防治效果具有促进作用 [4];用隐球酵母属的Cryptococcus infirmo-miniatus、红酵母属的Rhodotorula glutinis在采收前1 d对梨进行处理,能够有效地控制梨采后腐烂 [5]。胶红酵母(Rhodotorula mucilaginosa)是一种拮抗酵母菌,研究表明,胶红酵母对梨灰霉病(由Botrytis cinerea引起)、桃果青霉病(由Penicillium expansum引起)都表现出显著的拮抗效果,是被证明能有效控制水果采后病害的酵母拮抗菌 [1]。本研究通过果实室内毒力试验,研究胶红酵母对青霉菌、灰霉菌的控制效果,以期为梨果采后贮存及保鲜提供新的途径。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料 试验材料为正常成熟的梨果实,品种为幸水,购自江苏省句容市丰之源梨园,选择无机械损伤、未感染、大小、成熟度等外观品质基本一致的果实,分组待用。
1.1.2 试验菌株 胶红酵母(Rhodotorula mucilaginosa) 由江苏大学食品与生物工程学院实验室提供;青霉菌(Penicillium italicum)、灰霉菌(Botrytis cinerea)从腐烂的梨果果实上分离得到。
1.1.3 试验仪器 恒温摇床(上海智城分析仪器制造有限公司);高速离心机(Thermo);千分之一电子天平(台湾樱花股份有限公司);恒温箱(宁波江南仪器厂)。
1.2 试验方法
1.2.1 菌种处理 在250 mL的三角瓶中装入50 mL的 NYDB (8 g牛肉浸膏、5 g酵母浸膏、10 g葡萄糖、1 000 mL水)培养基,用接种环接入2环活化的胶红酵母,37 ℃、200 r/min 条件下培养20 h;将上述培养混合物在28°C、7 000 g 条件下离心10 min,用无菌生理盐水洗涤2次,去除培养介质,并用无菌生理盐水重新悬浮酵母细胞;用血球记数板调节细胞浓度为24亿 CFU/mL,再将浓度为24亿CFU/mL的酵母细胞悬浮液用无菌生理盐水依次稀释10、100、1 000、10 000倍。将青霉菌、灰霉菌分别接种在PDA培养基(将200 g 去皮马铃薯加水煮沸20 min后过滤,滤液中加入20 g葡萄糖、20 g琼脂,用蒸馏水定容至1 000 mL)中,于28°C培养 7 d 后,将其悬浮在无菌水中,用血球计数板在显微镜下对病原菌孢子数进行测定,用无菌水调节孢子浓度至7万个/mL。
1.2.2 室内毒力测定 先用0.1%次氯酸钠(NaClO)溶液将梨果浸泡30 s,用无菌水冲洗果实后,再用毛巾抹干果实,后用消过毒的打孔器在每个果实表面赤道部位制造直径5 mm、深3 mm的伤口。每个伤口处等量加入30 μL以下浓度胶红酵母孢子悬浮液溶液:24.0亿、2.4亿、2 400.0万、240.0万、24.0万CFU/mL的酵母菌溶液,以及无菌水(空白对照)。3 h 后在每个伤口处接种30 μL等量的青霉菌或灰霉菌原菌孢子液,自然晾干后,将果实放入塑料筐并用保鲜膜密封,于恒温、恒湿培养箱中培养(温度25 ℃,相对湿度95%)。每个处理重复3次,每个重复设10个果实。经过5 d的培养,分别测量各处理病斑直径,计算抑制率,并根据病斑直径抑制率、浓度对数计算胶红酵母LD50,以此评价胶红酵母对梨果上2种常见霉菌的抑制效果。
1.3 数据处理
数据处理中用到的公式为:
病斑直径抑制率=(空白对照病斑直径-胶红酵母处理病斑直径)/空白对照病斑直径×100%。
采用DPS 13.0专业版数据处理系统,以病斑直径抑制率值作为纵坐标、药剂质量浓度转化为对数值作为横坐标,根据斑直径抑制率值(y)与质量浓度对数(x)之间的线性回归关系,求毒力回归方程、相关系数,并计算LD50、LD95及其95%置信限。
2 结果与分析
2.1 胶红酵母对梨果采后贮存过程中2种霉菌病斑生长的影响
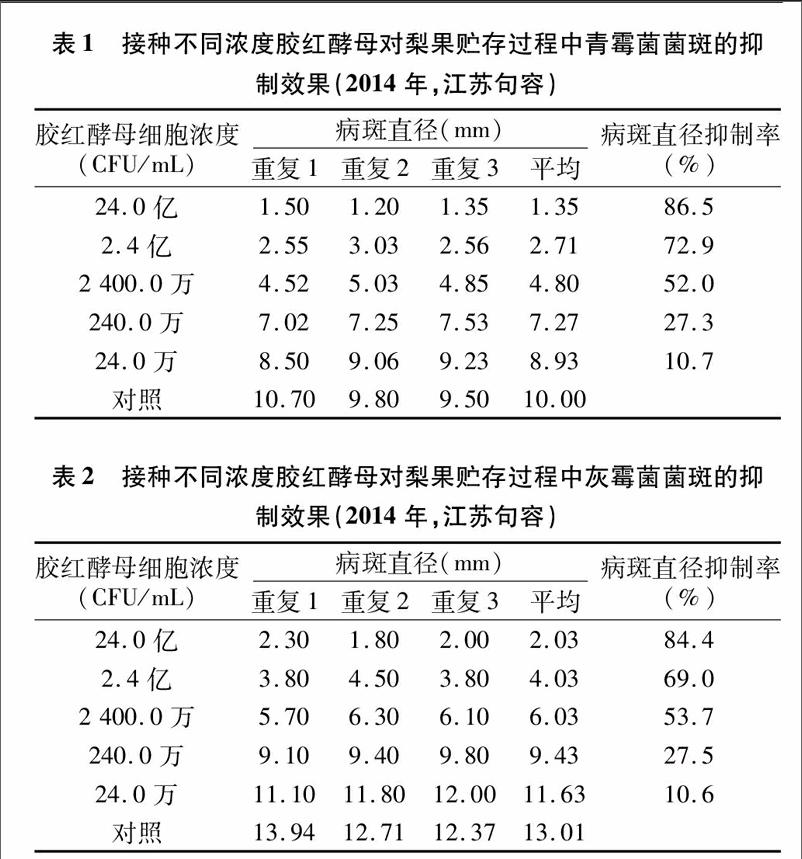
从表1、表2可以看出,不同浓度的胶红酵母对梨果上青霉菌、灰霉菌病斑生长都有一定的抑制作用。经过5 d培养,对照梨果上接种青霉菌处理组的病斑沿接种中心向四周扩张,出现水渍状软腐,接种灰霉菌处理组由中心向四周出现浅黄褐色不规则形软腐病病斑,2类病斑直径分别为10.00、13.01 mm;而经过浓度为24.0亿CFU/mL胶红酵母处理后,青霉病斑直径仅为1.35 mm,灰霉病斑直径为5.81 mm,病斑直径抑制率分别达到86.5%、55.3%;胶红酵母溶液稀释10、100、1 000、10 000倍后对梨果上2种霉菌病斑直径抑制率分别为72.9%、52.0%、27.3%、10.7%,69.0%、53.7%、27.5%、10.6%,均明显优于对照,且浓度越高,菌斑抑制效果越好。
2.2 胶红酵母对梨果采后贮存过程中2种霉菌的毒力测定结果
由表3可知,根据病斑直径抑制率与胶红酵母浓度对数建立的线性关系,胶红酵母对青霉菌、灰霉菌的LD50分别为2 560万、2 940万CFU/mL,LD95分别为156亿、251亿CFU/mL,胶红酵母浓度对数与2种霉菌病斑抑制率之间有很强的线性关系,相关系数均达到0.99以上。
3 结论与讨论
酵母菌通过以下3种途径发挥其对病原菌拮抗作用:(1)拮抗酵母菌通过与病原菌竞争果实表面的营养及侵染位点,在果实表面形成保护屏障,有效抵抗病原菌的侵入 [6];(2)拮抗酵母菌繁殖速度快,对环境适应能力强,能有效利用果蔬表面低营养物质而迅速扩大种群数量,使病原菌得不到足够的营养与空间条件,不能生长增殖,达到抑制病害发生的目的;(3)酵母菌的拮抗机制还有寄生和诱导抗性 [7],本试验人为在梨果表面形成伤口,接入2种梨果贮藏期常见的病菌,结果表明,胶红酵母对青霉菌、灰霉菌2种霉菌的抑菌LD50分别为2 560万、2 940万CFU/mL,LD95分别为156亿、251亿CFU/mL,且浓度越高,抑菌效果越好。有研究表明,23 ℃条件下黏红酵母(Rhodotorula glutinis)浓度达到10亿CFU/mL时能完全抑制柑橘上青霉病的发生 [8],25 ℃ 条件下丝孢酵母(Trichosporon sp.)悬浮液浓度为1亿CFU/mL时能显著抑制苹果果实表面伤口处青霉菌、灰霉菌的发生 [9]。引起果实腐烂的病原微生物大多腐生性强,一般通过果实上的皮孔、气孔或是机械损伤形成的伤口侵入,其孢子萌发和致病活动需要大量的外源营养。本试验中,酵母对2种病原菌在前3 d抑制效果好,7 d后开始下降,这可能是部分病原菌突破酵母保护层,侵入果实而导致发病腐烂,进一步说明胶红酵母对梨果的保护效果主要源于酵母细胞在伤口表面的快速繁殖而阻止病原菌的侵入。酵母的抑菌效果跟自身菌体数量相关,而菌体滤液不能抑制病斑的扩展,所以拮抗酵母抑菌机制不是靠产生抗生素,而可能是与病菌在伤口处具有较强的营养竞争有关 [10-11]。
虽然许多酵母菌已被证实对水果病原菌具有拮抗作用,但到目前为止,我国仍未进行商业化应用,其主要原因是在实际生产条件下,由于环境条件的不确定性,其防治效果往往达不到要求或者不稳定。但由于胶红酵母具有诸多优点,随着研究理论的不断深入、生防技术的日趋完善,胶红酵母等拮抗菌极有可能填补果蔬采后病害防治技术方面的不足,胶红酵母在果蔬采后防腐保鲜领域有着广阔的发展空间。
参考文献:
[1] 徐占利. 梨果采后病害新型拮抗菌分离、筛选及安全性研究[D]. 镇江:江苏大学,2010.
[2]王海燕. 苹果、梨贮藏期病害——青霉病的防治[J]. 河南农业科学,1991(10):34.
[3]Chalutz E,Wilson C L. Postharvest biocontrol of green and blue mold and sour rot of citrus fruit by Debaryomyces hansenii[J]. Plant Disease,1990,74(2):134-137.
[4]Wisniewski M,Droby S,Chalutz E,et al. Effects of Ca 2+and Mg 2+on Botrytis cinerea and Penicillium expansum in vitro and on the biocontrol activity of Candida oleophila[J]. Plant Pathology,1995,44(6):1016-1024.
[5]Benbow J M,Sugar D. Fruit surface colonization and biological control of postharvest diseases of pear by preharvest yeast applications[J]. Plant Disease,1999,83(9):839-844.
[6]刘海波,田世平. 水果采后生物防治拮抗机理的研究进展[J]. 植物学通报,2001,18(6):657-664.
[7]于 帅,刘天明,魏 渱. 拮抗酵母菌对果蔬采后病害生物防治的研究进展[J]. 食品工业科技,2010(9):402-405.
[8]孙 萍,郑晓冬,张红印,等. 黏红酵母与金属离子结合使用对柑橘采后青霉病的抑制效果[J]. 果树学报,2003,20(3):169-172.
[9]范 青,田世平,徐 勇. 丝孢酵母对苹果采后灰霉病和青霉病抑制效果的影响[J]. 中国农业科学,2001,34(2):163-168.
[10] McLaughlin R J,Wilson C L,Droby S,et al. Biological control of postharvest diseases of grape,peach,and apple with the yeasts Kloeckera apiculata and Candida guilliermondii[J]. Plant Disease,1992,76(5):470-473.
[11]Fan Q, Tian S P. Postharvest biological control of rhizopus rot of nectarine fruits by Pichia membranefaciens[J]. Plant Disease,2000,84(11):1212-1216.
