miR-140-5p对炎症模型支气管上皮细胞炎症因子分泌的影响
2021-06-08刘彩林
张 俊,马 冰,刘彩林
1)驻马店市中心医院检验科 河南驻马店 463000 2)河南省人民医院检验科 郑州 450000 3)郑州大学第一附属医院检验科 郑州 450052
miRNA是一种单链RNA分子,在多种生物体中广泛存在,其不仅参与调控细胞分化、衰老、免疫反应等正常生理过程,还与人类疾病的发生关系密切[1]。炎症与多种miRNA的异常表达有关,这些miRNA通过调控下游靶基因的表达影响靶细胞炎症因子的合成和分泌[2]。miR-140-5p是近些年来发现的具有多种生物学作用的miRNA,在肿瘤、关节炎等疾病的发生发展过程中发挥作用[3-4]。以前的研究[5]发现,miR-140-5p在支气管哮喘模型小鼠肺组织中表达下调。呼吸道合胞病毒(respiratory syncytial virus,RSV)是一种常见的病原体,其可以诱导肺炎、毛细支气管炎发生,RSV刺激可促使支气管上皮细胞释放大量炎症因子,这也是RSV加重哮喘的重要原因[6-7]。本实验以RSV感染人支气管上皮细胞16-HBE,构建支气管上皮细胞炎症模型,探讨miR-140-5p在支气管上皮细胞炎症反应中的作用和机制。
1 材料与方法
1.1细胞、主要试剂和仪器16-HBE购自上海康朗生物科技有限公司。RSV病毒Long株购自美国ATCC。Lipofectamine2000购自美国Invitrogen公司,miR-140-5p阴性对照(miR-NC)及其mimic购自百奥迈科生物技术有限公司,Toll样受体4(Toll-like receptor 4,TLR4)过表达载体及其阴性对照载体由北京信诺金达生物科技有限公司构建。双荧光素酶报告实验试剂盒购自上海碧云天生物技术研究所。Trizol试剂、反转录试剂盒、Real-time PCR 试剂盒购自赛默飞世尔科技有限公司。IL-6、IL-8含量检测试剂盒购自北京百奥莱博科技有限公司,IL-1β含量检测试剂盒购自武汉艾美捷科技有限公司,NO含量检测试剂盒购自南京碧云天生物技术研究所,TNF-α含量检测试剂盒购自南京森贝伽生物科技有限公司。iNOS、TLR4抗体购自美国Abgent公司。酶标仪和荧光定量PCR仪购自美国Thermo公司;凝胶成像系统购自英国Syngene公司;全自动激光共聚焦显微镜购自日本Olympus公司。
1.2miR-140-5p与TLR4靶向关系的预测和鉴定利用生物信息学软件TargetScan分析miR-140-5p的靶基因,发现miR-140-5p和TLR4的3’UTR有互补结合位点,利用双荧光素酶报告实验鉴定二者的靶向关系。将含有野生型(WT)或突变型(MUT)TLR4 3’UTR结合位点的荧光素酶报告载体分别与miR-NC、miR-140-5p mimic共转染到16-HBE细胞中,培养24 h以后,测定荧光素酶活性。
1.3上调miR-140-5p表达对炎症模型16-HBE细胞炎症因子分泌和NO合成的影响
1.3.1 实验分组 将16-HBE细胞分成空白对照组、RSV组、miR-NC+RSV组、miR-140-5p+RSV组,RSV组、miR-NC+RSV组、miR-140-5p+RSV组细胞感染RSV(MOI=1)24 h,以制备炎症模型。然后miR-NC+RSV组、miR-140-5p+RSV组分别转染miR-NC、miR-140-5p mimic,按照Lipofectamine2000说明操作。转染24 h后进行指标检测。实验均重复3次。
1.3.2 Real-time PCR法检测细胞中miR-140-5p的表达 分别收集4组细胞,每107个细胞内添加1 mL Trizol试剂以提取细胞总RNA。RNA经紫外分光光度计测定,OD(260 nm)/OD(280 nm)比值介于1.8~2.0,可以用于后续实验。取1 μg总RNA,添加1 μL的Oligo dT Primer,加RNase水补足12 μL,置于85 ℃结合5 min,冰上冷却,然后添加1 μL的RNase抑制剂、1 μL的dNTP、4 μL的5×缓冲液、1 μL的RT,最后添加RNase水补足20 μL。反转录条件:30 ℃10 min,42 ℃50 min,85 ℃10 min。合成的cDNA保存在-20 ℃冰箱中。取100 ng的cDNA,加入0.4 μL的ROX reference Dye Ⅱ, 上下游引物各0.4 μL, 10 μL的SYBR Premix EX Taq,最后加ddH2O补足20 μL。PCR反应条件:预变性95 ℃ 30 s,变性95 ℃ 5 s,退火延伸60 ℃ 34 s,共40个循环。按照2-ΔΔCt法分析miR-140-5p表达水平。miR-140-5p上游引物序列为5’-GAGTGTCAGTG GTTTTACCCT-3’,下游为5’-GCAGGGTCCGAGG TATTC-3’;内参U6上游引物序列为5’-CTCGCT TCGGCAGCACATATACTA-3’,下游为5’-ACGAATTTGCGTGTCATCCTTGCG-3’。
1.3.3 ELISA法检测细胞TNF-α、IL-1β、IL-6、IL-8分泌量 收集4组细胞培养上清,ELISA法测定TNF-α、IL-1β、IL-6、IL-8含量,按试剂盒说明操作。
1.3.4 Griess法检测NO生成量 收集4组细胞培养上清,Griess法测定NO含量,按试剂盒说明操作。
1.3.5 Western blot法检测细胞中iNOS和TLR4蛋白的表达 收集4组细胞, RIPA裂解,低温高速离心10 min,吸取上清,以BCA法检测蛋白浓度。将蛋白样品和等体积的Loading Buffer充分混合后,按照每孔40 μg蛋白样品上样,SDS-PAGE(100 g/L分离胶、50 g/L浓缩胶)进行蛋白分离。将PVDF膜浸泡在转移缓冲液中孵育5 min,在50 g/L脱脂奶粉溶液中室温摇床孵育1 h,再分别置于iNOS和TLR4一抗稀释液(均按1∶800稀释)中于4 ℃冰箱中摇床孵育12 h, 然后置于二抗稀释液(按1∶3 000稀释)中室温摇床孵育1 h,ECL发光,Image J分析。以目的蛋白和内参GAPDH条带灰度值的比值表示目的蛋白表达水平。
1.4过表达TLR4对上调miR-140-5p表达的炎症模型16-HBE细胞炎症因子分泌和NO合成的影响将TLR4阴性对照载体和miR-140-5p mimic(miR-140-5p组)、TLR4过表达载体和miR-140-5p mimic(miR-140-5p+ TLR4)分别共转染到16-HBE细胞中,培养24 h后,感染RSV(MOI=1)继续孵育24 h。检测培养上清中TNF-α、IL-1β、IL-6、IL-8、NO含量及细胞中iNOS、TLR4蛋白表达水平,操作同上,均重复3次。
1.5统计学处理实验数据用SPSS 21.0分析。空白对照组、RSV组、miR-NC+RSV组、miR-140-5p+RSV组间miR-140-5p表达水平,TNF-α、IL-1β、IL-6、IL-8分泌量,NO生成量,iNOS和TLR4蛋白表达水平的比较均采用单因素方差分析,组间两两比较采用SNK-q检验;miR-140-5p组、miR-140-5p+ TLR4组间各指标的比较采用两独立样本t检验;检验水准α=0.05。
2 结果
2.1miR-140-5p与TLR4靶向关系的验证生物信息学分析发现miR-140-5p和TLR4的3’UTR有互补结合位点(图1)。双荧光素酶报告实验结果显示,miR-140-5p mimic和TLR4-3’UTR-WT共转染的细胞荧光素酶活性降低(表1)。

图1 miR-140-5p和TLR4结合位点示意图

表1 荧光素酶活性(n=3)
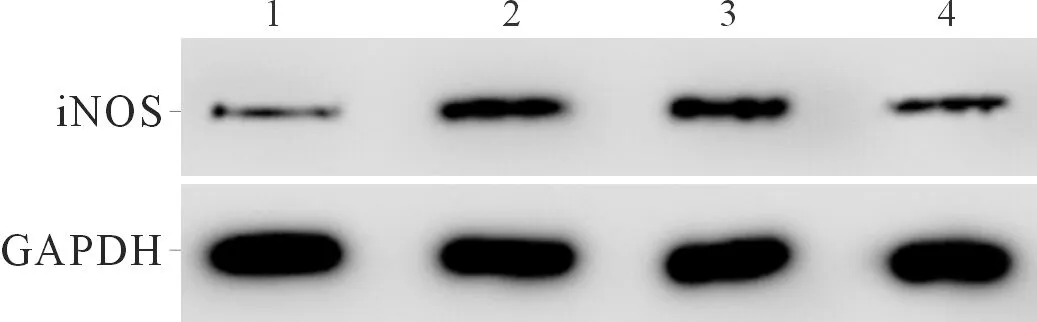
2.2上调miR-140-5p表达后炎症模型细胞中miR-140-5p和TRL4蛋白表达水平的变化空白对照组、RSV组、miR-NC+RSV组、miR-140-5p+RSV组细胞中miR-140-5p和TRL4蛋白表达检测结果见图2、表2。可以看出,miR-140-5p mimic转染可有效提高miR-140-5p的表达;炎症模型细胞中miR-140-5p表达水平降低;miR-140-5p可负调控0炎症模型细胞中TRL4蛋白的表达。

1:空白对照组;2:RSV组;3:miR-NC+RSV组;4:miR-140-5p+RSV组

表2 4组细胞中miR-140-5p和TRL4蛋白的表达水平(n=3)
2.3上调miR-140-5p表达后炎症模型细胞炎症因子分泌和NO合成能力的变化空白对照组、RSV组、miR-NC+RSV组、miR-140-5p+RSV组细胞中炎症因子分泌量、NO生成量和细胞中iNOS蛋白表达水平的比较见图3、表3。可以看出,上调miR-140-5p表达可以降低炎症模型细胞炎症因子分泌和NO合成的能力。
1:空白对照组;2:RSV组;3:miR-NC+RSV组;4:miR-140-5p+RSV组

表3 4组细胞TNF-α、IL-1β、IL-6、IL-8分泌量,NO生成量及细胞中iNOS蛋白表达水平的比较(n=3)
2.4过表达TLR4后miR-140-5p表达上调的炎症模型细胞炎症因子分泌和NO合成能力的变化miR-140-5p组、miR-140-5p+TLR4组各指标测定结果见图4、表4。可以看出,TLR4可逆转miR-140-5p诱导的炎症模型细胞炎症因子生成的作用。
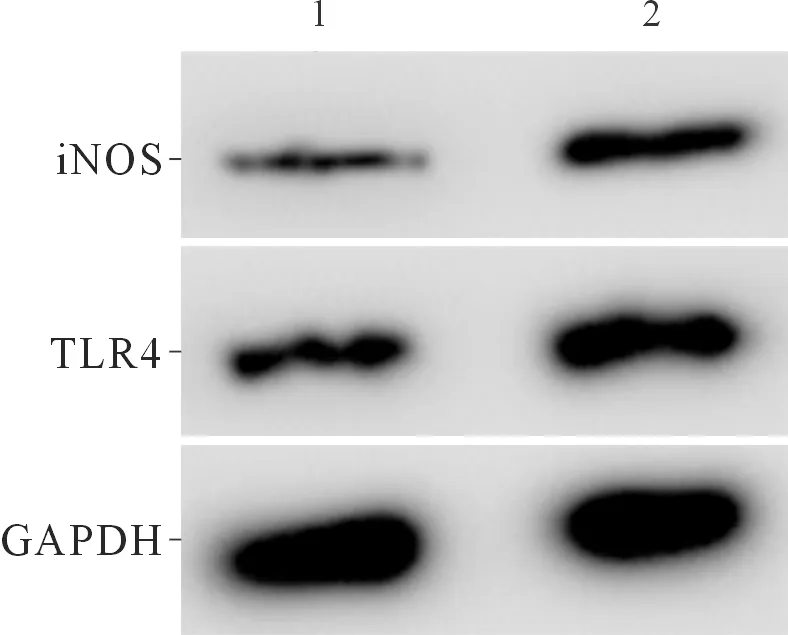
1:miR-140-5p组;2:miR-140-5p+TLR4
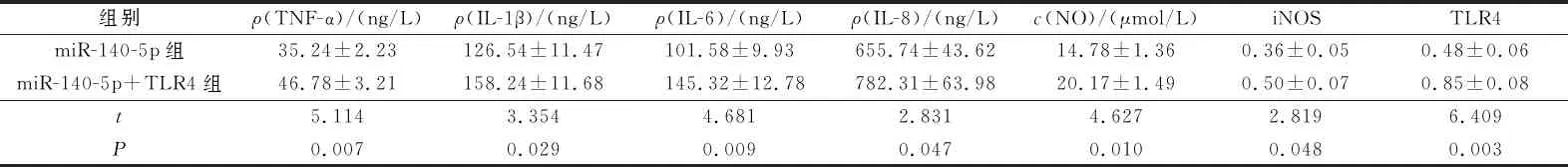
表4 2组细胞TNF-α、IL-1β、IL-6、IL-8分泌量,NO生成量及细胞中TLR4、iNOS蛋白表达水平的比较(n=3)
3 讨论
RSV是一种常见的毛细支气管炎病原体。研究[8]显示,RSV刺激后支气管上皮细胞分泌大量的炎症介质,诱导炎症发生。TNF-α、IL-1β、IL-6、IL-8是常见的促炎因子,其表达升高与支气管哮喘关系密切[9]。NO是一种重要的信号传递分子,也是一种重要的炎症介质,与免疫反应、神经传导等有关[10]。研究[11-13]显示,内源性NO是由NOS催化产生的,iNOS是NOS中与炎症有关的亚型,其在受到炎症因子、内毒素等刺激以后被激活,从而促使大量NO合成,而过量的NO能够推动炎症进展,诱导哮喘、癌症、炎症性肠道疾病等的发生。本研究结果显示,RSV感染后的支气管上皮细胞培养上清中TNF-α、IL-1β、IL-6、IL-8、NO含量均升高,细胞中iNOS蛋白表达水平也升高,提示RSV可诱导支气管上皮细胞炎症介质释放,说明成功构建了支气管上皮细胞炎症模型。
miRNA是一类非编码的RNA分子,能够通过调控下游靶基因的表达发挥多重作用,在人体组织中普遍表达,参与调控不同类型细胞的生长、代谢、衰老、氧化应激等生理过程[14]。miR-140-5p是一个在人体内多种组织中表达的调节因子,参与肿瘤生长、关节炎进展等过程;与支气管哮喘的发生发展关系密切[3-5]。本研究结果显示,miR-140-5p在RSV诱导的炎症模型支气管上皮细胞中表达下调,而上调miR-140-5p表达可以减少炎症模型细胞分泌TNF-α、IL-1β、IL-6、IL-8,降低细胞中iNOS蛋白的表达并减少NO的合成,说明miR-140-5p可抑制支气管上皮细胞炎症介质的释放。
本研究还进一步探讨了miR-140-5p的作用机制,发现miR-140-5p和TLR4的3’UTR有结合位点,并且上调miR-140-5p表达可以降低炎症模型细胞中TLR4蛋白的表达。TLR是存在于细胞表面的免疫受体,可以识别某些病原体或某些特定的分子结构,引发炎症介质释放,参与免疫反应过程[15-16]。TLR4是第一个被发现的TLR家族成员,在几乎所有的细胞系中均有表达,可以诱导IL-6、TNF-α等的表达,放大炎症信号,激发炎症瀑布链[17-18]。敲低TLR4能够抑制RSV诱导的支气管上皮细胞炎症因子的释放[19]。本研究结果表明,TLR4可以逆转miR-140-5p诱导的炎症模型支气管上皮细胞炎症介质的释放抑制作用,提示上调miR-140-5p可通过降低TLR4表达减少支气管上皮细胞炎症介质的释放。
总之,miR-140-5p在RSV诱导的支气管炎症中可能发挥抑制作用,作用机制与靶向下调TLR4的表达有关,这为miR-140-5p在支气管炎症中的应用提供了参考。今后我们会继续探讨miR-140-5p其他可能的靶向调控机制。