尾侧联合肠系膜上静脉优先入路机器人辅助下全结肠系膜切除治疗右半结肠癌的效果
2021-06-08连玉贵周全博段小飞王贵宪袁维堂
连玉贵,周全博,段小飞,王贵宪,袁维堂
郑州大学第一附属医院结直肠外科 郑州 450052
手术仍是治疗可切除右半结肠癌的主要方法。支配右半结肠的供血血管变异较多,且毗邻胰腺、十二指肠等重要脏器,因此手术难度大,手术风险较高。全结肠系膜切除联合中央血管结扎是治疗右半结肠癌的可选术式之一,强调在胚胎层面锐性游离脏壁层筋膜、保证系膜“信封”完整和肿瘤滋养血管的根部结扎,较传统手术更能保证系膜的完整,能够切除更大面积的结肠系膜及获取更多的淋巴结,降低局部复发率,改善远期生存状况[1-3]。
在微创外科时代,全结肠系膜切除手术治疗右半结肠癌常见有3种入路:中间入路[4]、头侧入路[5]及尾侧入路[6]。有研究[6-7]表明,尾侧入路以建立层面优先后离断血管为特点,首先进入升结肠后间隙及胰腺十二指肠前间隙,相比于其他入路,更加有利于右半结肠变异血管的处理和淋巴结清扫。理论上,机器人手术具有高清3D稳定的视野、灵活可旋转540°的机器人腕部结构等,使其在进行组织暴露、分离及淋巴结清扫等操作中更为精准。回顾性研究及Meta分析[8-11]结果表明,机器人全结肠系膜切除术较腹腔镜具有中转开腹率低、术后恢复快、长期生存更优的特点。尾侧联合肠系膜上静脉(superior mesenteric vein,SMV)优先入路机器人辅助下全结肠系膜切除术几乎适用于包括肥胖患者在内的所有病例,其特点在于能确保正确的解剖平面、精确识别关键解剖、优化Henle干属支血管的处理、提高淋巴结切除完整度。本文对该入路方式的技术细节及短期疗效进行了详细分析,报道如下。
1 对象与方法
1.1研究对象回顾性分析郑州大学第一附属医院结直肠外科前瞻性数据库记录的2020年3月至12月行尾侧联合SMV优先入路机器人辅助下全结肠系膜切除术20例患者的临床资料。病例纳入标准:①年龄>18岁。②结肠镜及病理证实为腺癌。③术前CT评估UICC TNM分期为Ⅰ~Ⅲ期。排除标准:①合并其他恶性肿瘤。②M1。③急诊手术、拒绝机器人手术、不能耐受麻醉或手术。患者均签署知情同意书。
20例患者中,男12例,女8例,年龄31~78岁,中位数59岁;体质指数20.6~28.7 kg/m2,中位数24.0 kg/m2;有腹部手术史3例;合并高血压7例,糖尿病5例;ASA分级Ⅰ、Ⅱ级18例,Ⅲ、Ⅳ级2例;肿瘤位于盲肠5例,升结肠4例,肝区11例;T分期T1、T2期2例,T3、T4期18例;N分期N0期12例,N1、N2期8例。
1.2手术方法所有手术由两组医师完成,单个医生年机器人大肠切除手术量超过150例。仔细分析术前影像学资料,以评估可能存在的远处转移、原发肿瘤的T分期以及区域淋巴结转移情况,确定肠系膜上动脉(superior mesenteric artery,SMA)、SMV属支血管解剖特征。患者术前均未行机械性肠道准备。均采用气管插管静吸复合全身麻醉,头低5°~15°,同时左倾10°~15°,使小肠移向脾曲,以便于术野的显露。手术均基于DaVinci SiTMSurgical System平台完成。Trocar孔位置见图1。脐部左下方约3 cm处为12 mm镜头孔,左侧锁骨中线肋缘下2~3 cm为8 mm主操作孔,置入单极电剪或超声刀;麦氏点尾侧2 cm处为8 mm副操作孔,置入双击电凝;在操作孔、镜头孔弧形连线上分别建立12、5 mm辅助孔。机器人自患者右侧、头侧进入完成对接。整个手术过程不再调整体位。肿瘤位于升结肠肝区或横结肠近肝区者,行包括幽门下淋巴结及中结肠血管根部淋巴结清扫的扩大切除术;肿瘤位于回盲部或升结肠近端者则行标准右半结肠切除术。手术步骤如下。
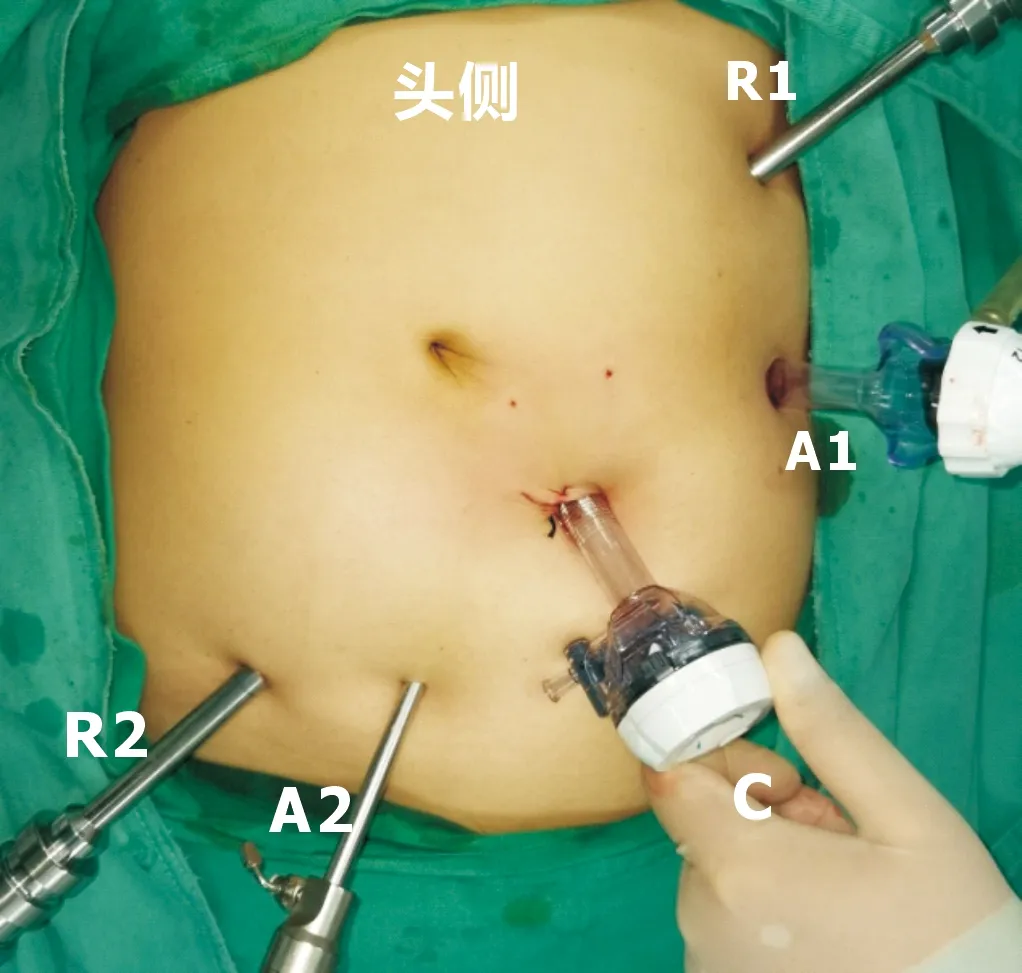
C:12 mm镜头孔;R1:8 mm主操作孔;R2:8 mm副操作孔;A1:12 mm主辅助孔;A2:5 mm副辅助孔
①尾侧入路:首先识别解剖标志(十二指肠、右髂总动脉),于小肠系膜根部与后腹膜交接处右髂总动脉上方约1 cm处自左向右切开腹膜,进入升结肠后间隙。在十二指肠外侧建立平面后继续向右侧扩大平面直至升结肠旁沟,此时可见右侧生殖血管与右侧输尿管被肾前筋膜覆盖(图2A),避免其损伤。转向十二指肠水平部,打开原始后腹膜,进入胰腺十二指肠前间隙,此时可显露SMV、SMA背侧面。继续沿十二指肠降部向头侧游离扩大平面,寻找右结肠或副右结肠静脉,以其为“路标”向汇入Henle干方向推进(图2B)。注意在靠近汇入点时有胰十二指肠上前静脉加入Henle干,在上提升结肠系膜时注意张力,以防其撕裂。在胰十二指肠前方留置小纱布作为标记。
②SMV的显露:转向腹侧,不调整体位,把小肠移向左下腹及盆腔,暴露术野。牵拉回结肠血管蒂,在其汇入SMV尾侧1 cm处切开腹膜。寻找SMV,以SMV左侧缘为“路标”向头侧游离至胰腺下缘。一般SMV前方没有属支血管,可安全清除SMV前方的淋巴、脂肪组织。通过裸化SMV建立游离平面,同时有利于辨认SMA的右侧分支(图2C),以确保完整的淋巴结清扫。由于整个解剖过程靠近SMV,因此应小心处理,以避免出现血管损伤。为避免出血或血栓形成,不要直接抓持SMV。造成血管损伤的最高风险可能是在分支的汇合处,在解剖过程中应避免过度牵引血管以防意外出血。如果遇到出血,应立即纱布压迫,视损伤程度和术者技术水平选择血管缝合线修复缝合或转换为开放性手术。
③回结肠血管蒂的离断(203组淋巴结清扫):提起回结肠血管蒂,于其下方1 cm处切开小肠系膜,与尾侧游离层面相通。SMV前方已经裸化,回结肠静脉(Ileocolic vein,ICV)的SMV汇入点很容易显露。回结肠动脉(Ileocolic artery,ICA)通常位于ICV背侧,离断ICV后更容易显露及清扫ICA根部淋巴结(图2D)。SMA一般走行于SMV左后方,ICA走行于ICV后方更为多见。然而,约42%的ICA走行于SMV前方[12],在裸化SMV时应注意这些血管变异。
④中结肠血管蒂的离断(223组淋巴结清扫):ICV/ICA离断后继续向头侧游离至Henle干水平,此时于SMV左侧胰腺下缘寻找起源于SMA的中结肠动脉(middle colic artery,MCA),中结肠静脉(middle colic vein,MCV)通常位于MCA头侧。自MCA根部向远心端游离至MCA左右支分叉处,根部肿瘤位置决定MCA离断水平(图2E)。结肠肝区肿瘤自MCA/MCV根部离断,其他部位肿瘤可离断MCA/MCV右支。约60%的患者有单独的右结肠动脉(right colic artery,RCA)[12],在进行SMV裸化时需要注意。
⑤Henle干属支的处理:前述手术已沿右结肠静脉(right colic vein,RCV)游离至Henle干起始部。沿Henle干自左向右解剖血管,显露属支。游离并保护胃网膜右静脉,离断RCV(图2F)。此时整个胰十二指肠前间隙处理完毕。第2机器臂可向腹侧上压升结肠系膜,外侧游离至升结肠旁沟,头侧游离至膈结肠韧带,显露十二指肠起始部。
⑥结肠肝区的游离:自胃网膜中段或距肿瘤10 cm以远胃网膜血管弓内或弓外离断胃结肠韧带进入网膜囊。在胃系膜与横结肠系膜间隙内自左侧向肝区方向游离。在上述留置纱布指引下离断大网膜、膈结肠韧带及升结肠侧腹膜。至此,整个右半结肠及其系膜已完全游离。
⑦消化道重建:取上腹正中5 cm切口,经此切口切除标本,完成小肠与横结肠端侧或侧侧吻合,关闭系膜裂孔。冲洗腹盆腔,升结肠旁沟留置引流管一根,关闭各切口,术毕。

A:尾侧入路进入升结肠后间隙,可见输尿管,其被肾前筋膜所覆盖;B:胰十二指肠前间隙,分别暴露SMV背侧及RCV;C: 以SMV左缘为导向向头侧裸化SMV,同时可显露SMA的分支;D:暴露并清扫ICV、ICA根部淋巴结;E:清扫中结肠血管根部淋巴结,MCV、MCA已离断;F:暴露Henle干属支,离断RCV
1.3手术结果术中出血量30~200(中位数80)mL,手术时间135~240(中位数170) min,淋巴结获取总数12~37(中位数19)枚;有1例患者术中出现RCV损伤,给予钛夹夹闭;无中转开腹。术后首次排气时间1~3 d,首次进流食时间1~4 d,引流管拔除时间3~7 d,住院时间6~19(中位数8) d。术后无Clavien-DindoⅢ级以上并发症发生。术后有2例出现并发症,其中1例出现切口感染换药后愈合;另1例出现淋巴漏,初始引流量约300 mL,采取禁食加全胃肠外营养支持加生长抑素后痊愈。无围手术期死亡,无30 d内非计划再次住院或手术。
2 讨论
在传统开腹时代,外侧入路是右半结肠切除的主流入路。在微创外科时代,鉴于器械和手术视野的不同,采取中间入路和尾侧入路越来越普遍。Henle干属支血管变异较多且静脉壁菲薄,如果Henle干显露不清、牵拉张力过高或者操作粗暴极易造成Henle干及其属支的出血,这也是全结肠系膜切除的技术难点。我们采取尾侧入路,自小肠系膜根部切开腹膜进入升结肠后间隙,首先显露右侧输尿管及生殖血管并加以保护。建立起层面后再进入胰十二指肠前间隙,以RCV为导向向SMV方向游离,为后续寻找Henle干和安全离断RCV创造条件。本研究结果显示,术中无重要血管损伤,无Clavien-Dindo Ⅲ级以上并发症发生,与其他研究[8]基本一致。
欧美国家多采取全结肠系膜切除,而日本则采取D3淋巴结清扫术治疗Ⅱ、Ⅲ期结肠癌,二者手术理念相似,都取得了显著的治疗效果,但两者孰优孰劣目前尚无定论[3]。然而,对于右半结肠癌,无论是全结肠系膜切除还是D3淋巴结清扫,均未对淋巴结清扫的内侧界有明确的说明。根据淋巴引流规律,中央组淋巴结位于SMA发出右侧属支的根部,理论上以SMA为内侧界更为合理。但有研究[7,13]表明,以SMA为导向进行淋巴结清扫有较高的腹泻及淋巴漏发生率,且对术者有较高的技术要求,长期生存是否获益仍不明确。因此,目前国际上绝大多数学者均以SMV左缘为手术切除的内侧界限[14-15]。尾侧入路实质是先建立游离空间,以层面为优先,内侧游离终点线恰好为SMV背侧的右侧缘;而以SMV为导向即是淋巴结清扫需要,也为SMV右侧属支的处理提供便利。两种入路联合更加有利于淋巴结清扫和重要血管的保护。本研究详细描述了尾侧联合肠系膜上静脉优先入路机器人辅助下全结肠系膜切除治疗右半结肠癌的技术细节和短期疗效,初步证实了该技术的可行性和安全性。
需要强调的是,机器人辅助下全结肠系膜切除治疗右半结肠癌手术难度较高,对术者和助手有较高的要求,存在较长的学习曲线。在开展此术式时需要优化手术操作,选择合理的手术入路,保证手术安全。该术式的疗效仍有待大样本、多中心的前瞻性研究提供更高级别的循证医学证据。