悬吊式外固定支具有限制动建立的兔膝骨关节炎模型
2021-05-27易强谢利民邝高艳万云峰李肇华曹寅生
易强 谢利民 邝高艳 万云峰 李肇华 曹寅生

〔摘要〕 目的 运用不依赖加压固定的体外关节制动造模方式,制备皮肤软组织健康的兔膝骨关节炎模型。方法 选用雄性新西兰大白兔18只,按照随机数字表法随机分为正常组、传统Videman法造模组(简称Videman组)、悬吊式外固定法造模組(简称悬吊组),各6只。正常组不予任何处理,Videman组单纯采用管型高分子石膏完全制动兔左膝关节于伸直位,悬吊组采用悬吊式外固定支具有限制动兔左膝关节于伸直位。6周后解除关节制动,观察兔皮肤软组织和左膝关节情况,用Bates-Jensen伤口评估工具(the Bates-Jensen wound assessment tool, BWAT)对皮肤软组织健康情况进行评估,用Lequesne MG评分对左膝关节功能进行评估;空气栓塞法处死动物,对左膝关节软骨行大体观察和HE染色病理学观察,并用Pelletier评分及Mankin评分对软骨损伤情况进行评估。结果 (1)皮肤软组织健康情况比较,与正常组和悬吊组相比,Videman组BWAT评分升高(P<0.05);悬吊组与正常组BWAT评分比较,差异无统计学意义(P>0.05)。(2)左膝关节功能比较,与正常组相比,Videman组和悬吊组Lequesne MG评分均显著升高(P<0.01);Videman组和悬吊组Lequesne MG评分比较,差异无统计学意义(P>0.05)。(3)正常组左膝关节软骨大体观察和HE染色观察结果均正常,Videman组和悬吊组均见典型的软骨破坏,符合膝骨关节炎病理学改变。与正常组相比,Videman组和悬吊组Pelletier评分及Mankin评分均显著升高(P<0.01),达到轻中度骨关节炎的评分等级;Videman组和悬吊组Pelletier评分及Mankin评分比较,差异均无统计学意义(P>0.05)。结论 悬吊式外固定支具有限制动膝关节于伸直位的造模方式可成功制备皮肤软组织健康的兔膝骨关节炎模型,其造模效果与传统Videman造模法效果一致,但对皮肤软组织的保护能力强于后者。
〔关键词〕 膝骨关节炎;悬吊;有限制动;动物模型;兔
〔中图分类号〕R684;R274 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.02.014
〔Abstract〕 Objective To establish the model of knee osteoarthritis in rabbits with healthy skin and soft tissue by using the method of external joint braking with unpressurized fixation. Methods A total of 18 male New Zealand white rabbits were selected and randomly divided into the normal group, the traditional Videman model group (Videman group) and the suspension external fixation model group (suspension group) according to random number table method, with 6 rabbits in each group. The normal group did not do any treatment, the Videman group simply used tube type polymer gypsum to completely fix the left knee joint in the extension position, and the suspension group used suspension external fixator to restrict the movement of the left knee joint in the extension position. After 6 weeks, the joint external fixation was removed. The condition of skin soft tissue and the left knee joint were observed. The health status of skin soft tissue was evaluated by the Bates-Jensen wound assessment tool(BWAT). The function of left knee joint was evaluated by Lequesne MG score. Then killed the rabbits by air embolization. The cartilage of the left knee joint was observed by gross observation and pathological observation by HE staining. The Pelletier score and Mankin score were usd to evaluate the cartilage injury. Results (1) Comparison of skin and soft tissue health, compared with the normal group and the suspension group, BWAT score in the Videman group was increased (P<0.05); there was no statistically significant difference in BWAT scores between the suspension group and the normal group (P>0.05). (2) Comparison of left knee joint function, Lequesne MG score in the Videman group and the suspension group was significantly higher than that in the normal group (P<0.01); there was no statistically significant difference in Lequesne MG score between the Videman group and the suspension group (P>0.05). (3) Gross observation and HE staining observation of left knee articular cartilage in the normal group were all normal, the Videman group and the suspension group all showed typical pathological changes of knee osteoarthritis. Compared with the normal group, Pelletier and Mankin scores in the Videman group and the suspension group were significantly increased (P<0.01), reaching the scoring level of mild to moderate osteoarthritis; there were no statistically significant difference in Pelletier score and Mankin score between the Videman group and the suspension group (P>0.05). Conclusion The rabbit model of knee osteoarthritis with healthy skin and soft tissue can be successfully established by the method of hanging external fixator with limited immobilization the knee joint to extension position, its modeling effect is consistent with that of traditional Videman modeling method,but the protection ability to the skin soft tissue is stronger than the latter.
〔Keywords〕 knee osteoarthritis; hanging; limited immobilization; animal model; rabbit
骨關节炎是一种多因素综合所致的关节退化性疾病,可影响体内多关节,其中膝关节为高发病关节[1],据估计,在60岁以上的成年人中,膝骨关节炎的男性发病率约为10%,女性发病率约为13%,是老年人口致残的主要原因之一[2]。膝骨关节炎目前无特效治疗药物,其确切致病机制仍然未知[3-4],研究[5]发现炎症因子与膝骨关节炎的发生发展关系密切。因此,制备合理的动物模型是相关研究深入开展的重要基础。膝骨关节炎造模方法多样,其中传统Videman造模法[6]是经典的诱导性体外关节制动动物膝骨关节炎造模法,该方法不受手术创伤和关节内操作的影响,可较好地模拟人类膝骨关节炎的发生、发展模式[7],适用于药物对膝骨关节炎动物模型炎症递质表达影响的研究[8]。既往研究[9-12]表明传统Videman造模法通过体外关节的完全制动可成功制备膝骨关节炎动物模型,但实践过程中发现其加压固定的造模方式易致模型动物造模侧下肢产生缺血性肿胀等皮肤软组织损伤,而其产生的炎症成为传统Videman造模法诱导的膝骨关节炎模型的主要干扰因素[13-15]。因此,运用不依赖加压固定的体外关节制动造模方式制备皮肤软组织健康的动物膝骨关节炎模型十分必要。本研究对传统Videman造模法加以改进,用悬吊式外固定支具有限制动膝关节于伸直位的造模方式建立皮肤软组织健康的动物膝骨关节炎模型。
1 材料与方法
1.1 实验动物及分组
选择6月龄雄性新西兰大白兔18只,体质量(2 750±250) g;由湖南太平洋生物科技有限公司提供,动物生产许可证号:SCXK(湘)2020-0005;饲养于湖南中医药大学动物实验中心,实验单位许可证号:SYXK(湘)2019-0009。适应性喂养1周,观察无异常后按随机数字表随机分为正常组、传统Videman法造模组(简称Videman组)、悬吊固定法造模组(简称悬吊组),每组6只。本实验经湖南中医药大学动物实验中心伦理委员会批准(伦理审查备案号:202007070001)。
1.2 主要实验材料
高分子绷带(广东省揭西县泰洲医疗科技有限公司,201600163);弹性绷带(浙江安吉县精诚医用绷带厂,20150001);高分子绷带(广东省揭西县泰洲医疗科技有限公司,201600163);弹性绷带(浙江安吉县精诚医用绷带厂,20150001);医用高分子石膏(上海优加医疗用品有限公司,20200403);透明胶带(上海晨光文具股份有限公司,AJD97338);细铁丝网(江苏元井汇有限公司,52775616729);0.5 mm铁丝;剪刀;尖嘴钳。
1.3 主要实验试剂
4%多聚甲醛(北京兰杰柯科技有限公司,批号BL600A);10% EDTA脱钙液(北京索莱宝生物科技有限公司,批号20200616);苏木素伊红染液套装(武汉谷歌生物科技有限公司,批号G1005);无水乙醇(批号100092683)、二甲苯(批号100023418)、盐酸(批号10011008)、氨水(批号10002118)、中性树胶(批号10004160)均购自国药集团化学试剂有限公司。
1.4 主要实验器械
脱水机(武汉俊杰电子有限公司,JJ-12J);包埋机(武汉俊杰电子有限公司,JB-P5);病理切片机(上海徕卡仪器有限公司,RM2016);冻台(武汉俊杰电子有限公司,JB-L5);组织摊片机(浙江省金华市科迪仪器设备有限公司,KD-P);烤箱(天津市莱玻瑞仪器设备有限公司,GFL-230);载玻片及盖玻片(江苏世泰实验器材有限公司,10127105P-G);正置光学显微镜(日本尼康公司,Nikon Eclipse E100);成像系统(日本尼康公司,Nikon DS-U3)。
1.5 动物模型的制备
正常组:不做任何处理。
Videman组:单纯采用管型高分子石膏完全制动兔左膝关节于伸直位[6]。
悬吊组:将新西兰大白兔左膝关节短暂固定于伸直位,用皮尺测量内踝关节上1.0 cm至大腿内侧根部下0.5 cm的直线距离(一号数据),测量大腿内侧根部水平的大腿周长(二号数据),测量内踝关节上1.0 cm处的小腿周长(三号数据),随即解除固定;将高分子绷带塑形成管型,其纵轴长度为一号数据长度,上端内周长为二号数据长度加0.5 cm,下端内周长为三号数据长度加3.0~4.0 cm;修剪管型高分子绷带上下缘毛糙部分,并包绕数层透明胶带使之光滑、圆钝;将细铁丝网紧密覆盖管型高分子绷带外表面,并用多层透明胶带缠绕固定;制作直径约为8.0 mm的细铁丝环,使之固定于管型高分子绷带上缘,取宽5.0 cm,长30.0 cm的弹性绷带,将其穿过细铁丝环;再次临时固定模型兔左下肢于伸直位,将管型高分子绷带自下而上套入模型兔左下肢,在模型兔大腿根部稍前方用弹性绷带环绕躯干打结,调整弹性绷带环的松紧度使管型高分子绷带下缘位于踝关节上1.0 cm,上缘位于大腿内侧根部下0.5 cm,使其左膝关节有限制动于伸直位。见图1。
Videman组和悬吊组兔造模支具安装完成后观察30 min,如出现肢体远端血运不良或躯干处弹性绷带捆绑过紧应立刻拆除固定,等血运恢复后重新操作;6周造模期内如发现有造模支具固定失效,立刻予以重新固定。
1.6 标本取材及处理
造模6周后用空气栓塞法处死实验兔,解剖暴露兔左膝关节,切取股骨头全层关节软骨,以4%多聚甲醛液固定48 h后,放入10% EDTA脱钙液中脱钙处理,脱钙完成后石蜡包埋,纵行切片,每个标本切3张,间隔100 μm切片,切片厚度为5 μm,将组织切片置于60 ℃恒温箱中烘烤1 h。依次将切片放入二甲苯Ⅰ20 min、二甲苯Ⅱ20 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、75%乙醇5 min,自来水洗,苏木素染色3~5 min,盐酸水溶液分化,氨水水溶液返蓝,水洗,依次将切片放入85%、95%的梯度乙醇脱水,于伊红染液中染色5 min;依次将切片放入无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、无水乙醇Ⅲ5 min、二甲苯Ⅰ5 min、二甲苯Ⅱ5 min透明化处理,中性树胶封片。最后进行显微镜镜检及图像采集分析。
1.7 指标观察与检测
1.7.1 一般观察 每日检查并维护造模支具防止其固定失效;造模6周时取下造模支具,观察兔外观形态并拍取照片;观察统计3组兔的存活率。
1.7.2 皮肤软组织Bates-Jensen伤口评估工具(the
Bates-Jensen wound assessment tool, BWAT)评分 造模6周时用BWAT[16-17]对实验兔皮肤软组织的健康情况进行评估,BWAT评分包含13个项目。BWAT对9个特征(坏死组织类型、坏死组织数量、肉芽组织、上皮化程度、渗液类型、渗液数量、周围皮肤颜色、水肿、硬结)进行主观评估,评分等级为1~5分,其中1分表示该特征健康,5分表示该特性最不健康;其余4个特征(大小、深度、边缘、破坏程度)的等级为0~5分,0分表示“不存在”。总得分范围为9~65分,皮肤软组织受压病变程度和总分数呈正相关性。
1.7.3 膝关节Lequesne MG评分 造模6周时采用 Lequesne MG[18]评分评估实验兔左膝关节功能,包括疼痛刺激反应(0~3分)、步态改变(0~3分)、关节活动(0~3分)、关节肿胀(0~2分),总得分范围为0~11分,膝关节功能障碍程度和总分数呈正相关性。
1.7.4 左膝关节软骨大体观察及Pelletier评分 造模6周时对解剖完成的兔左膝关节标本行肉眼下观察并拍取左股骨髁关节面照片。采用Pelletier评分[19]评估软骨损伤情况:(1)0分:关节面光整,色泽如常;(2)1分:关节面粗糙,有小的裂隙且色泽灰暗;(3)2分:关节面糜烂,软骨缺损深达软骨表、中层;(4)3分:关节面溃疡形成,缺损深达软骨深层;(5)4分:软骨剥脱,软骨下骨暴露。软骨损伤程度和分数呈正相关性。
1.7.5 左膝关节软骨HE染色观察 在200倍光学显微镜下观察造模6周时实验兔左膝关节软骨HE染色标本,每张切片选择3个视野。
1.7.6 左膝关节软骨Mankin评分 参照Mankin评分[20]进行分数统计,满分14分,软骨退变程度和分数呈正相关性。分级标准:正常(0~2分),轻度退变(3~7分),中度退变(8~11分),重度退变(12~14分)。
1.8 统计学方法
采用SPSS 20.0统计软件对所有数据进行统计分析。计量资料以“x±s”表示,若满足正态分布和方差齐性检验,组间比较采用单因素方差分析,进一步采用LSD法进行两两比较;若不满足正态性和方差齐性,采用非参数检验,如Kruskal-Wallis法;P<0.05为差异有统计学意义。
2 结果
2.1 一般观察
(1)6周造模期内,Videman组有3只兔予以重新固定,原因为造模中后期兔左下肢肌肉萎缩致加压固定的管型高分子石膏滑脱及管型高分子石膏被啃咬破坏致固定失效。悬吊组有1只兔予以重新固定,原因为管型高分子绷带边缘与弹性绷带连接处被啃咬破坏致模具脱落。
(2)造模6周时拆除造模支具,正常组兔左下肢毛发松软,左膝关节屈伸自如;Videman组兔左下肢毛发稀疏凌乱,左膝关节完全僵直;悬吊组兔左下肢毛发松软,左膝关节完全僵直。
(3)实验第6周末正常组、Videman组、悬吊组兔存活率均为100%。
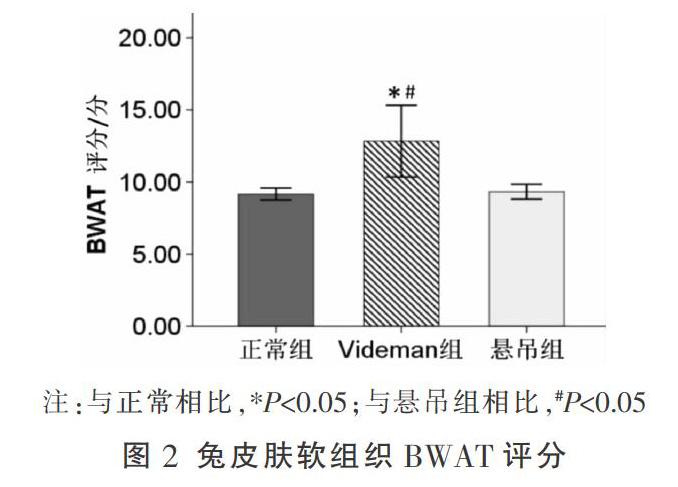
2.2 皮肤软组织BWAT评分
BWAT评分结果显示,正常组为(9.166±0.408)分,Videman组为(12.833±2.483)分,悬吊组为(9.333±0.516)分。与正常组和悬吊组相比,Videman组BWAT评分较高(P<0.05);悬吊组与正常组BWAT评分比较,差异无统计学意义(P>0.05)。见图2。
2.3 膝关节Lequesne MG评分
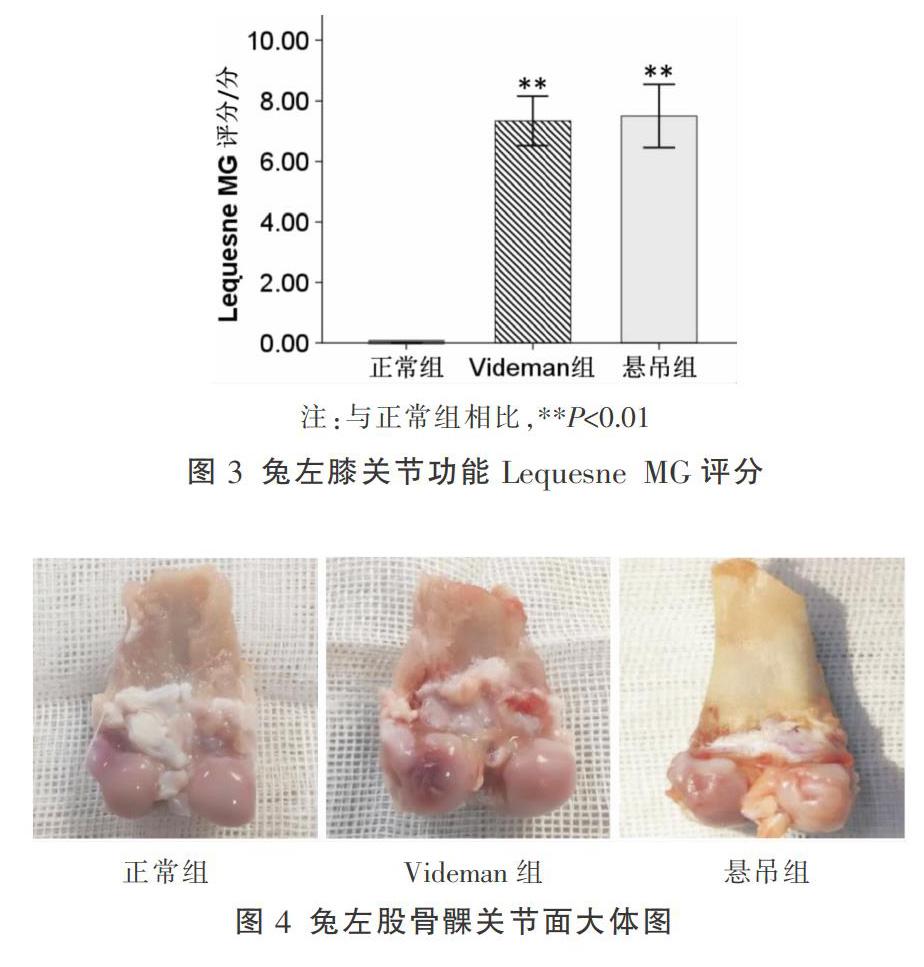
Lequesne MG評分结果显示,正常组为(0.000±0.000)分,Videman组为(7.333±0.816)分,悬吊组为(7.500±1.048)分。与正常组相比,Videman组和悬吊组 Lequesne MG评分均显著升高(P<0.01);Videman组与悬吊组 Lequesne MG评分比较,差异无统计学意义(P>0.05)。见图3。
2.4 左膝关节软骨大体观察及Pelletier评分
造模6周时Videman组和悬吊组兔左膝股骨内侧或外侧髁关节面软骨变薄,色泽灰暗,表面向下凹陷形成溃疡。正常组兔左膝股骨内侧及外侧髁关节面光整,软骨色泽正常。见图4。
Pelletier评分结果显示,正常组为(0.000±0.000)分,Videman组为(2.500±0.547)分,悬吊组为(2.666±0.516)分。与正常组相比,Videman组与悬吊组Pelletier评分均显著升高(P<0.01);Videman组与悬吊组Pelletier评分比较,差异无统计学意义(P>0.05)。见图5。
2.5 左膝关节软骨标本HE染色观察及Mankin评分
造模6周时的Videman组和悬吊组兔左膝关节软骨HE染色标本可见浅表区不平整,存在破裂或缺失,表层软骨细胞减少,软骨基质及胶原纤维增生,深层软骨细胞数目异常,表现为细胞簇聚或数目减少,为典型的骨关节炎病理学改变。正常组兔左膝软骨HE染色标本组织观察情况正常。见图6。
Mankin评分结果显示,正常组为(0.666±0.516)分,Videman组为(8.000±1.095)分,悬吊组为(8.166±1.471)分。与正常组相比,Videman组与悬吊组Mankin评分均显著升高(P<0.01);Videman组与悬吊组Mankin评分比较,差异无统计学意义(P>0.05)。见图7。
3 讨论
3.1 实验动物选择
兔是骨关节炎造模的常用动物之一[21],最近研究[22]结果表明雌激素可能对膝骨关节炎的发展具有保护作用,为排除雌激素对本实验的干扰,故选用雄性兔作为实验对象。由于幼年兔软骨的自发愈合特性较强[23],本实验选择6月龄的兔以保证骨骼的成熟[24]。
3.2 改进造模原因
体外关节制动动物膝骨关节炎造模法如传统Videman造模法[25]用管型固定物把实验动物膝关节固定于伸直位,经过5~6周的完全性体外关节制动,膝关节软骨的会发生与骨关节炎临床病理改变相似的关节退变[26]。但实践中发现传统Videman法加压固定的造模方式因管型固定物需与兔造模侧下肢紧密接触,易致兔皮肤软组织产生压迫性损伤,导致其会阴感染[11]、下肢缺血性肿胀[10,27]、压疮[9,12]等,甚至由压疮引发全身炎症反应综合征[28]。在膝骨关节炎发病过程中,关节组织会产生并释放如白细胞介素1、白细胞介素6、肿瘤坏死因子等炎性因子,进行膝骨关节炎发病机制的研究需要测定相关炎性因子在血浆含量[29-30],而模型动物皮肤软组织损伤时也会导致血浆中白细胞介素1、白细胞介素6和肿瘤坏死因子等炎性因子的含量异常[31-32],故当膝骨关节炎模型动物有皮肤软组织损伤时,其血浆中与膝骨关节炎发病机制相关的炎性因子检测结果将出现误差。由于传统Videman造模法加压固定的造模方式有以上不足,因此,本研究对其加以改进,探索以不依赖加压固定的体外关节制动造模方式制备皮肤软组织健康的膝骨关节炎动物模型。
3.3 改进优势分析
(1)不同于传统Videman造模法加压固定和完全制动的造模方式,本造模法的固定方式为悬吊固定,依靠绑扎在模型兔躯干的弹性绷带将周径稍大于兔下肢的管型固定物悬吊在其下肢上,制动方式为有限制动,通过管型固定物限制兔膝关节的屈伸范围在0°~10°。悬吊固定使整个外固定支具重量由兔四肢分担,不会出现造模侧下肢负重过大影响髋部活动的现象。有限制动的情况下,管型固定物不会对动物模型造模侧下肢形成环形加压,能有效防止压迫性皮肤软组织损伤出现。(2)传统Videman造模法固定支具的制作方式是在体制作,而本造模法为离体制作,固定支具离体制作完成后统一安装可大幅度缩短不同动物个体之间的造模时间差。(3)据统计,传统Videman造模法外固定支具的安装、拆卸耗时较长[11],特别是拆卸,常耗时数十分钟。本造模法安装调试过程可控制在5 min内,拆卸时剪断悬吊带,向下取出管型固定物,数秒钟便能完成;其快速安装、拆卸的特点使得在大批量造模时能更频繁地检查固定支具覆盖范围内皮肤软组织的健康情况,及时预防或消除造模导致的不必要损伤。(4)对比传统Videman造模法,本造模法拆卸外固支具时不破坏其管型固定物的完整性,能避免划伤模型兔皮肤,且整个造模过程可单人操作,无需麻醉。(5)本造模法兔造模侧下肢与管型固定物间有较大间隙,空气可通过间隙进行流通,其透气性能优于传统Videman造模法。
综上所述,通过悬吊式外固定支具有限制动膝关节于伸直位的造模方式可成功制备皮肤软组织健康的兔膝骨关节炎模型,其造模效果与传统Videman造模法一致,但对皮肤软组织的保护能力强于后者,可能更适用于药物对膝骨关节炎动物模型炎症递质表达影响的研究。
参考文献
[1] MABEY T, HONSAWEK S. Cytokines as biochemical markers for knee osteoarthritis[J]. World Journal of Orthopedics, 2015, 6(1): 95-105.
[2] PRIMORAC D, MOLNAR V, ROD E, et al. Knee osteoarthritis: A review of pathogenesis and state-of-the-art non-operative therapeutic considerations[J]. Genes, 2020, 11(8): E854.
[3] GEYER M, SCH NFELD C. Novel insights into the pathogenesis of osteoarthritis[J]. Current Rheumatology Reviews, 2018, 14(2): 98-107.
[4] SAMVELYAN H J, HUGHES D, STEVENS C, et al. Models of osteoarthritis: Relevance and new insights[J]. Calcified Tissue International, 2020: 1-14.
[5] 汪國翔,章晓云.骨关节炎病变过程中炎症细胞因子及相关信号通路的作用机制[J].中国组织工程研究,2021,25(14):2266-2273.
[6] VIDEMAN T. Experimental osteoarthritis in the rabbit: Comparison of different periods of repeated immobilization[J]. Acta Orthopaedica Scandinavica, 1982, 53(3): 339-347.
[7] 孙银铁,郭开今,蔡红星.NOD2、NLRP3在石膏关节制动法建立兔膝骨性关节炎模型关节软骨中的表达[J].中国组织工程研究,2018,22(8):1211-1216.
[8] 沈景寿,张 晶,胡毓诗,等.膝关节骨关节炎诱导性动物模型研究进展[J].中国运动医学杂志,2019,38(8):726-730.
[9] 陳 达,彭力平,廖州伟,等.木瓜蛋白酶与石膏制动建立兔膝骨关节炎模型的比较[J].广东医学,2017,38(14):2114-2118.
[10] 吴 强,郑倩华,蒋一璐,等.膝骨性关节炎动物模型选择与制备的比较[J].中国比较医学杂志,2019,29(5):125-130.
[11] 刘 晶,林巧璇,卢莉铭,等.改良Videman法复制兔膝骨关节炎的实验研究[J].康复学报,2020,30(3):212-219.
[12] 田育魁,郝 洋,刘俊昌,等.高分子绷带结合塑料杆建立的兔膝骨关节炎模型[J].中国组织工程研究,2020,24(23):3690-3695.
[13] ZHANG Y, JORDAN J M. Epidemiology of osteoarthritis[J]. Clinics in Geriatric Medicine, 2010, 26(3): 355-369.
[14] HE Y C, LI Z, ALEXANDER P G, et al. Pathogenesis of osteoarthritis: Risk factors, regulatory pathways in chondrocytes, and experimental models[J]. Biology, 2020, 9(8): 194.
[15] SCHRAM B, ORR R, POPE R, et al. Risk factors for development of lower limb osteoarthritis in physically demanding occupations: A narrative umbrella review[J]. Journal of Occupational Health, 2020, 62(1): 1-13.
[16] HARRIS C, BATES-JENSEN B, PARSLOW N, et al. Bates-Jensen wound assessment tool[J]. Journal of Wound, Ostomy and Continence Nursing, 2010, 37(3): 253-259.
[17] BATES-JENSEN B M, MCCREATH H E, HARPUTLU D, et al. Reliability of the Bates-Jensen wound assessment tool for pressure injury assessment: The pressure ulcer detection study[J]. Wound Repair and Regeneration, 2019, 27(4): 386-395.
[18] LEQUESNE MG, MERY C, SAMSON M, et al. Indexes of severity for osteoarthritis of the hip and knee. Validation--value in comparison with other assessment tests[J]. Scandinavian Journal of Rheumatology, 1987,16(s65):85-89.
[19] PELLETIER J P, JOVANOVIC D, FERNANDES J C, et al. Reduced progression of experimental osteoarthritis in vivo by selective inhibition of inducible nitric oxide synthase[J]. Arthritis and Rheumatism, 1998, 41(7): 1275-1286.
[20] MANKIN H J, LIPPIELLO L. Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips[J]. The Journal of Bone & Joint Surgery, 1970, 52(3): 424-434.
[21] 李 军,彭 峥,刘兆丰,等.膝骨关节炎动物模型研究进展[J].西部医学,2019,31(12):1962-1965,1981.
[22] GANOVA P, ZHIVKOVA R, KOLAROV A, et al. Influence of estradiol treatment on bone marrow cell differentiation in collagenase-induced arthritis[J]. Inflammation Research, 2020, 69(5): 533-543.
[23] MCCOY A M. Animal models of osteoarthritis: Comparisons and key considerations[J]. Veterinary Pathology, 2015, 52(5): 803-818.
[24] VAN DER KRAAN P M. Factors that influence outcome in experimental osteoarthritis[J]. Osteoarthritis and Cartilage, 2017, 25(3): 369-375.
[25] 張 洪,江捍平,王大平.关节制动制作骨性关节炎动物模型的探讨[J].中国现代医学杂志,2006,16(12):1843-1844,1848.
[26] 詹楚宁,付拴虎,程 俊,等.骨关节炎实验动物模型研究进展[J]. 大众科技,2013,15(12):121-123,112.
[27] 张 劲,赵 亮,胡春生.新型外固定支具建立兔膝骨性关节炎模型的研究[J].湖北中医药大学学报,2015,17(4): 8-9.
[28] JAIRAM A, SONG P, PATEL N B, et al. Pressure sores and systemic inflammatory response syndrome: UC Davis quality improvement initiative[J]. Annals of Plastic Surgery, 2018, 80(5S Suppl 5): S308-S310.
[29] BARRETO G, MANNINEN M, K EKLUND K. Osteoarthritis and toll-like receptors: When innate immunity meets chondrocyte apoptosis[J]. Biology, 2020, 9(4): E65.
[30] GROMA V, TARASOVS M, SKUJA S, et al. Inflammatory cytokine-producing cells and inflammation markers in the synovium of osteoarthritis patients evidenced in human herpesvirus 7 infection[J]. International Journal of Molecular Sciences, 2020, 21(17): E6004.
[31] DINARELLO C A. Historical insights into cytokines[J]. European Journal of Immunology, 2007, 37(Suppl 1): S34-S45.
[32] CHEN G Y, NU EZ G. Sterile inflammation: Sensing and reacting to damage[J]. Nature Reviews Immunology, 2010, 10(12): 826-837.
