1株人感染柯萨奇病毒A组16型B1b亚型的分离和鉴定*
2021-05-26杜加亮于晴川赵荣荣刘悦越
杜加亮,刘 艳,于晴川,张 永,赵荣荣,赵 岩,韩 菲,刘悦越
中国食品药品检定研究院,北京 102629
柯萨奇病毒A16(CV-A16)是小RNA病毒科肠道病毒属的成员,是引起婴幼儿手足口病(HFMD)的常见病原体之一[1]。CV-A16是含有约7.4 kb基因组的正义单链RNA病毒,其基因组包含5′端非翻译区(5′UTR)、结构蛋白编码区P1、非结构蛋白编码区P2/P3及3′非翻译区(3′UTR)。P1编码4种结构蛋白(VP1、VP2、VP3、VP4),P2和P3分别编码7种非结构蛋白(2A、2B、2C、3A、3B、3C、3D)[2]。随着研究的不断深入,在分子流行病学方面,基于VP1基因的完整序列,CV-A16可以在系统发育上分为A、B、C和D 4个基因组[3-6]。基因组B可以进一步分为B1~B4这4个基因亚型,其中B1基因亚型还可以细分为B1a~B1d[3,7]。在基础研究方面,利用反向遗传学技术构建感染性克隆[8],能够在体外对病毒基因组进行突变、缺失、嵌合等操作后,获得表型、性状发生变化的拯救病毒,为研究其基因的结构与功能、病毒复制机制、致病机制及筛选候选疫苗提供了崭新的途径。在疾病预防控制方面,单价肠道病毒71 型(EV-A71)疫苗无法预防其他病原体引起的HFMD及其他相关疾病,应研发多价HFMD 疫苗[9],而EV-A71和CV-A16交替或共同流行可引发世界多个国家或地区HFMD暴发。本研究从CV-A16的分离、鉴定、系统进化分析、检测方法建立和全基因组克隆构建等方面进行了一系列研究,以期为CV-A16 病毒的分子流行病学和基础研究提供有利的工具。
1 材料与方法
1.1细胞 RD细胞为人恶性胚胎横纹肌瘤细胞,为本实验室保存。细胞培养液为含有1%(v/v)L-谷氨酰胺(200 mmol/L)、2.5%(v/v)NaHCO3溶液(7.5%)、10%(v/v)胎牛血清和1%(v/v)双抗的Gibco D-MEM培养液。
1.2材料 一步法荧光定量PCR试剂盒(RR064)和一步法反转录PCR(RT-PCR)试剂(RR057)购自TaKaRa公司,QIAamp Viral RNA Mini 试剂盒购自QIAGEN公司。粪便处理液为含有终浓度为500 U/mL青霉素和500 μg/mL链霉素的磷酸盐缓冲液(PBS)。
1.3病毒分离 粪便标本来源于临床诊断为HFMD和实验室诊断为CV-A16感染的患者。取粪便标本1 g加入10 mL粪便处理液中,涡旋混匀30 s,4 000 r/min离心30 min,取上清,除菌过滤后接种于RD细胞。在倒置显微镜下每日观察细胞病变情况,7 d后观察若未出现细胞病变,盲传两代,直至出现超过75%的细胞病变后,将其在—70 ℃以下冻存。
1.4分离毒株的分子生物学鉴定 步骤1.3中的冻存液反复冻融3次后,吸取200 μL,按照QIAamp Viral RNA Mini 试剂盒说明书的步骤提取病毒RNA。按照一步法反转录PCR试剂(RR057)说明书,利用CV-A16特异性引物CA-VP1-F和CA-VP1-R(终浓度均为10 μmol/L),进行一步法反转录PCR扩增VP1基因(反应条件为94 ℃预变性5 min;94 ℃变性30 s、50 ℃退火30 s、72 ℃延伸1 min、35个循环;72 ℃充分延伸7 min),探针引物信息见表1。目的条带经1%琼脂糖凝胶电泳鉴定后测序验证,并参照文献与GenBank中的已知基因型和亚型的毒株序列进行比对,利用Mega软件构建Neighbour-joining系统进化树。
1.5病毒滴度检测 将长成致密单层的Vero细胞用0.25%胰蛋白酶消化,制成浓度为2×105/mL的细胞悬液备用;同时将待测病毒进行10倍系列稀释,取稀释度为10-10~10-3的病毒液按每孔50 μL接种细胞,每个稀释度设置8个复孔;然后立即将细胞悬液按每孔50 μL加入96孔板;同时设置细胞对照(100 μL细胞悬液+100 μL病毒稀释液),36 ℃培养7 d后观察细胞病变。以能使细胞发生病变的病毒最高稀释度作为终点。在显微镜下观察到细胞病变记为“+”,否则记为“-”。按Behrens-Krber公式计算出分离病毒株的病毒滴度(log CCID50)=L—d (S —0.5),其中:L=实验中使用的最低稀释度的log值;d=稀释梯度的log值;S=终判时阳性部分的总和(即出现CPE的细胞孔所占的比例之和)。
1.6分离毒株对乳鼠的致病性 将增殖后的病毒悬液反复冻融3次,然后在4 ℃、12 000 r/min条件下离心10 min,取上清液。实验用7 d龄Balb/c乳鼠由中国食品药品检定研究院实验动物资源研究所提供,同时设实验组和对照组,5只/组,实验组注射病毒液20 μL(100 CCID50),对照组注射等量培养液,颅内注射,逐日观察并记录乳鼠发病情况。
1.7全基因组克隆构建 参照步骤1.4中的方法提取病毒RNA,利用分片段引物(见表1),扩增全长基因。目的条带经1%琼脂糖凝胶电泳鉴定回收后,与pEASY-T3载体连接。转化DH5α大肠埃希菌感受态后,经过蓝白斑筛选、酶切鉴定和测序验证,提交GenBank。根据全长序列酶切位点分析,选择合适的酶切位点将全长序列分两段扩增克隆至pVAX载体,构建全基因组克隆,酶切鉴定和测序验证。
1.8检测方法建立
1.8.1RT-PCR方法建立 针对VP1设计引物探针,见表1,设计一步法RT-PCR。1×Taqman universal master mix Ⅱ 25 μL;CA-F(20 μmol/L)、CA-R(20 μmol/L)和CA-P(20 μmol/L)各5 μL,RNA 5 μL;反应条件:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s,55 ℃ 1 min;40个循环。
1.8.2质粒参考品制备 将VP1编码基因克隆入pEASY-T3载体作为质粒参考品。质粒纯度符合要求吸光度(A)260/280为1.8~2.0)后作为备用参考品原液。质粒拷贝数(copy/μL)按照以下公式计算:(6.02×1023)×(质粒浓度ng/μL×10-9)/(质粒长度bp×660)。本研究中使用稀释至106、105、104、103、102copy/μL的质粒作为参考品。
表1 探针引物信息
2 结 果
2.1人感染CV-A16分离株的生物学特征 成功地从HFMD患者的粪便标本中分离到1株CV-A16(BJ1208)。该病毒在RD细胞中培养时可以观察到明显的致细胞病变现象,见图1;在RD细胞增殖后的病毒滴度为6.8 log CCID 50/mL;以100 CCID50(20 μL)的病毒量在Balb/c乳鼠颅内注射后可以观察到典型的后肢瘫痪症状,见图2。

注:A为人感染CV-A16接种RD细胞;B为细胞对照。
上的细胞病变现象(×10)
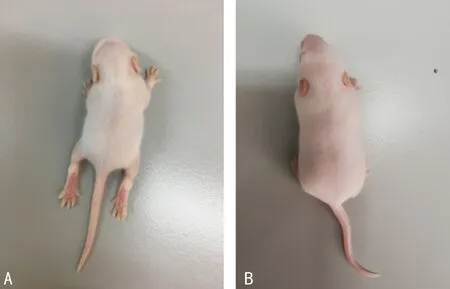
注:A为人感染CV-A16感染小鼠;B为正常小鼠对照。
肢瘫痪症状
2.2人感染CV-A16分离株的分子生物学特征 分段扩增(图3)测序后拼接获得该病毒的完整基因组序列(GenBank Accession No.:JX507808),全长7 406 bp,包括745 bp的5′UTR、6 579 bp的蛋白编码区(编码2 193个氨基酸)及82 bp的3′UTR。根据CV-A16 VP1序列构建的系统进化树显示,该病毒分离株为B1b亚型,且与俄罗斯2007年分离株(KC879501)具有最近的亲缘关系,见图4。但是与其他病毒相比,明显不同的是该分离株在VP1编码蛋白中(688~690 bp处)缺少一个蛋氨酸,见图5。但从其生物学特征来看,该缺失并不影响病毒复制和感染能力。
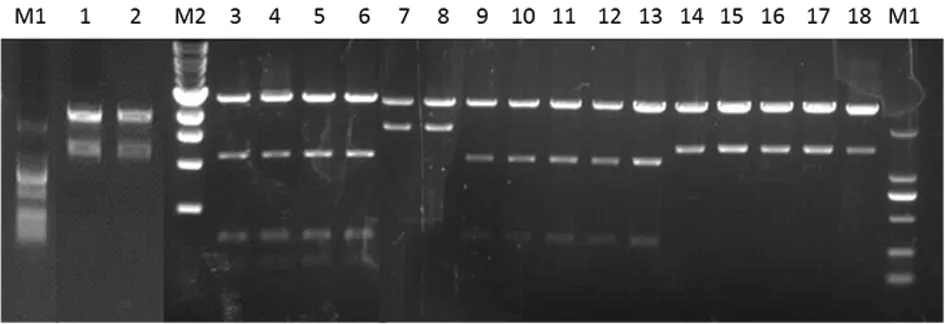
注:M1为DL2000 DNA 标记物;M2为1 kb ladder;泳道1-2、3-6、7-8、9-13、14-18分别是CV-A16 F1~F5 5个PCR扩增片段TA克隆的酶切鉴定结果。
克隆的酶切鉴定结果
2.3全基因组克隆构建 对全基因组进行酶切位点分析,利用一个单酶切位点(EcoR V)及基因组中未含有的两个酶切位点(Pme I 和Not I),将基因组分成两个片段依次扩增克隆和连接至载体pVAX1中,构建全基因组克隆pVAX1-CA16。经酶切(Pme I+ EcoR V)(约3.6和6.9 kb两个片段,见图6)和测序验证了基因组克隆后未发生基因突变。
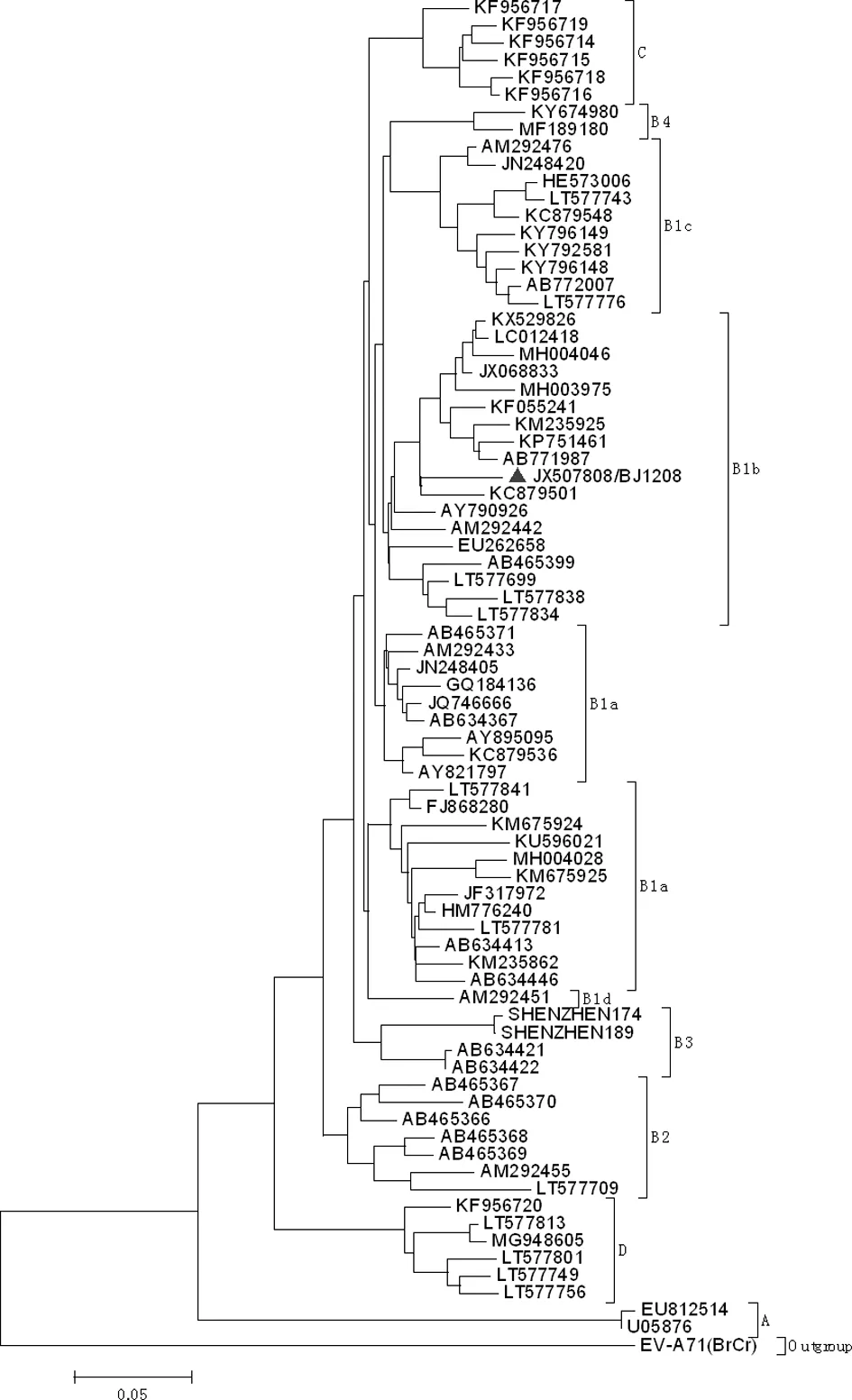
注:▲表示本研究中的病毒分离株BJ1208。
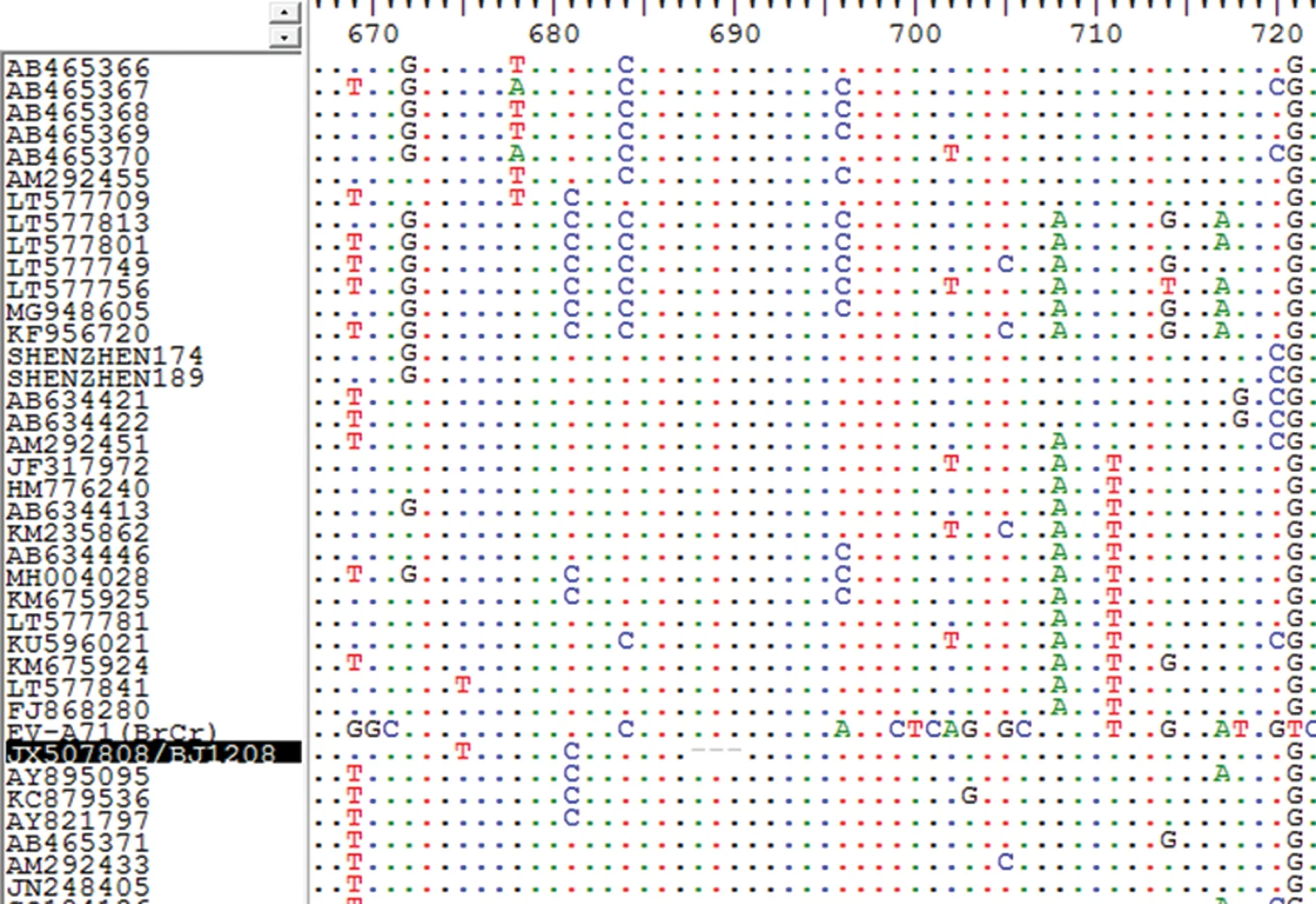
图5 CV-A16 BJ1208 VP1编码区核苷酸比较(部分)
2.4检测方法 由4次重复检测结果可见,质粒标准品的浓度对数与循环阈值(Ct值)在102~106copy/μL呈现明显的线性相关(Y=-1.602 ln(X)+36.873,R2=0.999 9),可用作该毒株的定性检测和病毒增殖滴度定量检测。

注:1为未酶切质粒对照;2为质粒经Pme I+EcoR V双酶切;M为DNA标记物。
3 讨 论
本研究成功从HFMD患者的粪便标本中分离到1株在体内(Balb/c乳鼠)和体外(RD细胞)均具有典型生物学特征的B1b亚型CV-A16(BJ1208)病毒。建立了一套从病毒分离、鉴定、系统进化分析、全基因组扩增和克隆到荧光定量检测方法建立的技术平台,为该类病毒的后续研究提供了参考。
虽然CV-A6、CV-A10等病原体在亚洲、美洲和欧洲逐渐取代EV-A71和CV-A16成为引起HFMD暴发或流行的主要病原体,但是传统的病原体仍然不能被忽视[10]。CV-A16感染可导致多种疾病,从轻度HFMD、疱疹性咽峡炎、上下呼吸道疾病到严重并发症,如脑炎、瘫痪、脊髓炎、脑膜炎,甚至死亡。CV-A16的基因型和基因亚型众多,但是型别与疾病严重程度之间的关系尚不十分明确。CV-A16病毒B1b亚型在我国多个省份均有报道[11],并且田晓灵等[12]发现内蒙古自治区不同临床症状患者中分离出的CV-A16代表株在分子基因型/基因亚型及亲缘进化关系树分布上虽无明显差异,但大部分的重症病例和死亡病例感染病毒都分布在B1b分支中。本研究中分离到的B1b亚型CV-A16(BJ1208)病毒来源于重症患者的粪便标本,这提示在疾病监测过程中应重视收集基因型/亚型与疾病严重程度的关系数据,为疾病的治疗及疫苗毒株的选择提供依据。
通常认为,CV-A16 的VP1编码区氨基酸序列相对于其他肠道病毒较为保守,且与其抗原性密切相关[13]。因此,这一区域发生的氨基酸特性改变可能对蛋白质空间结构有一定的影响,从而导致毒力的改变[14-17]。本研究中的分离株BJ1208虽然在VP1编码蛋白中(688~690 bp处)缺少一个蛋氨酸。但从其生物学特征和临床来看,该缺失并不影响病毒复制和感染能力。得益于反向遗传操作技术的成功应用,可以从基因型的改变来研究表型的变化。以往研究多是利用T7聚合酶系统以线性化的重组质粒为模板进行体外转录反应得到CA16病毒基因组RNA,并将CAl6基因组RNA转染至适宜细胞获得拯救病毒。而以CMV为启动子实现病毒拯救的策略可以利用哺乳动物细胞内天然的Ⅱ类RNA聚合酶来实现转录,在操作上更为简捷[18],可以用于研究基因突变、缺失或插入等改变对病毒性状的影响。
pVAXl是在载体pcDNA3.1的基础上改建而成的一种新型真核表达载体,是美国食品药品监督管理局(FDA)批准的唯一一个可以用于DNA疫苗的载体。该质粒含有的强启动子pCMV和BGH poly A信号可以在哺乳动物细胞中高水平表达重组蛋白[19]。与经典的T7启动子相比,少了体外转录的步骤。本研究利用pVAXl作为载体构建了全基因组克隆,下一步工作是在此基础上对全基因组克隆进行改造,如在5′和3′端增加核酶来提高剪切精确度等[20],实现病毒拯救,以期为病毒基因型和表型关系的研究提供更便捷的工具。
本研究建立了一个基于CV-A16病毒的分离鉴定体系,以期为复杂多样的HFMD病原体的相关研究提供更多的参考。
