外源CaCl2调控浒苔(Ulva prolifera)高温逆境的比较转录组研究*
2021-05-26唐晓雯范美华王超峰徐年军王健鑫
唐晓雯 范美华① 王超峰 廖 智 李 鹏 徐年军 王健鑫①
外源CaCl2调控浒苔()高温逆境的比较转录组研究*
唐晓雯1范美华1①王超峰1廖 智1李 鹏1徐年军2, 3, 4, 5王健鑫1①
(1. 浙江海洋大学海洋科学与技术学院 舟山 316022; 2. 宁波大学 海洋生物技术与工程国家地方联合工程实验室 宁波 315832; 3. 应用海洋生物技术教育部重点实验室 宁波 315832; 4. 浙江海洋高效健康养殖省部共建协同创新中心 宁波 315832; 5. 浙江省海洋生物工程重点实验室 宁波 315832)
钙(Ca2+)作为一种必需的信号分子, 在植物的生长发育和非生物胁迫调节中起着至关重要的作用。本实验采用BGISEQ平台进行高通量测序, 获得浒苔外源CaCl2添加(UpCa)和高温对照(UpHT)处理下相关的转录组数据, 分析了在高温(35 °C)下外源CaCl2的添加转录组的变化。结果显示, 根据UpHT和UpCa处理分析共获得36625条基因; 与UpHT相比, 在UpCa下鉴定出7513个差异表达的基因, 包括6002个上调基因, 1151个下调基因, 对差异基因进行了GO富集和KEGG富集分析。对膜转运、植物信号转导和环境适应性相关的差异基因进行KEGG富集分析, 主要富集在内吞(Endocytosis)、植物病原菌互作(Plant-pathogen interaction)、丝裂原激活的蛋白激酶信号通路(MAPK signaling pathway-plant)、植物激素的信号传递(Plant hormone signal transduction)、ABC转运(ABC transporters)和磷脂酰肌醇信号系统(Phosphatidylinositol signaling system)等代谢通路上。植物激素信号转导途径中, 细胞分裂素、脱落酸、油菜素内酯和乙烯信号转导途径增强。抗氧化酶中FeSOD、谷胱甘肽过氧化物酶、谷胱甘肽S转移酶和抗坏血酸过氧化物酶等基因表达上调, 下调的基因主要是热激蛋白。Ca2+信号组分基因钙结合蛋白、钙调素、钙/钙调素依赖的蛋白激酶以及钙/钙调蛋白依赖性3′,5′环核苷酸磷酸二酯酶的基因表达上调, 丝裂原活化蛋白激酶激酶激酶和磷脂酰肌醇信号相关的基因也差异性上调。本研究系统阐述了植物信号转导、抗氧化酶、MAPK信号系统以及Ca2+信号组分基因在外源CaCl2对浒苔高温压力的调节中的重要作用, 可为进一步阐明Ca2+信号对高温的调节适应机制提供理论基础。
浒苔(); 外源氯化钙; 转录组; 高温
浒苔()是典型的大型绿藻, 属于石莼目(Ulvales)、石莼科(Ulvaceae)。浒苔繁殖速度快、环境适应性强, 是绿潮暴发的优势藻种, 在海洋生态平衡中发挥重要的作用。浒苔在生长过程中不可避免的受到高温、光照和盐度等环境变化的影响, 而温度是限制浒苔生长和繁殖的关键因素(Fan, 2018)。其中, 高温作为影响浒苔生长发育的关键因素, 越来越受到学者的高度关注。迄今为止, 已有学者相继报道了温度对浒苔生长发育或者分子机理的影响(李雪娜等, 2016; Fan, 2018)。
温度的升高影响着浒苔的生活史, 导致浒苔形态和生理指标发生变化, 影响孢子囊的形成、孢子释放和幼苗成长(Wang,2016; Chávez-Sánchez, 2017; Li, 2017; Rybak, 2018)。高温条件下, 大型海藻主要通过调节自身的生长发育过程来提高生存和繁殖能力, 特别是光合作用、基因的表达、蛋白质的合成和代谢都有适应性的改变, 而这些改变主要是通过植物信号响应系统来实现的。
钙离子(Ca2+)作为植物信号系统中普遍存在的第二信使, 在植物的生长发育和非生物刺激调节中发挥着重要的作用。Ca2+信号也是响应非生物刺激的关键信号。高温胁迫下, 大型海藻会诱导一系列抗氧化物酶, 蛋白激酶以及Ca2+依赖性相关蛋白的表达, 积累了多种糖和氨基酸代谢产物(Fan, 2018; He, 2018b)。高温胁迫下, 在转录组水平主要涉及光合和能量代谢率降低, 抗氧化活性物质的增加, Ca2+信号途径调节的热休克蛋白(Hsp70)、锰超氧化物歧化酶(Mn-SOD)和过氧化氢酶(CAT)等分子伴侣与自由基清除相关酶基因的表达也明显上调。另外, 筛选鉴定了参与Ca2+信号转导、藻类生长和植物激素生物合成的基因和蛋白(Im, 2015; Fan, 2017, 2018), 并且 Ca2+信号在应激反应中起到重要的调节作用。高温下, 外源Ca2+处理使小麦钙依赖蛋白激酶(calcium-dependent protein kinase, CDPK)、HSP、SOD和APX基因的表达差异性上调(Goswami, 2015)。Ca2+在扁浒苔()中对铜胁迫的调节可能是通过CaMs或者CDPKs来激活抗氧化基因的表达(González, 2012); 外源Ca2+处理在一定程度上可提高杜氏盐藻()对高渗胁迫和UV-B响应的调节作用(陈辉, 2011)。
综上所述, 高温影响了藻类的生长发育, Ca2+信号作为第二信使在高温调节中起到关键作用, 但是Ca2+信号对浒苔高温胁迫的调节机制还不清楚, 需要进一步研究。本实验以浒苔为材料, 采用转录组测序的方法, 阐述外源Ca2+添加对浒苔高温胁迫转录组响应调节机制, 不仅有助于了解Ca2+信号调节的通路, 而且对浒苔规模暴发的机制提供大量的基因数据。
1 材料与方法
1.1 实验材料
2019年6月份在青岛石老人海滩海面采集漂浮浒苔样品(120.481037°E, 36.100093°N)。采集后的浒苔先清洗掉其他杂质、0.2% KI处理5 min和灭过菌的海水进行洗涤。浒苔在加入100 µg/mL氨苄青霉素的Provasoli培养基中进行培养。培养条件为25 °C、12 h光照和12 h黑暗的光周期, 光照强度为40 μmol/(m2·s)。
1.2 实验方法
1.2.1 实验处理 2 g浒苔分别放在含有5 mmol/L CaCl2的400 mL Provasoli培养基中, 转移到35 °C高温的培养箱中进行培养(处理组, 标记为UpCa)。2 g浒苔在不含CaCl2的400 mL Provasoli培养基中在35 °C高温培养作为对照, 标记为UpHT。每个处理有3个生理性重复。在光照强度40 µmol/(m2·s)、光照周期12L:12D的光照培养箱培养3 h, 每个样品各取1 g, 液氮冷冻, –70 °C保存直至RNA提取, RNA提取后送样到武汉华大基因进行转录组测序。
1.2.2 RNA提取和cDNA文库的构建 利用十六烷基三甲基溴化铵-聚乙烯吡咯烷酮(CTAB-PVP)的方法根据说明书来提取浒苔的总RNA, 使用NanoDrop ND2000紫外分光光度计(Thermo)测定RNA的浓度和质量。利用Illumina TruSeq RNA Sample Prep Kit进行文库构建。文库的构建是带polyA的mRNA被含有OligodT的磁珠富集纯化。二价阳离子把富集的mRNA片段化, 将片段化的RNA合成cDNA (朱婷芳等, 2020)。在BGISEQ (MGI2000)平台按照标准程序进行测序。
1.2.3 数据处理 在BGISEQ平台获得原始序列(Raw data), 用fastq文件格式存储结果。利用SOAPnuke软件将原始序列过滤, 去除带接头(Adaptor)的reads、含有N(无法确定碱基信息)的比例>10%的reads和低质量reads(质量值≤15的碱基数占整个reads总碱基数的50%以上), 得到Clean data (朱婷芳等, 2020)。Clean reads通过HISAT和Bowtie2软件比对到参考基因序列, 进行基因注释。转录本的表达水平主要通过RSEM计算获得。
1.2.4 差异基因的鉴定和GO、KEGG富集分析 主要是根据UpHT(对照) vs UpCa(处理)即实验组与对照组的样品的Unigene表达量进行对比, 差异基因(Differentially Expressed Genes)的筛选主要是根据<0.05和|log2(UpCa FPKM/UpHT FPKM)|≥1作为筛选标准, 获得DEGs (Wang, 2010)。利用KEGG数据库和GO数据库对DEGs进行KEGG通路和GO富集分析(He, 2018a), 将值≤0.05的GO注释和KEGG注释归属为DEGs显著富集的GO和KEGG通路。值是用KOBAS(2.0)的BH方法得到的修正后的值(Hu, 2019)。
2 结果
2.1 转录组测序结果
本研究以UpCa和UpHT处理的浒苔总RNA为模板, 每个3个重复, 共构建了6个cDNA文库, 利用BGISEQ平台进行了转录组测序。UpHT对照组平均获得48.51 M的总Raw reads, 过滤后获得43.12 M Clean reads, 过滤后的碱基数是6.47 Gb, 过滤后的reads的比例是88.88% (表1)。UpCa实验处理组平均获得48.67 M的总Raw reads, 经过数据过滤获得43.25 M Clean reads。过滤后的碱基数是6.49 Gb, 过滤后的reads比例为88.86% (表1)。UpHT和UpCa处理比对到基因的Clean reads的比例分别为50.53%和45.64%。
表1 浒苔UpHT和UpCa处理转录组的测序结果
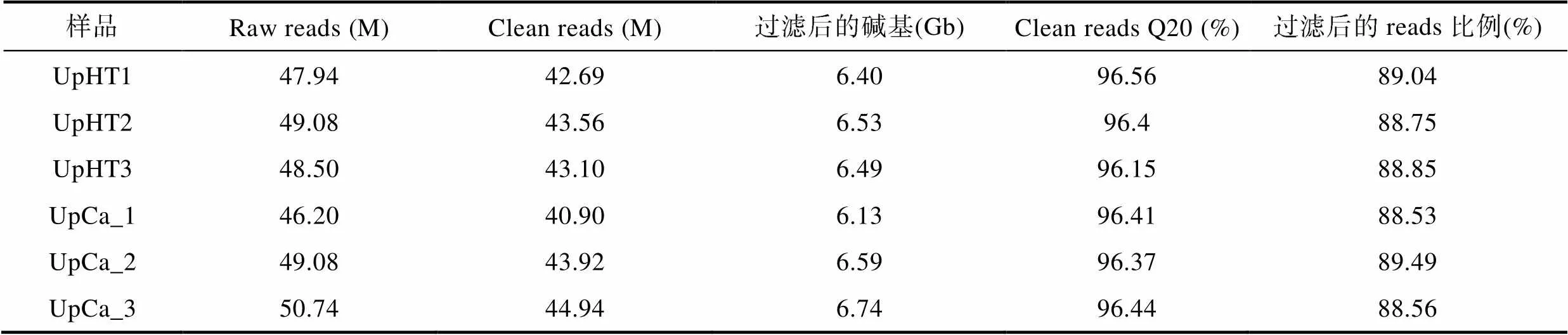
Tab.1 The result of transcriptome sequencing in U. prolifera under UpHT and UpCa treatments
注:20表示过滤后的reads中质量值大于20的碱基数(测序错误率<0.01)占总碱基数的比例,= –10 lg, M为million
2.2 基因的注释
UpHT主要注释到26545条基因, UpCa注释到35368条基因, 交叉的基因有25288条, 总共注释到36625条基因(图1)。
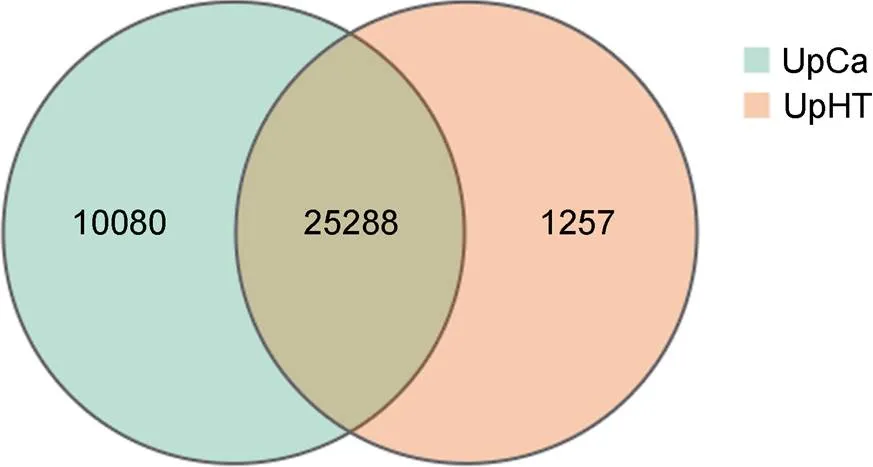
图1 UpCa处理组和UpHT对照组基因表达的韦恩图
2.3 差异基因的筛选和表达
参照其他相关的基因库, 在<0.05和|log2(FC)|≥1条件下, 获得7153个DEGs (图2)。其中上调的DEGs有6002个, 下调的DEGs有1151个(图2a)。
2.4 DEGs的GO分类和富集分析
对DEGs进行GO分类分析, 共有4335条DEGs基因被注释归属到GO的功能统计里面, 结果如图3所示。对于参与的生物过程(biological process)来说,GO注释最多的为细胞的过程(cellular process, 1691)、代谢的过程(metabolic process, 1446)、生物的调节(biological regulation, 447)、定位(localization, 360)、对刺激反应(response to stimulus, 328)、信号(signaling, 119)和发育过程(developmental process, 63)等。对于细胞的构成(cellular component)来说膜(membrane, 1731)、膜部分(membrane part, 1630)和细胞(cells, 1612)是GO基因注释最多的分类。对与分子功能(molecular function)来说, 注释的基因归类最丰富的为结合(binding, 2218)、催化的活性(catalytic activity, 2511)和转运活性(transporter activity, 286)等。另外, 有29个DEGs归属到抗氧化活性(antioxidant activity), 25个DEGs归属到信号转导活性(signal transducer activity)。
对DEGs进行GO富集分析, 结果如图4所示。在生物过程(biological process)的GO通路中DEGs主要富集到有机循环化合物代谢过程(organic cyclic compound metabolic process, GO: 1901360, 741)、细胞芳香族化合物的代谢过程(cellular aromatic compound metabolic process, GO: 0006725, 714)、杂环代谢过程(heterocycle metabolic process, GO: 0046483, 714)、有机循环复合生物合成过程(organic cyclic compound biosynthetic process, GO: 1901362, 286)和RNA代谢过程(metabolic process, GO: 0016070, 318)等GO术语。
参与细胞组成(Cellular component)的GO通路中, 富集程度最高的是nucleus (GO: 0005634, 601)和细胞内的核糖核蛋白复合体(Intracellular ribonucleoprotein complex, GO: 0030529, 765)。参与分子功能(molecular function)富集程度最高的包括催化活性(catalytic activity, GO: 0003824, 2511)和连接酶活性, 形成碳氮键(ligase activity, forming carbon-nitrogen bonds, GO: 0016879, 87)等(图4)。
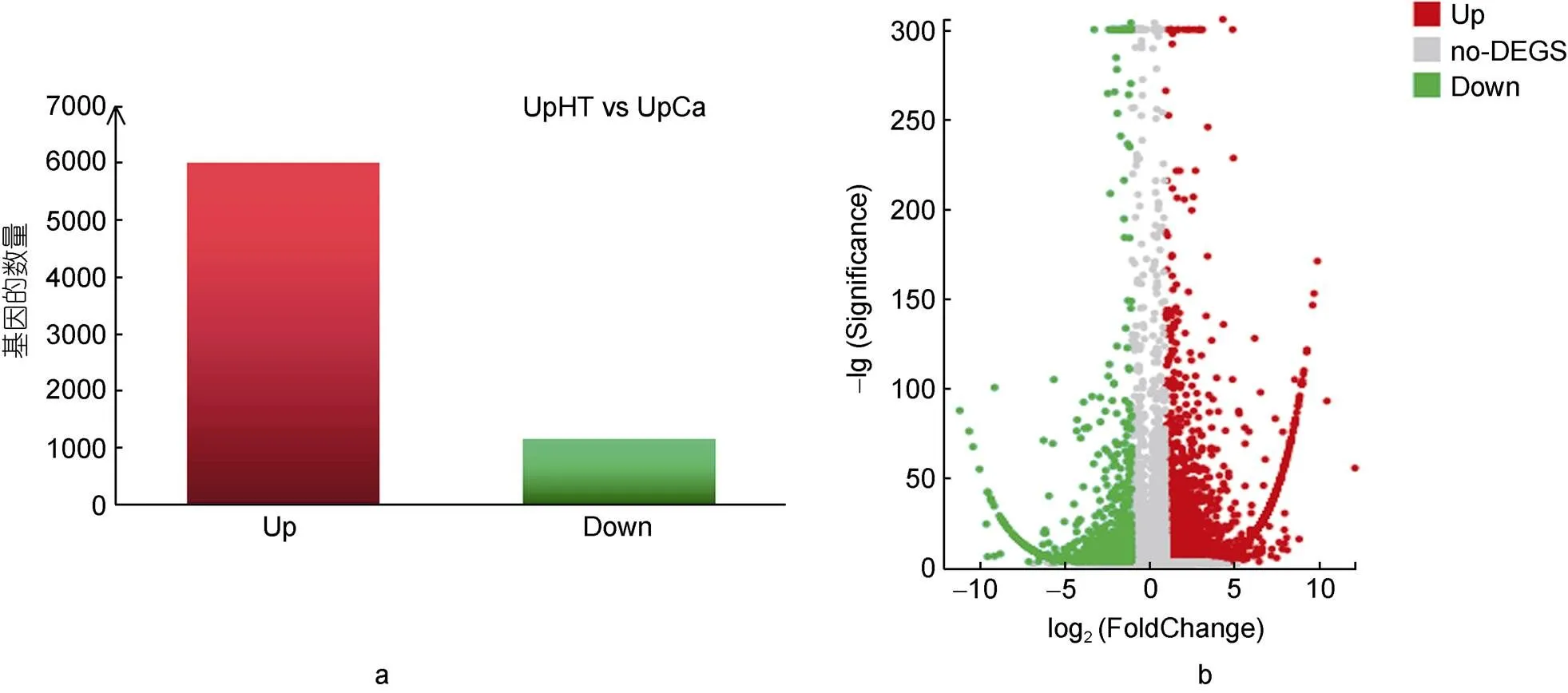
图2 浒苔UpCa处理下差异基因的分析
注: a. 上调和下调基因的数目; b. 火山图。X轴代表log2转换后的差异倍数值, Y轴代表-l转换后的显著性值。红色点表示上调的DEGs, 绿色点表示下调的DEGs, 灰色点表示差异不显著的基因
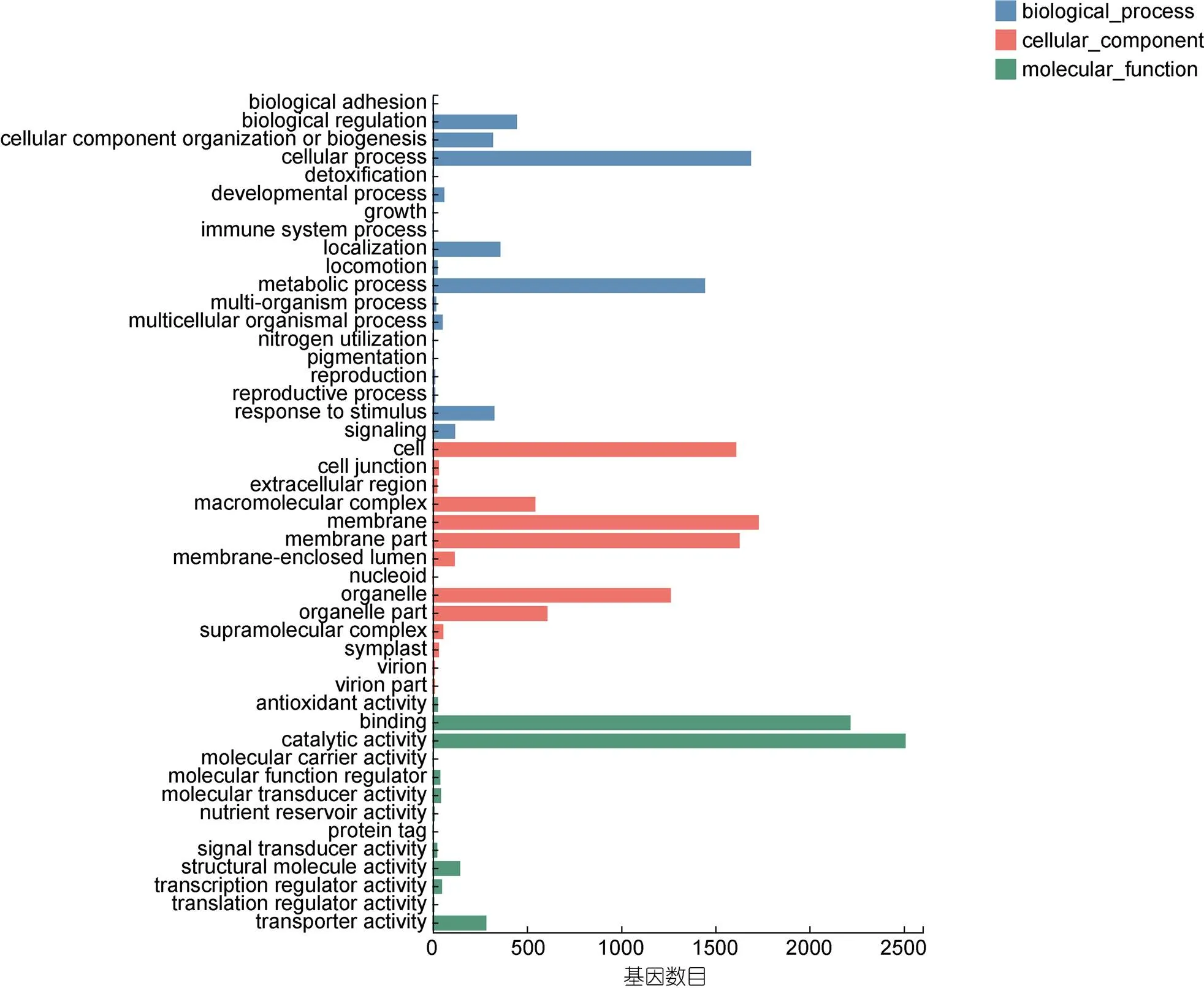
图3 差异基因GO分类
注: X轴代表注释到GO条目上的基因数目, Y轴代表GO功能分类
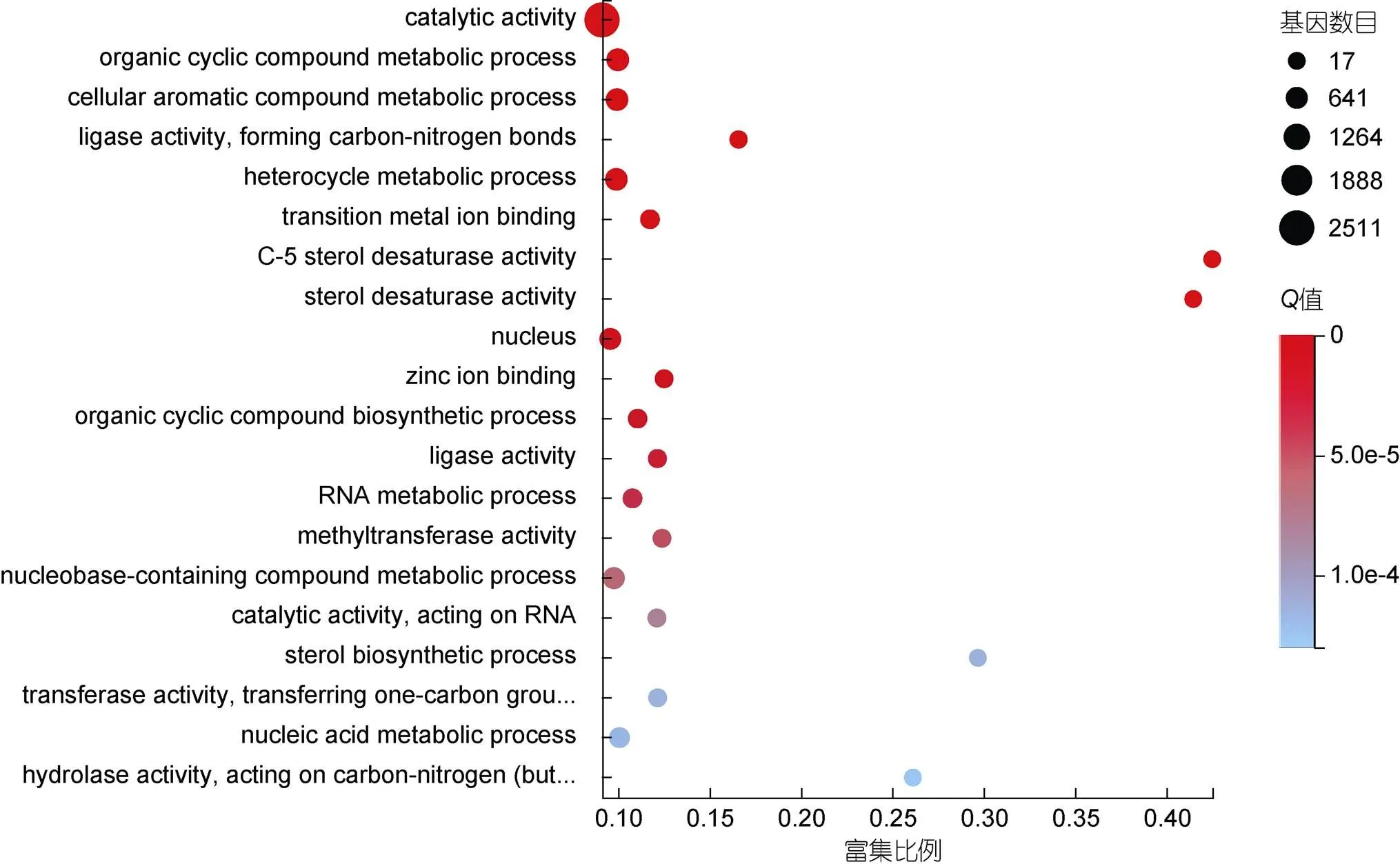
图4 差异基因GO富集分析气泡图
2.5 差异表达基因的KEGG通路和KEGG富集分析
为了研究涉及重要代谢途径的基因, 我们把注释的基因Mapped到KEGG pathway途径中。通过KEGG和KOBAS软件, 共有2121个DEGs基因mapped到21个level2。47个DEGs mapped到environmental adaptation, 66个DEGs mapped到signal transduction, 20个DEGs mapped到Membrane transport (图5)。
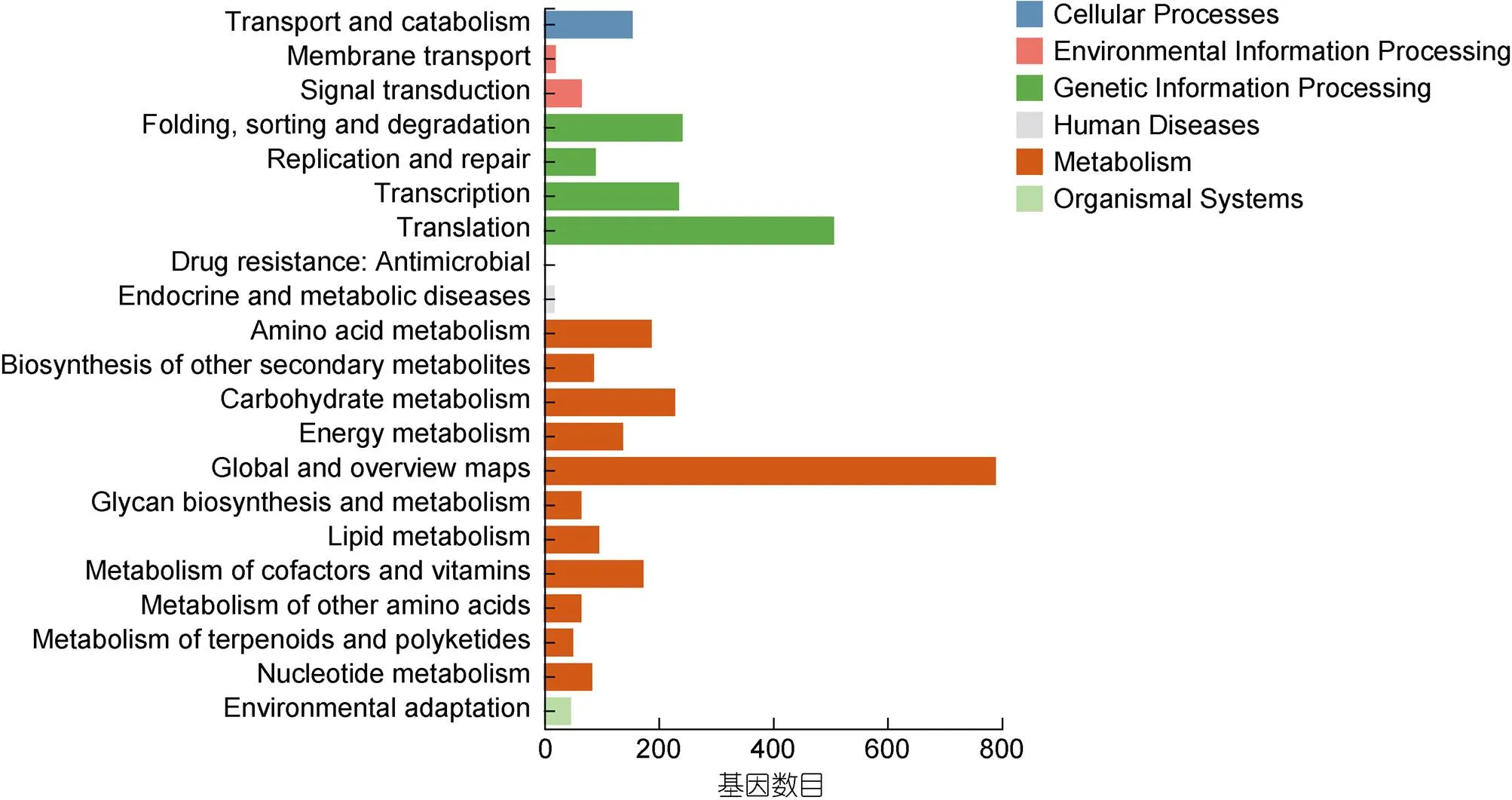
图5 差异基因的KEGG分类
根据KEGG注释结果, 利用KOBAS进行KEGG富集分析。富集程度较高的Pathway代谢途径主要是烟酸和烟酰胺代谢(nicotinate and nicotinamide metabolism, ko00760, 36)、核糖核酸聚合酶(RNA polymerase, ko03020, 95)、赖氨酸降解(lysine degradation, ko00310, 34)、糖基磷脂酰肌醇生物合成(glycosylphosphatidylinositol (GPI)-anchor biosynthesis,ko00563, 20)、维生素B1代谢(thiamine metabolism, ko00730, 20)、RNA降解(RNA degradation, ko03018, 60)、类胡萝卜素生物合成(carotenoid biosynthesis, ko00906, 22)和植物激素信号转导(plant hormone signal transduction, ko04075, 33)等(图6)。
进一步对KEGG分类中运输和分解代谢(transport and catabolism, 155)、膜运输(membrane transport, 20)、信号转导(signal transduction, 66)和环境适应(environmental adaptation, 47)共288个DEGs进行KEGG富集散点图分析(图7)。富集程度较高的代谢途径主要包括内吞(endocytosis, ko04144, 72)、植物-病原体相互作用(plant-pathogen interaction, ko04626, 42)、植物激素信号转导(plant hormone signal transduction, ko04075, 33)、丝裂原激活的蛋白激酶植物信号通路(MAPK signaling pathway-plant, ko04016, 42)、ABC转运(ABC transporters, ko02010, 20)和磷酸肌醇代谢(inositol phosphate metabolism, ko00562, 14)等(图7)。
3 讨论
藻类在遭受一系列的非生物胁迫, 如高温、低温、干旱等环境状况, 其对环境压力的防御机制主要是通过抗氧化酶的表达来调节适应性机制。我们主要从信号传导、抗氧化酶和热激蛋白等方面对差异基因的表达和鉴定进行进一步分析。
3.1 植物激素和信号转导相关的基因的鉴定和分析
已有的研究表明在非生物胁迫条件下高温改变了激素相关蛋白的表达(Reguera, 2013; Fan,2018)。在本研究中, UpCa处理改变了高温条件下参与植物激素信号转导和激素生物合成的关键酶的表达。筛选获得33个编码关键蛋白激酶的差异表达基因, 其中32个DEGs上调, 1个DEGs下调。脱落酸(abscisic acid, ABA)途径和细胞分裂素转导途径在植物的生长发育及压力胁迫调节中有很重要的作用。组氨酸磷酸转移蛋白(histidine-containing phosphorytransfer protein, AHP)主要作为细胞分裂素传感因子组氨酸激酶和反应调节因子(B-type ARRs)之间的磷酸化转移的介质, 通过His到Asp的多步磷酸化, 在促进细胞分裂素信号转导中发挥重要作用。在细胞分裂素(cytokinin)信号转导通路中, 下游的AHPs主要是通过保守的组氨酸残基来转运需要转运的保守的氨基酸。1个unigene编码的AHP和8个unigenes编码的反应调节因子(two-component response regulator ARR-B family)的表达水平都是差异性上调。在ABA的信号转导途径中, 在拟南芥的生化和分子遗传学研究中, 已经发现蛋白磷酸酶2C(PP2C)酶是植物信号转导过程中的负调节因子(Rodriguez, 1998; Fan, 2018)。在没有ABA的情况下, PP2C主要抑制蔗糖非发酵相关蛋白激酶2(sucrose non-fermenting 1-related protein kinase 2, SnRK2)蛋白的活性状态。在ABA的信号转导途径中, SnRK2s起着重要的作用。SnRK2s蛋白活性状态的抑制导致下游转录调控的减少。ABA减轻PP2C对SnRK2s的抑制作用, 激活SnRK2s启动下游信号转导。已有的研究表明, 浒苔在高温压力下, AHP和SnRK2s蛋白的表达增加, 而PP2C蛋白的表达降低说明细胞分裂素和ABA的信号转导通路在高温下被诱导(Reguera, 2013; Fan, 2018)。本研究表明, 在UpCa处理下8个unigenes编码丝氨酸-苏氨酸蛋白激酶(serine/ threonine-protein kinase, SRK2),基因表达都显著上调。PP2C也是显著性上调(表2)。另外, MAPK signal system中, 有丝分裂原活化蛋白激酶激酶激酶17/18(mitogen-activated protein kinase kinase kinase 17/18, MAPKKK17/18)和有丝分裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase 9, MAPKK9)都是上调。结果表明UpCa处理缓解了高温的压力, 改变了ABA信号转导途径、细胞分裂素信号途径和MAPK signal途径, 提高了对高温压力的适应性调节。
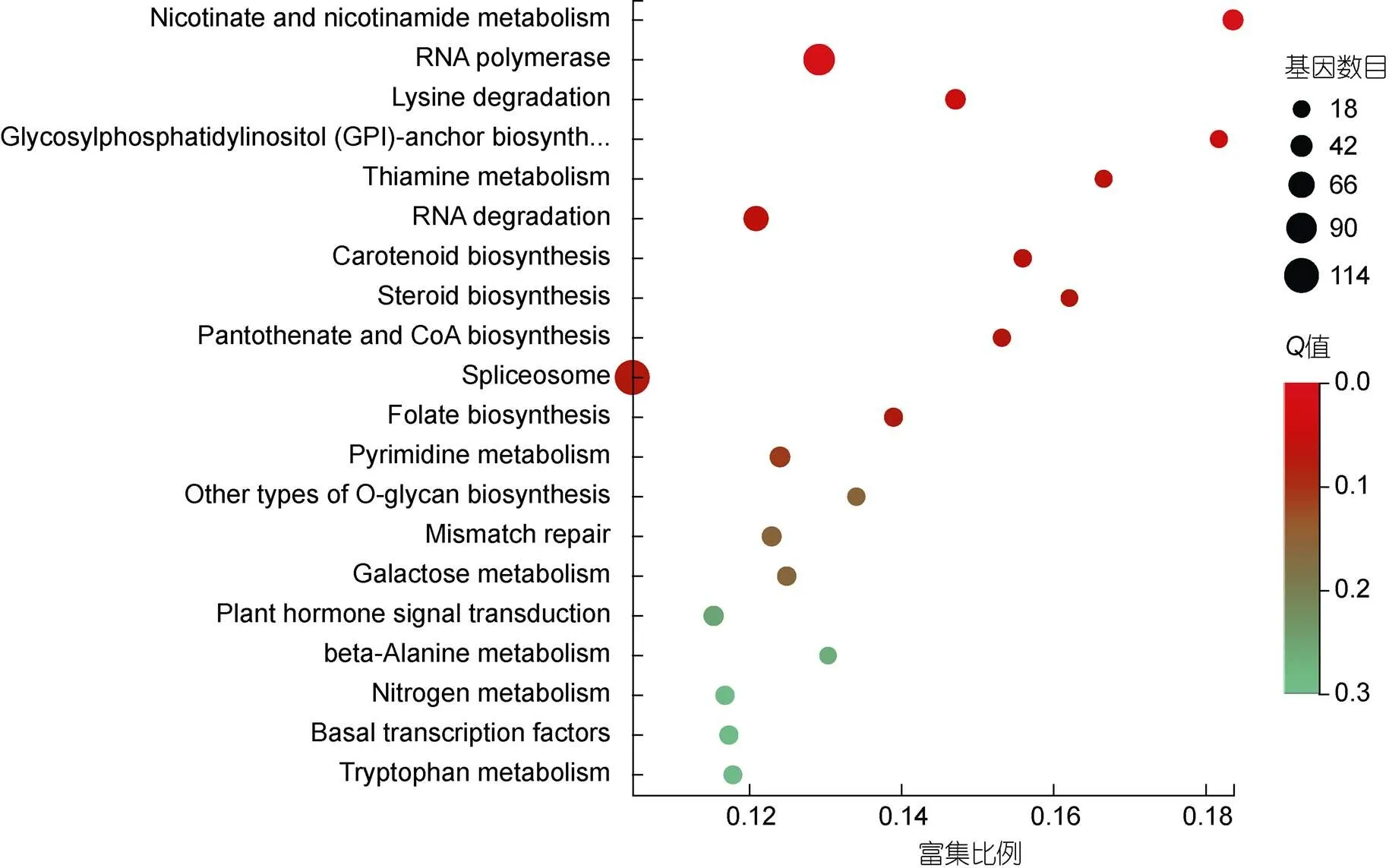
图6 差异基因的KEGG富集分析
注: Rich Factor是指在该代谢通路中差异表达的基因数与注释基因总数的比值。比值越大, 说明富集程度越高。value是校验后的value, 在0—1之间, 越邻近0, 富集越显著
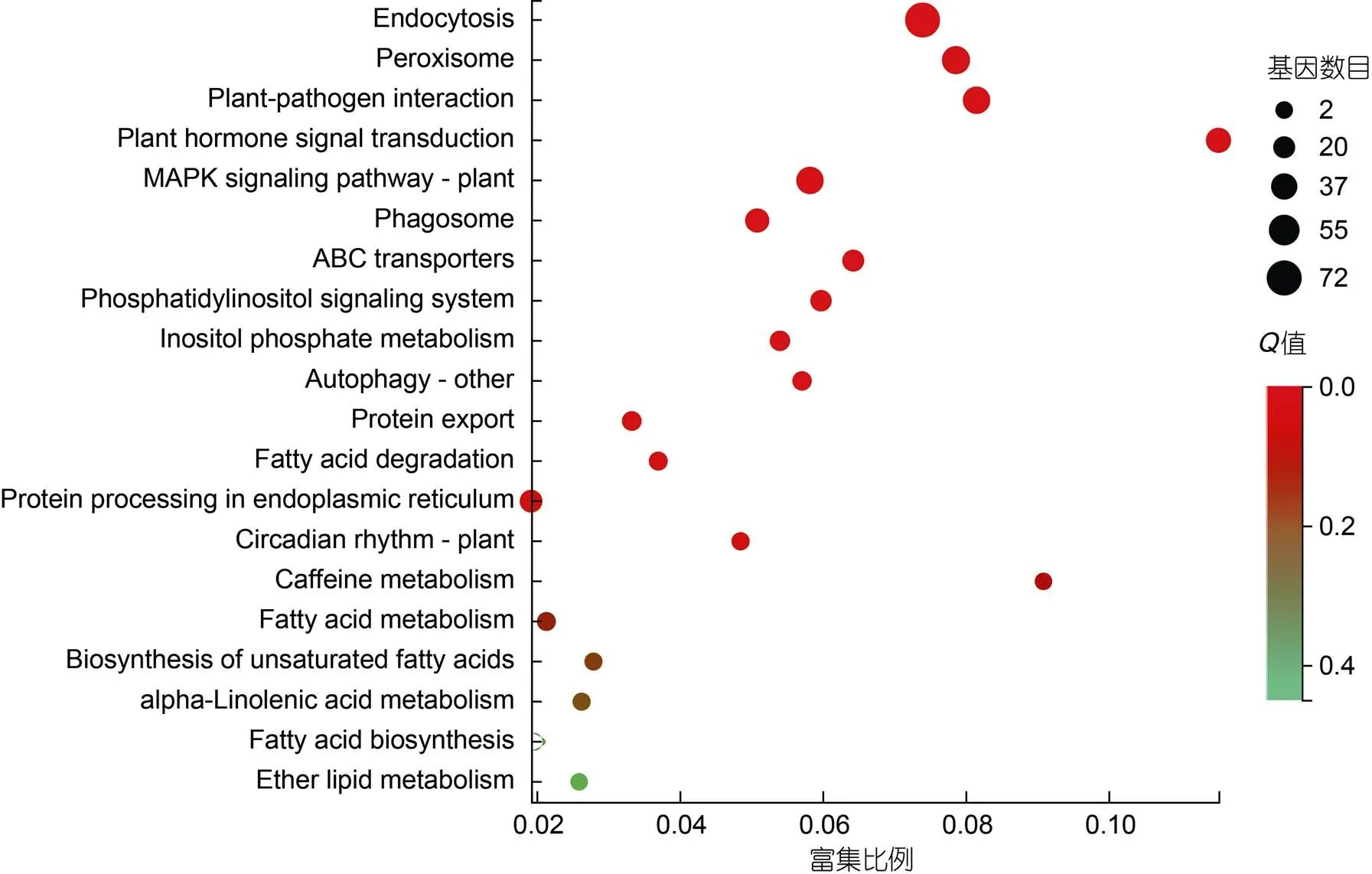
图7 信号和膜运输相关基因的KEGG富集分析
在油菜素内酯(brassinosteroid, BR)信号转导通路中, 丝氨酸/苏氨酸蛋白磷酸酶(serine/threonine- protein phosphatase BSU1, Unigene3691_All)基因的表达增加, BR的信号途径增强。乙烯信号转导途径中, 8个unigene编码的乙烯受体(ethylene receptor, ETR)和CL3860.Contig2_All编码的EIN3-binding F-box protein都是差异性上调。4个unigenes编码的CTR1(serine/threonine-protein kinase CTR1)表达上调。
植物的生长受到环境和激素信号的协调调节, 油菜素类固醇(BR)、细胞分裂素和ABA在温度胁迫适应性调节中发挥重要作用; 然而, 激素信号转导与环境信号之间的相互作用在分子水平上仍不清楚。结果表明, 可能是在高温状况下, 浒苔自身有一套应激反应机制来应对高温胁迫, 氯化钙的施加促进了这一套反应机制。因此, 浒苔细胞分裂素、脱落酸、油菜素内酯和乙烯信号转导途径增强, 促进了对非生物环境胁迫的适应。在应对高温胁迫时, 浒苔激素信号转导途径中氯化钙调节起着重要的作用, 但是其具体机制有待进一步深化研究。
表2 抗氧化、植物信号转导和Ca2+相关差异基因(部分)
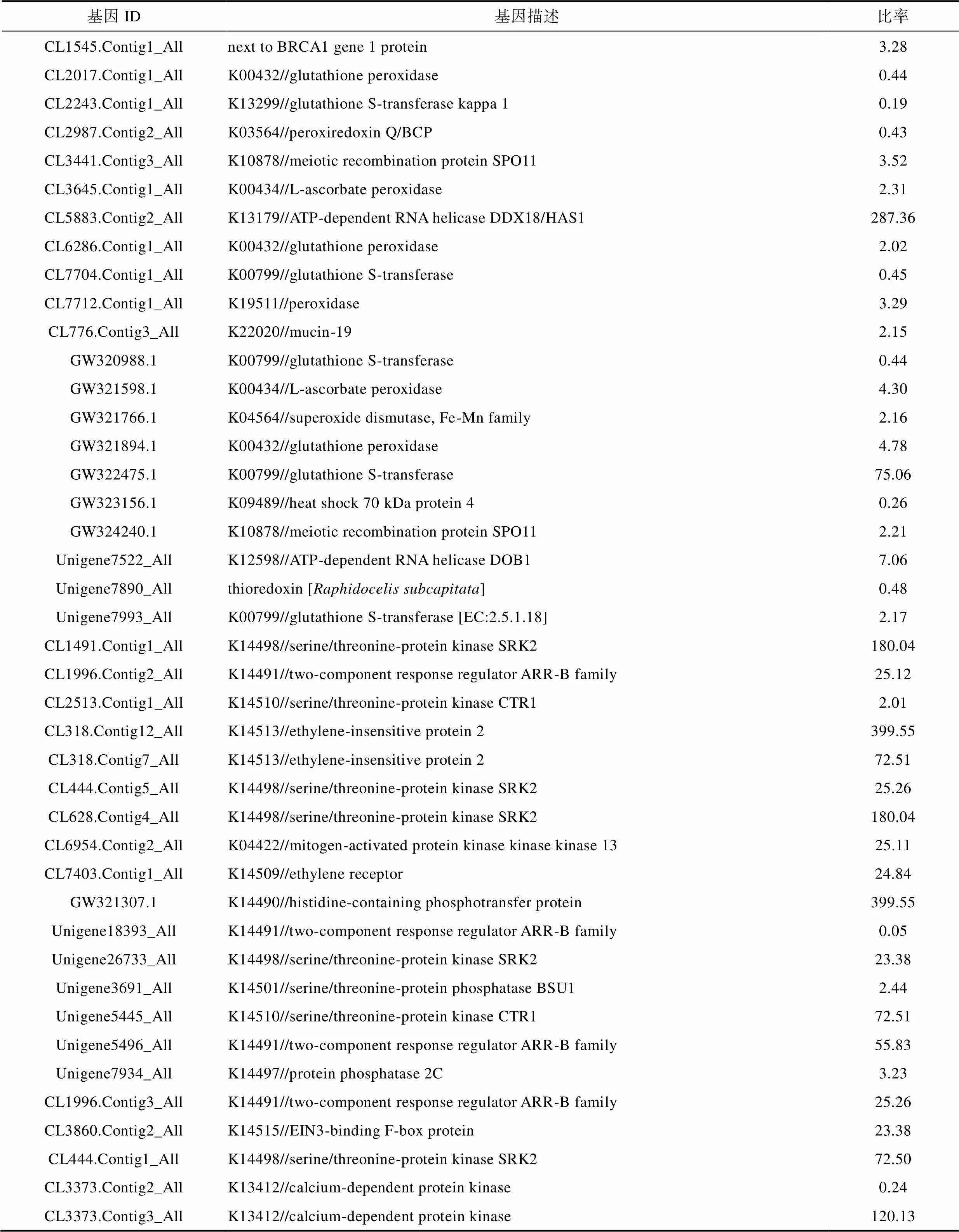
Tab.2 Antioxidant, plant signal transduction and Ca2+ related differentially expressed genes (portion)

续表
3.2 编码Ca2+信号组分的基因表达
Ca2+信号组分主要由3部分组成, 即生成Ca2+信号, 识别Ca2+信号, 转导, 最后开始针对特定刺激的反应。细胞质Ca2+水平是高度动态的, 并通过通道、泵和转运体对各种生物和非生物信号进行调节。信号转导过程中游离Ca2+水平的变化由Ca2+响应蛋白检测。钙调蛋白(CaM)、钙调磷酸酶b(CBL)和Ca2 +依赖的蛋白激酶(CDPKs)直接或间接调节转录的转录因子通过磷酸化/脱磷酸作用响应细胞内Ca2+增加(Shankar, 2014)。本研究结果表明15个DEGs编码的CDPK基因表达有差异性变化, 其中4个DEGs编码的基因表达下调, 11个DEGs编码的基因上调。钙结合蛋白(calcium-binding protein CML)、钙/钙调素依赖的蛋白激酶(calcium/calmodulin-dependent protein kinase)、钙调素(calmodulin)和钙/钙调蛋白依赖性3′,5′环核苷酸磷酸二酯酶(calcium/ calmodulin-dependent 3′,5′-cyclic nucleotide phosphodiesterase)的基因表达上调(表2)。Ca2+的感应因子CDPKs仅在植物和原生生物中被鉴定, 并且有一个结合Ca2+离子的自动调节域。对于CDPKs活性的调控, 不仅需要Ca2+离子, 还需要特定的磷脂和自磷酸化。结果表明, 外源CaCl2离子的添加激活了多种Ca2+信号组分, 使浒苔产生适应性反应和Ca2+的吸收更加顺畅, 这与已有研究结果相一致(González, 2012; Shankar, 2014; Goswami, 2015)。
3.3 抗氧化基因功能的鉴定
非生物胁迫如高温、低温和干旱可以诱发植物防御机制, 可以通过调节抗氧化酶表达来适应非生物压力。在高等植物中, 对高温胁迫的信号响应包括正常蛋白质合成的减少, 并伴随着热响应性的基因和热激蛋白(heat shock protein, Hsps)表达的上调, 导致活性氧的积累(Kim, 2013)。活性氧(ROS)是指自由基, 包括过氧化氢(H2O2)、单重态氧(O2−)和羟基自由基(OH–)。过量的ROS会破坏大分子和细胞膜。为了清除有毒的ROS, 藻类启动自身的抗氧化防御系统, 即超氧化物歧化酶(SOD)、过氧化氢酶、过氧化物酶、硫氧还蛋白和谷胱甘肽等(Wang, 2011)。目前的研究表明, 主要有15个抗氧化基因有差异性表达, 其中9个DEGs表达上调, 6个DEGs表达下调。上调的基因主要包括抗坏血酸过氧化物酶(L-ascorbate peroxidase)、谷胱甘肽过氧化物酶(glutathione peroxidase)、铁超氧化物歧化酶(Fe superoxide dismutase)、谷胱甘肽s-转移酶(glutathione S-transferase)、ATP依赖的RNA解旋酶(ATP-dependent RNA helicase DOB1)(表2)。下调的基因主要为谷胱甘肽过氧化物酶、谷胱甘肽s-转移酶和热激蛋白(heat shock 70 kDa protein)等(表2)。
Hsp70在新生蛋白的折叠、跨膜转运和错误蛋白的修复方面起着重要的作用。在植物遭受压力时, HSP70上调参与保持细胞的平衡, 保护机体免受伤害。高温下浒苔Hsp70的表达升高(Fan, 2018)。谷胱甘肽过氧化物酶主要是催化氧化谷胱甘肽(glutathione disulfide, GSSG)降解成巯基化的谷胱甘肽(sulfhydryl form glutathione, GSH), GSH在抵抗氧化反应和维持细胞的还原环境方面起到重要的作用。本研究结果表明UpCa处理缓解了高温压力, Hsp70的表达量下调, FeSOD genes和抗坏血酸过氧化物酶基因表达的上调显著增强了浒苔的抗氧化能力。谷胱甘肽过氧化物酶和谷胱甘肽s-转移酶转录本有上调也有部分下调, 可能是因为不同的转录本可能有相似的表象, 但是它们可能通过不同的Pathway途径行使不同的功能。
4 结论
采用BGISEQ平台进行高通量测序, 获得了浒苔UpCa和UpHT处理下相关的转录组数据。分析结果显示, 根据UpHT和UpCa处理分析共获得36625条基因, 在UpCa下鉴定出7513个差异表达的基因, 包括6002个基因上调, 1151个基因下调, 对差异基因进行了GO富集和KEGG富集分析。对膜转运、植物信号转导和环境适应性相关的DEGs进行分析, 主要富集在内吞(Endocytosis)、植物-病原体相互作用(Plant-pathogen interaction)、植物激素信号转导(Plant hormone signal transduction)、丝裂原激活的蛋白激酶(MAPK signaling pathway-plant)、ABC转运(ABC transporters)和磷脂酰肌醇信号系统(Phosphatidylinositol signaling system)等代谢通路上。
植物激素信号转导途径中, 细胞分裂素、脱落酸、油菜素内酯和乙烯信号转导途径增强。抗氧化酶中FeSOD、谷胱甘肽过氧化物酶和谷胱甘肽S转移酶, 抗坏血酸过氧化物酶等基因表达上调, 下调的基因主要是热激蛋白。Ca2+信号组分基因钙结合蛋白、钙/钙调素依赖的蛋白激酶、钙调素和钙/钙调蛋白依赖性3′,5′环核苷酸磷酸二酯酶的基因表达上调, 丝裂原活化蛋白激酶激酶激酶和磷脂酰肌醇信号相关的基因也差异性上调。植物信号转导、抗氧化酶、MAPK信号系统和Ca2+信号组分基因在外源CaCl2对浒苔高温压力的调节中具有重要的作用, 不同信号通路之间的相互作用还需要进一步研究。
朱婷芳, 管 峰, 苗 亮等, 2020. 大弹涂鱼()单核巨噬细胞低氧胁迫比较转录组学分析. 海洋与湖沼, 51(2): 335—344
陈 辉, 2011. 杜氏盐藻耐盐渗透调节与Ca2+介导的渗透信号传导. 广州: 华南理工大学博士学位论文
李雪娜, 韩 震, 刘贤博等, 2016. 浒苔和马尾藻的生消与海表面温度的相互影响研究. 海洋湖沼通报, (5): 126—130
Chávez-Sánchez T A, Piñón-Gimate E, Serviere-Zaragoza A, 2017. Recruitment inblooms in relation to temperature, salinity and nutrients in a subtropical bay of the Gulf of California. Botanica Marina, 60(3): 257—270
Fan M H, Sun X, Liao Z, 2018. Comparative proteomic analysis ofresponse to high temperature stress. Proteome Science, 16: 17
Fan M H, Sun X, Xu N J, 2017. Integration of deep transcriptome and proteome analyses of salicylic acid regulation high temperature stress in. Scientific Reports, 7(1): 11052
González A, Cabrera M D L Á, Henríquez M J, 2012. Cross talk among calcium, hydrogen peroxide, and nitric oxide and activation of gene expression involving calmodulins and calcium-dependent protein kinases inexposed to copper excess. Plant Physiology, 158(3): 1451—1462
Goswami S, Kumar R R, Sharma S K, 2015. Calcium triggers protein kinases-induced signal transduction for augmenting the thermotolerance of developing wheat () grain under the heat stress. Journal of Plant Biochemistry and Biotechnology, 24(4): 441—452
He B X, Hou L L, Dong M M, 2018a. Transcriptome analysis in: astaxanthin induction by high light with acetate and Fe2+. International Journal of Molecular Sciences, 19(1): 175
He Y L, Hu C Y, Wang Y H, 2018b. The metabolic survival strategy of marine macroalgaunder temperature stress. Journal of Applied Phycology, 30(6): 3611—3621
Hu C Y, Cui D D, Sun X, 2019. Transcriptomic analysis unveils survival strategies of autotrophicagainst high light stress. Aquaculture, 513: 734430
Im S, Choi S, Hwang M S, 2015. De novo assembly of transcriptome from the gametophyte of the marine red algaeand identification of abiotic stress response genes. Journal of Applied Phycology, 27(3): 1343—1353
Kim H J, Chiang Y H, Kieber J J, 2013. SCFKMDcontrols cytokinin signaling by regulating the degradation of type-B response regulators. Proceedings of the National Academy of Sciences of the United States of America, 110(24): 10028—10033
Li Y H, Wang D, Xu X T, 2017. Physiological responses of a green algae () exposed to simulated acid rain and decreased salinity. Photosynthetica, 55(4): 623—629
Reguera M, Peleg Z, Abdel-Tawab Y M, 2013. Stress-induced cytokinin synthesis increases drought tolerance through the coordinated regulation of carbon and nitrogen assimilation in rice. Plant Physiology, 163(4): 1609—1622
Rodriguez P L, 1998. Protein phosphatase 2C (PP2C) function in higher plants. Plant Molecular Biology, 38(6): 919—927
Rybak A S, 2018. Species of(Ulvophyceae, Chlorophyta) as indicators of salinity. Ecological Indicators, 85: 253—261
Shankar A, Srivastava A K, Yadav A K, 2014. Whole genome transcriptome analysis of rice seedling reveals alterations in Ca2+ion signaling and homeostasis in response to Ca2+deficiency. Cell Calcium, 55(3): 155—165
Wang H, Lin A P, Gu W H, 2016. The sporulation of the green algais controlled by changes in photosynthetic electron transport chain. Scientific Reports, 6: 24923
Wang J X, Sommerfeld M, Hu Q, 2011. Cloning and expression of isoenzymes of superoxide dismutase in(Chlorophyceae) under oxidative stress. Journal of Applied Phycology, 23(6): 995—1003
Wang L K, Feng Z X, Wang X, 2010. DEGseq: an R package for identifying differentially expressed genes from RNA-seq data. Bioinformatics, 26(1): 136—138
COMPARATIVE TRANSCRIPTOME STUDY OFTO CALCIUM CHLORIDE TREATMENT UNDER HIGH TEMPERATURE STRESS
TANG Xiao-Wen1, FAN Mei-Hua1, WANG Chao-Feng1, LIAO Zhi1, LI Peng1, XU Nian-Jun2, 3, 4, 5, WANG Jian-Xin1
(1. Marine Science and Technology College, Zhejiang Ocean University, Zhoushan 316022, China; 2. National Engineering Research Laboratory of marine biotechnology and Engineering, Ningbo University, Ningbo 315832, China; 3. Key Laboratory of Applied Marine Biotechnology (Ningbo University), Ministry of Education, Ningbo 315832, China; 4. Collaborative Innovation Center for Zhejiang Marine High-efficiency and Healthy Aquaculture, Ningbo University, Ningbo 315832, China;5. Key Laboratory of Marine Biotechnology of Zhejiang Province, Ningbo University,Ningbo 315832, China)
As a necessary signal molecule, calcium (Ca2+) plays an important role in plant growth and abiotic stress regulation. The transcriptome variation of exogenous CaCl2addition in.at a high temperature (35 °C) was analyzed in experiment using BGISEQ platform. The high temperature with CaCl2addition was the treatment group (denoted UpCa), and high temperature was the control group (UpHT). Results show that 36625 genes were obtained, of which 7513 differentially expressed genes were identified, including 6002 up-regulated genes and 1151 down-regulated genes. The DEGs related to membrane transport, plant signal transduction and environmental adaptability were analyzed. They were mainly enriched in endocytosis, plant pathogen interaction, plant hormone signal transduction, mitogen activated protein kinase (MAPK signaling pathway plant), ABC transporters, and phosphatidylinositol signaling system. In the metabolic pathway of plant signaling transduction system, cytokinin, abscisic acid, brassinolide, and ethylene signal transduction pathways were enhanced. The expressions of FeSOD, GSHPx, glutathione-s-transferase, and ascorbic acid peroxidase were up-regulated, and the down regulated genes were heat shock protein. The expressions of calcium binding protein, calcium/calmodulin dependent protein kinase, calmodulin, and calcium/calmodulin dependent 3′,5′-cyclic nucleotide phosphodiesterase were up-regulated. The mitogen activated protein kinase kinase kinase (MAPKKK) and phosphatidylinositol signal related genes were also up-regulated. In this study, the important roles of plant signal transduction, antioxidant enzyme, MAPK signal system, and Ca2+signal component genes in exogenous CaCl2regulation of high temperature pressure in.were systematically reviewed. These results will provide a basis for further elucidating the mechanism of Ca2+signal regulation and adaptation to high temperature.
; exogenous CaCl2; transcriptome; high temperature
* 浙江省省属高校基本科研业务费项目, 2019J00049号; 浙江省自然科学基金项目, LY20D060006号; 宁波大学海洋学院联合实验室开放基金项目, 2019—2021; 浙江海洋大学博士启动基金项目, Q1701号; 浙江省一流学科开放基金项目, 2019—2021。唐晓雯, E-mail: 1759406725@qq.com
范美华, E-mail: dinger503@163.com; 王健鑫, E-mail: jxwang@zjou.edu.cn
2020-10-26,
2020-12-29
Q523.8; Q789; S917
10.11693/hyhz20201000297
猜你喜欢
杂志排行
海洋与湖沼的其它文章
- 基于高通量测序技术解析鲣鱼(Katsuwonus pelamis)鱼油和鱼白调控肠道菌群结构作用*
- 龙须菜(Gracilariopsis lemaneiformis)海藻糖-6-磷酸合成酶(TPS)对逆境胁迫的响应*
- 基于北斗船位数据的渔业信息解译与应用研究——以中国毛虾限额捕捞管理为例*
- 温度对美洲黑石斑(Centropristis striata)幼鱼生长和免疫因子活力与相关基因表达的影响*
- 条斑紫菜Tubulin和Kinesin基因家族鉴定及失水胁迫表达模式分析*
- 白芍(Radix paeoniae alba)提取物对中华绒螯蟹(Eriocheir sinensis)造血组织发育及造血因子Astakine的影响*
