IL-1β通过STAT3信号通路上调食管鳞癌细胞PD-L1表达的研究*
2021-05-19郑树涛杨丽菲张琪琪韩秀娟阿尔孜古丽吐尔逊卢晓梅
郑树涛,刘 清,刘 涛,杨丽菲,张琪琪,韩秀娟,阿尔孜古丽·吐尔逊,卢晓梅
(1新疆医科大学临床医学研究院;2省部共建中亚高发病成因与防治国家重点实验室,乌鲁木齐830011;3新疆医科大学第一附属医院检验科,乌鲁木齐830054)
食管癌(esophageal carcinoma,ESCA)是最常见的上消化道恶性肿瘤之一,中晚期患者5年生存率不足10%。ESCA有食管鳞癌(Esophageal squamous cell carcinoma,ESCC)和食管腺癌(Esophageal adenocarcinoma,EAC)两种组织病理学分型。EAC多见于欧美,ESCC为亚洲高发[1]。食管癌的发生与环境因素和饮食习惯等密切相关[2],多数就诊的患者确诊时已处于晚期。晚期食管癌由于失去了最佳的手术治疗机会,主要采用化疗/靶向治疗方案。对于晚期的食管癌患者,化疗与靶向治疗效果极为有限、导致复发率和转移率偏高,致使食管癌患者总体预后较差,5年生存率不足20%[3]。因此,在食管鳞癌中寻找新的治疗靶点[4]和探索新的治疗方法[5-6]显得尤为重要。
免疫治疗已成为继靶向治疗之后,肿瘤治疗领域的最有希望的疗法[7]。临床研究发现,肿瘤微环境对食管癌患者的免疫治疗起着重要的调控作用[8]。在食管鳞癌微环境中,存在大量的M2型肿瘤相关巨噬细胞(TAMs)的浸润[9]。前期研究发现,M2型TAMs浸润密度高的ESCC患者其总生存要比浸润密度低的患者总生存差[9];且源于M2型TAMs的促炎细胞因子白介素1β(IL-1β)能促进食管鳞癌细胞的迁移和浸润[10],提示IL-1β作为促炎细胞因子能够增加食管癌细胞的恶性细胞学行为。但IL-1β在ESCC细胞中对细胞程序性细胞死亡1配体1(PD-L1,又称为CD274)的表达调控尚不明确。PD-L1作为重要的免疫检查点分子,其表达状态在肿瘤的免疫治疗中起着重要的作用。本研究拟分析IL-1β对ESCC细胞的PD-L1表达调控作用并明确其临床意义,探讨IL-1β能否在食管癌免疫治疗中作为一个干预靶点提供理论依据。
1 材料与方法
1.1 生物信息学分析 运用GEPIA(Gene Expression Profiling Interactive Analysis)[11]和TIMER(Tumor Immune Estimation Resource)[12]数据库分析IL-1β和PD-L1在人ESCA中的表达水平及预后意义。
1.2 细胞培养 食管鳞癌细胞系KYSE30(中国医学科学院惠赠)在37℃,5%CO2条件培养,含10%胎牛血清(FBS),青霉素(100 IU/mL)及链霉素(100 IU/mL)的RPMI1640培养液中培养。所有的细胞实验均在细胞对数生长期时进行。重组的人源化IL-β蛋白购自义翘神州公司(货号:10139-H07E;义翘神州公司;北京),其处理细胞的工作浓度为20 ng/mL。
1.3 实时荧光定量PCR(qRT-PCR)运用Trizol法提取细胞总RNA,NanoDrop ND-2000超微量分光光度计检测总RNA的纯度和浓度。Invitrogen™公司的Super Script™III逆转录酶(货号:18080044;ThermoScientific;美国)反转录成cDNA。用Takara TB Green Fast qPCR Mix荧光定量qPCR试剂盒(货号:RR430B;TaKaRa;中国大连)进行实时荧光定量PCR检测。PD-L1上游引物:5-CCTACTGGCATTTGCTGAACGCAT-3;PD-L1下游引物:5-ACCATAGCTGATCATGCAGCGGTA-3;β-actin上游引物:5-CATGTACGTTGCTATCCAGGC-3;β-actin下游引物:5-CTCCTTAATGTCACGCACGAT-3;引物的退火温度为55℃。PCR反应程序设置为:95℃预变性5 min;95℃变性60 s,55℃退火60 s,72℃延伸60 s,扩增40个循环;72℃延伸5 min。以β-actin为内参照,采用2-ΔΔCt法计算PD-L1 mRNA的相对表达量。
1.4 免疫印迹 采用RIPA蛋白裂解液进行细胞总蛋白的提取,并用BCA蛋白质定量试剂盒进行总蛋白的浓度测定。将总蛋白在8%的聚丙烯酰胺凝胶(SDS-PAGE)进行蛋白质电泳;待蛋白条带跑到胶底,100 V恒压转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。含5%的TBST脱脂牛奶中封闭4℃过夜或室温2 h,TBST缓冲液洗涤3遍,每遍5 min;之后进行兔抗人PD-L1(稀释度1∶1 000;货号:66248-1-Ig,Proteintech,武汉)和兔抗人β-actin(1:1 000;货号:TA-09;ZSGB-BIO,北京)和兔抗人GAPDH(稀释度1∶1 000;货号:10494-1-AP,Proteintech,武汉)抗体一抗孵育4℃过夜或室温2 h;TBST缓冲液洗涤3遍,每遍5 min;进行碱性磷酸酶AP标记的二抗(货号:SA00002-2;Proteintech,武汉)孵育室温1 h,TBST缓冲液洗涤3遍,每遍5 min;之后碱性磷酸酶底物显色试剂盒(BCIP/NBT)(货号:002209,Invitrogen,美国)进行显色。
1.5 免疫荧光 将处于对数生长期的食管鳞癌细胞接种在激光共聚焦显配套专用微皿(货号:801001;NEST公司;无锡)上,待细胞贴壁后,用浓度为20 ng/mL重组的人源化IL-β蛋白(货号:10139-H07E;义翘神州公司;北京)刺激1 h,以未处理的细胞作为对照组。用pH=7.0~7.2的磷酸盐缓冲液(PBS)洗涤3次,每次3 min;然后用4%的多聚甲醛溶液进行室温固定20 min,然后PBS洗涤3次,每次3 min;然后用0.5%的Triton®X-100 PBS进行通透20 min;然后PBS洗涤3次,每次3 min;然后加入正常山羊血清进行室温封闭20 min,然后PBS洗涤3次,每次3 min;然后兔抗人PD-L1(稀释度1:1 000;货号:66248-1-Ig,Proteintech,武汉)一抗孵育4℃过夜。然后PBS洗涤3次,每次3 min;在暗盒中加入羊抗兔IgG(H+L),Alexa Fluor®488荧光标记二抗(稀释度2μg/mL;货号:A27034;Thermo Scientific;美国),室温孵育30 min,然后PBS洗涤3次,每次3 min;然后加入DAPI(4,6-二脒基-2-苯基吲哚)荧光染料(货号:C0065;Solarbio;北京)进行细胞核染色。之后,进行荧光倒置显微镜观察采集图片。
1.6 抗体芯片 采用RIPA蛋白裂解液进行细胞总蛋白的提取,并用BCA蛋白质定量试剂盒进行总蛋白的浓度测定。将实验组和对照组总蛋白分别用Cy5和Cy3两种不同颜色的荧光分子分别标记两个样品,洗去多余的标记分子,与抗体芯片(芯片型号:AAH-JAKSTAT-1-8;RayBiotech,广州)杂交孵育,扫描分析结果。
1.7 统计学处理 采用SPSS17.0软件对数据进行统计学分析,所有的计量资料以均值±标准差(±s)表示,并进行正态分布检验,每个试验至少进行2~3次,符合正态分布的两组间的数据比较独立样本t检验;计数资料采用卡方检验,预后采用Kaplan-Meier生存曲线分析和对数秩检验分析方法,以P<0.05表示差异具有统计学意义。
2 结果
2.1 IL-1β和PD-L1在人食管癌中的表达水平及预后意义 通过分析GEPIA数据库中收录的有关IL-1β和PD-L1的mRNA在ESCA中表达的数据,发现相比在癌旁正常组织,IL-1β和PD-L1的mRNA在ESCA组织中上调表达,但PD-L1(CD274)不具有统计学差异(P<0.05)(图1A)。运用另一个数据库TIMER,分析IL-1β和PD-L1的mRNA在ESCA中的表达,发现在TIMER数据库中,相比在癌旁正常组织,IL-1β和PD-L1的mRNA在ESCA组织中均呈显著性上调表达(P<0.001)(图1B)。通过这两种不同的数据库分析,PD-L1的结果是一致的,即PD-L1的mRNA在ESCA组织中显著性上调表达。而IL-1β只在TIMER数据库中呈显著性上调表达,但是在GEPIA数据库中虽然上调但不具有统计学差异。分析GEPIA数据库数据显示,上调的IL-1β和PD-L1的mRNA与ESCA患者不良预后有统计学趋势但是不具有统计学意义(P值分别为0.061与0.052)(图1C和1D)。运用Pearson相关分析,发现IL-1β和PD-L1的mRNA表达之间具有统计学相关性(R2=0.194;P=0.008 1)(图1E),提示ESCA组织中IL-1β和PD-L1的mRNA表达 之间具有统计学正相关。

图1 生物信息学分析IL-1β和PD-L1 mRNA在食管癌中的表达水平及预后意义
2.2 IL-1β上调食管鳞癌细胞系KYSE30细胞的PD-L1表达 在体外食管鳞癌细胞系水平,运用重组的人源化IL-β蛋白刺激食管鳞癌细胞系KYSE30,运用qRT-PCR检测发现,PD-L1的mRNA在重组的人源化IL-β蛋白短时间处理下表达迅速升高,相比对照组差异具有统计学意义(P<0.001)(图2A)。在蛋白水平,运用免疫印记和免疫荧光发现,食管鳞癌细胞系KYSE30在重组的人源化IL-β蛋白刺激下,其PD-L1蛋白表达上调(图2B和2C)。该结果表明,重组人源化IL-β蛋白刺激食管癌细胞后能够显著性上调食管癌细胞的PD-L1蛋白表达。
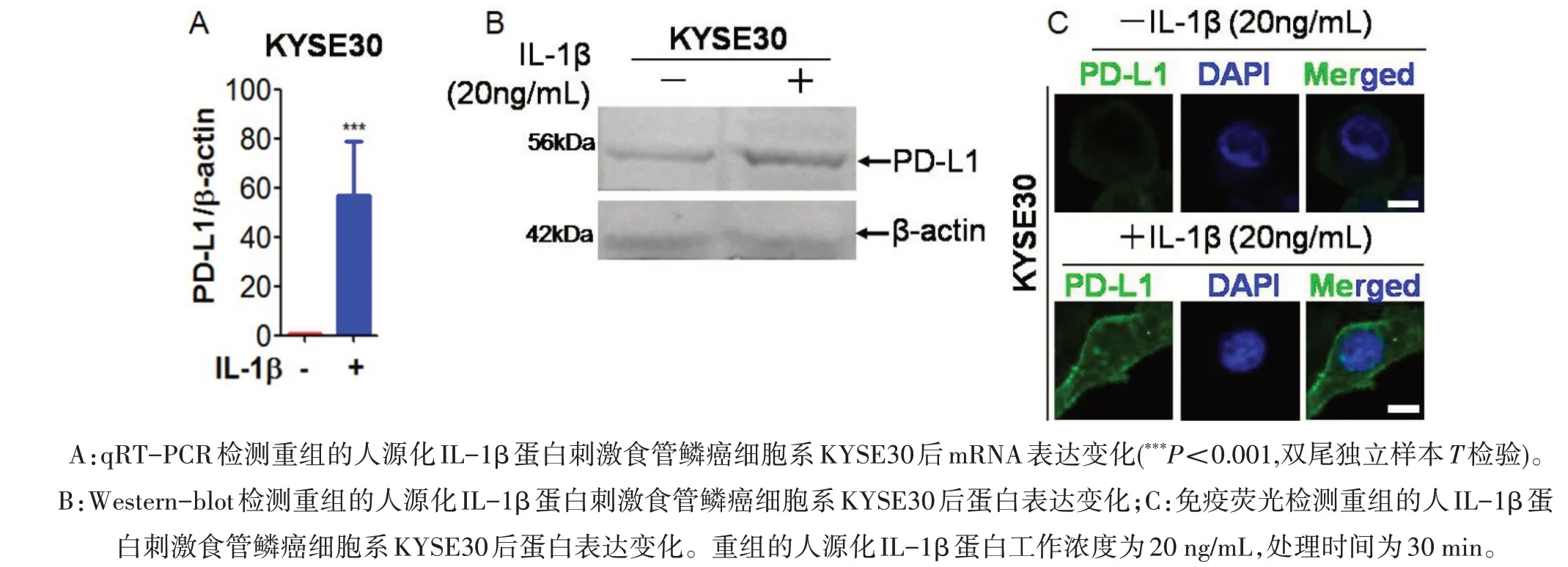
图2 重组的人IL-1β蛋白刺激食管鳞癌细胞系KYSE30后上调PD-L1的mRNA和蛋白表达
2.3 IL-1β激活STAT3信号通路 为了明确重组的人源化IL-β蛋白如何上调PD-L1蛋白表达,本研究运用抗体芯片技术筛选了食管癌细胞食管鳞癌细胞系KYSE30在重组的人源化IL-β蛋白刺激与非刺激下,差异信号通路的筛选,发现相比IL-β蛋白未刺激,KYSE30在重组的人源化IL-β蛋白刺激下其胞内的STAT3信号通路被激活(图3A)。运用免疫印迹,验证了抗体芯片筛选的结果(图3B),表明重组的人源化IL-β蛋白通过激活STAT3信号通路来上调PD-L1的表达。
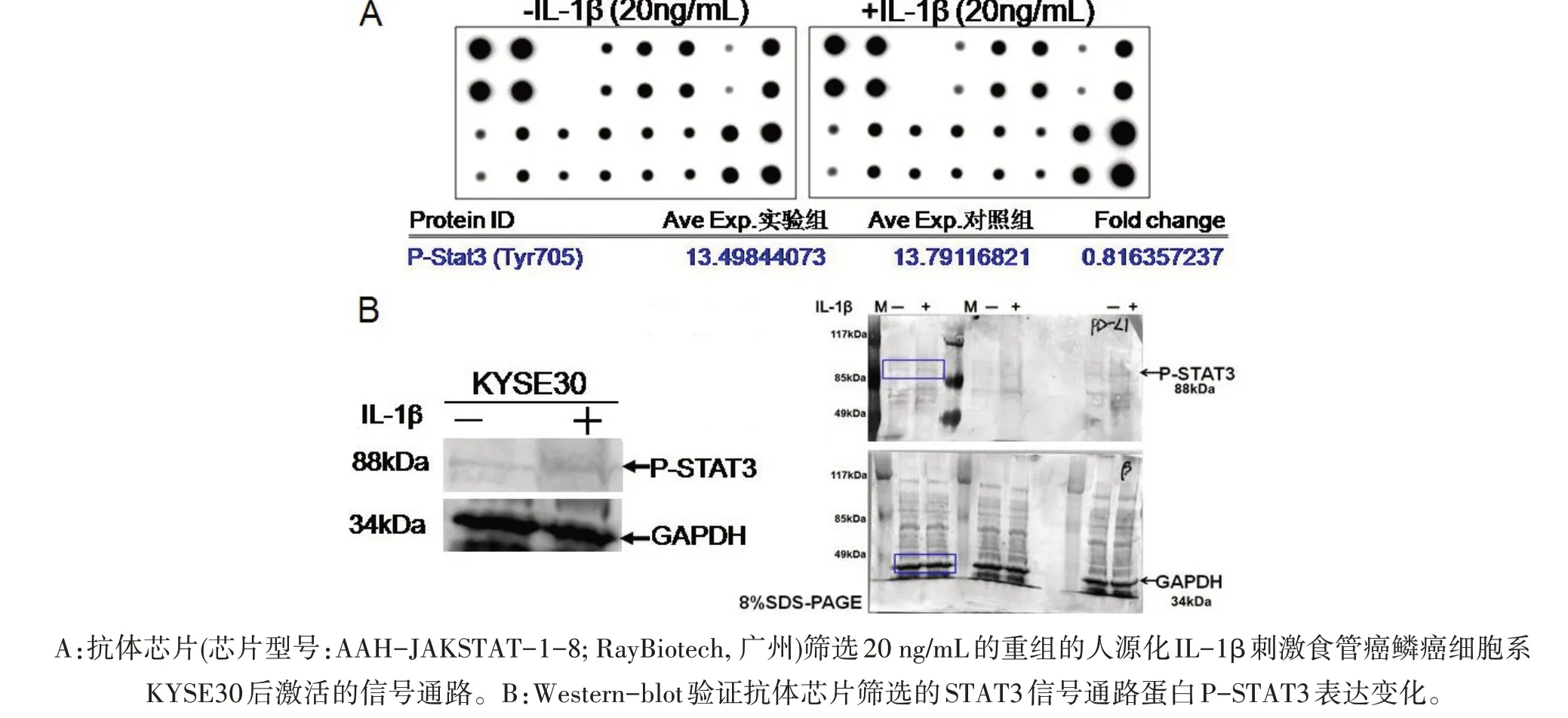
图3 抗体芯片筛选IL-1β刺激食管癌鳞癌细胞系KYSE30后激活的信号通路
3 讨论
在本研究中,通过分析GEPIA[11]和TIMER[12]数据库发现相比癌旁正常组织,IL-β和PD-L1的mRNA在ESCA组织中显著性上调;且上调的IL-β和PD-L1的mRNA与ESCA患者的总生存具有统计学趋势不具有统计学相关性。在体外食管鳞癌细胞系水平,IL-β能够通过激活STAT3信号通路上调食管癌细胞的PD-L1表达。本研究结果提示,IL-β可能作为食管鳞癌抗PD-L1抗体免疫治疗的一个联合干预靶标。因此,本研究对食管鳞癌的免疫治疗具有一定的理论参考价值。
在正常生理状态下,组织细胞表面的PD-1与其配体PD-L1结合后可抑制T细胞的过度增殖活化,维持机体正常的免疫平衡。在肿瘤发生时,肿瘤细胞表面过度表达的PD-L1可阻止T细胞的活化及增殖,进行负性调节免疫应答,诱导T细胞凋亡,使肿瘤细胞发生免疫逃逸进而促进肿瘤增长[13]。本研究发现IL-β能够通过激活STAT3信号通路上调食管癌细胞的PD-L1表达;提示IL-β可以作为下调PD-L1过度表达的一个潜在干预靶标。在食管癌肿瘤微环境中,过度表达的IL-β从何而来?前期实验,通过体外细胞共培养体系发现IL-β主要来源于M2型肿瘤相关巨噬细胞,而食管鳞癌细胞本身分泌的IL-β极其少[10]。因此,在食管鳞癌微环境中M2型肿瘤相关巨噬细胞通过分泌大量的IL-β从而促进食管鳞癌细胞高表达PD-L1,从而协助肿瘤细胞免疫逃逸。
在本研究中,通过分析GEPIA和TIMER数据库中IL-β和PD-L1的mRNA表达数据发现,尽管相比癌旁正常组织,IL-β和PD-L1的mRNA在ESCA组织中显著性上调;但是显著上调的IL-β和PD-L1的mRNA与ESCA患者的总生存只有统计学趋势但并不具有统计学相关性。这与大多数PD-L1与食管鳞癌预后相关报道不一致[14-15]。导致不一致的原因可能在于:这些数据库中收录的ESCA包括了ESCC和EAC;而ESCC和EAC是两种病理生理发病机制完全不同的两种肿瘤[16],因此IL-β和PD-L1的mRNA与ESCA患者的总生存只有统计学趋势。此外,检测方法的不同也会导致最终结果的不同。这两个数据库中收录的都是RNA测序(RNA-Seq)的数据,即都是mRNA表达水平;而其他研究运用的都是免疫组化技术[17]检测食管鳞癌组织的IL-β和PD-L1。在本研究中,发现IL-β能够激活STAT3信号通路,这与Wang等[18]的研究报道是相一致的,其研究发现PD-L1的表达依赖于STAT3信号通路[19]。但是激活的STAT3信号通路如何上调PD-L1表达的调控机制目前仍不清楚,需要进一步研究。在M2型巨噬细胞中IL-β如何被调控的尚不清楚。最近的一份研究可能解释了M2型肿瘤相关巨噬细胞如何调控IL-β分泌的。Zhang等[20]通过研究发现脂肪酸氧化促进了M2型巨噬细胞分泌IL-β从而促进食管癌细胞的迁移。
综上所述,本研究从细胞因子角度解释了食管鳞癌微环境中M2型巨噬细胞如何通过上调食管癌细胞的PD-L1表达来协助食管癌细胞发生免疫逃逸的机制,这对食管癌抗PD-L1抗体治疗中协同抑制靶标探讨具有一定的参考价值。
