LncRNA H19介导的let-7表达下调对食管癌细胞上皮间质转化的影响①
2021-05-19郑树涛陈玉梅张琪琪杨丽菲卢晓梅
刘 清,郑树涛,刘 涛,陈玉梅,张琪琪,杨丽菲,卢晓梅
(1新疆医科大学临床医学研究院,2省部共建中亚高发病成因与防治国家重点实验室,乌鲁木齐830011;3新疆医科大学第一附属医院检验科,乌鲁木齐830054)
最新研究表明中国癌症发病约占全球癌症发病的1/4,来自中国的癌症死亡事件更是超过全球占比的1/4,癌症是造成中国人死亡的首要原因,而食管癌作为最常见的恶性肿瘤之一,其发病率居全球第七位,死亡率居全球第六位,中国位于全球食管癌负担最重的东亚地区,2020年统计结果显示在中国每18例癌症死亡中就有1例是食管癌[1]。由于食管癌早期不易被发现,较早发生的转移及对周围组织的侵袭导致大部分病人就诊时病变已处于中晚期,并且一旦发生远处转移,死亡率普遍较高[2]。因此,探讨介导食管癌侵袭转移的分子机制对于改善食管癌患者预后、降低食管癌死亡率具有重要的意义。
长链非编码RNA(Long non-coding RNA,lncRNA)是一类在长度上大于200 nt的非编码RNA,其本身不表现任何蛋白编码潜能,但其作为潜在的基因调控因子在个体发育及肿瘤发生、发展中起重要作用,因而受到越来越多的关注[3]。LncRNA H19位于染色体11p15.5的端粒区域附近,其表达与多种肿瘤的进展和转移相关,H19可以通过转录水平或转录后水平调控参与细胞功能变化[4],然而,H19促进食管癌转移的机制尚未明确。根据生物信息学预测,miRNA let-7与H19之间存在四个不同位置的结合位点[5],并且本课题组前期研究发现let-7下调HMGA2参与食管癌细胞上皮间质转化(Epithelial-Mesenchymal Transition,EMT)过程[6],因此,本研究旨在讨论食管癌中H19通过let-7调控上皮间质转化的作用,明确H19参与食管癌侵袭转移的机制。
1 材料与方法
1.1 临床病理样本和细胞株 收集2005-2010年在新疆医科大学第一附属医院接受手术的48例食管癌患者的癌组织及癌旁组织,液氮冷冻至提取总RNA,逆转录聚合酶链反应合成cDNA,于-80℃保存。所有样本均经病理诊断确诊为鳞癌,且在术前均未经过放疗和化疗。所有患者均获得知情同意书,并且项目通过医院伦理委员会审核。食管癌细胞株KYSE450、KYSE150和KYSE30为中国医学科学院国家重点实验室馈赠,Eca109和EC9706购自武汉大学细胞保藏中心。所有细胞均在RPMI-1640培养液中培养(HyClone公司),添加10%胎牛血清(Gibco公司)和1%青-链霉素(HyClone公司),放置于37℃加5%CO2的恒温细胞培养箱中进行培养。
1.2 细胞转染 于对数生长期收集食管癌细胞,按照5×105个/毫升计数后将细胞接种于6孔板上,使用LipofectamineTM3000(Invitrogene公司),根据说明进行转染实验。空白对照组:仅转染LipofectamineTM3000;阴性对照组:5'-ACAGAACAUAACGACGAACTTGUUCGUCGUUA UGUUCUGUTT-3';实验组:siRNAH19-1(5'-GAACCCACAACAU GAAAGATTUCUUU CAUGUUGUGGGUUCTT-3')、siRNA-H19-2(5'-CA GCCCAACAUCAAAGACATTUGU CUUUGAUGUUGG GCUGTT-3'),siRNA-H19-3(5'-CAGCCUUCAAGCA UUCCAUTTAUGGAAUGCUUGAAGGCUGTT-3')。
1.3 实时荧光定量PCR(qRT-PCR)收集食管癌组织和癌旁组织、以及食管癌细胞沉淀,使用TRIzol试剂(life公司)提取总RNA。用Nano-Drop ND-2000分光光度计测定RNA的浓度和质量,使用RevertAid First Strand cDNA试剂盒(Thermo公司)将1 000 ng RNA反转录为cDNA,采用试剂盒(Takara公司)进行qRT-PCR实验。所有样本均设置3个复孔,以β-actin为内参,结果通过2-ΔΔCT进行计算。
1.4 蛋白质印迹分析 使用RIPA缓冲液(含蛋白酶抑制剂和磷酸酶抑制剂,Thermo公司)裂解细胞。蛋白质用BCA蛋白质分析法(Solarbio公司)定量后,加入loading缓冲液(Solarbio公司),在100℃下煮沸10 min进行蛋白质变性。SDS-PAGE电泳并转膜,5%牛血清白蛋白(SIGMA公司)室温封闭0.5 h,加入一抗(上皮间质转化抗体试剂盒,Cell Signaling Technology公司),4℃摇床孵育过夜后,用TBST(1%Tween 20)洗涤膜3次/10 min,加入二抗,室温避光孵育2 h,洗膜后用Odyssey-Clx扫描并用Image Studio ver5.2对结果进行分析。
1.5 统计学处理 采用SPSS17.0软件进行处理。计量资料结果以(±s)表示,采用t检验、单因素方差分析或秩和检验分析差异的显著性,用Kaplan-Meier法绘制生存曲线并进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 食管癌中H19和let-7表达情况 通过qRTPCR检测48对食管癌组织及相应的癌旁组织中H19和let-7的表达(图1A、1B)。结果 发现,H19在食管癌组织中总的平均表达水平显著高于癌旁组织(图1C)。进一步分析H19在食管癌中的表达与临床病理参数之间的相关性发现,H19表达上调与食管癌的浸润深度呈显著正相关关系(表1,P<0.05)。Kaplan-Meier生存分析显示,食管癌中H19表达上调与患者预后不良显著相关(图1D),即高表达H19的食管癌患者预后较差。
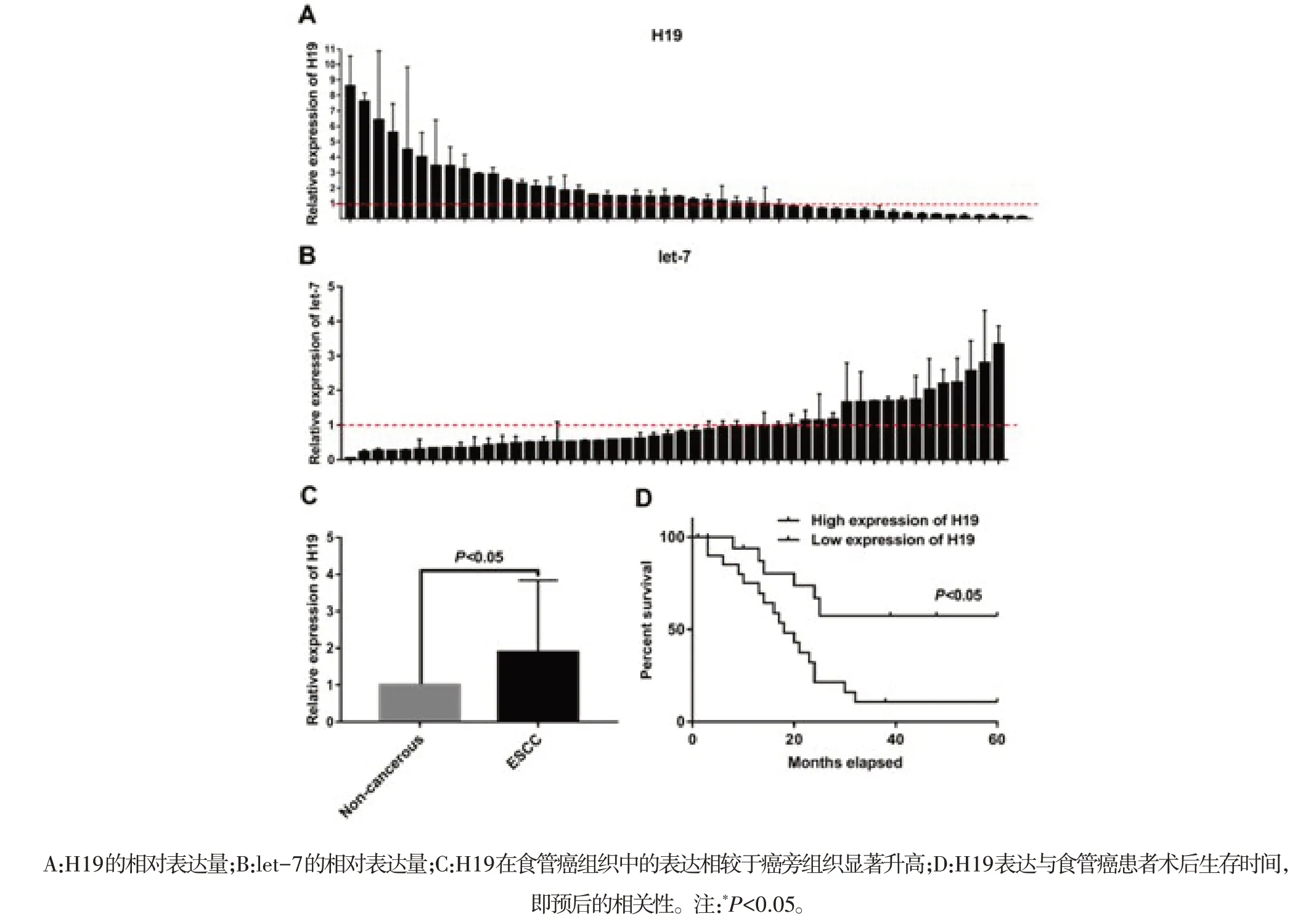
图1 H19和let-7在48例食管癌临床样本中的表达
2.2食管癌细胞中H19表达对EMT的影响 通过慢病毒转染干预H19在食管癌细胞中的表达,进一步运用Western blot检测EMT相关蛋白的表达,结果发现敲低H19表达后,食管癌细胞KYSE30和Eca109中上皮标志物E-cadherin蛋白表达量上调,而间质标志物β-catenin、Vimentin和Slug表达量均下调,与空白对照组和阴性对照组比较差异均有统计学意义(图2,P<0.05),提示H19能够促进食管癌细胞的EMT过程。
2.3 H19与let-7在食管癌组织中表达的相关性分析 通过McNemar统计分析验证48例食管癌组织样本中H19和let-7表达之间的相关性,结果显示,H19在食管癌组织中高表达的同时,let-7呈显著低表达(表2,P<0.05)。
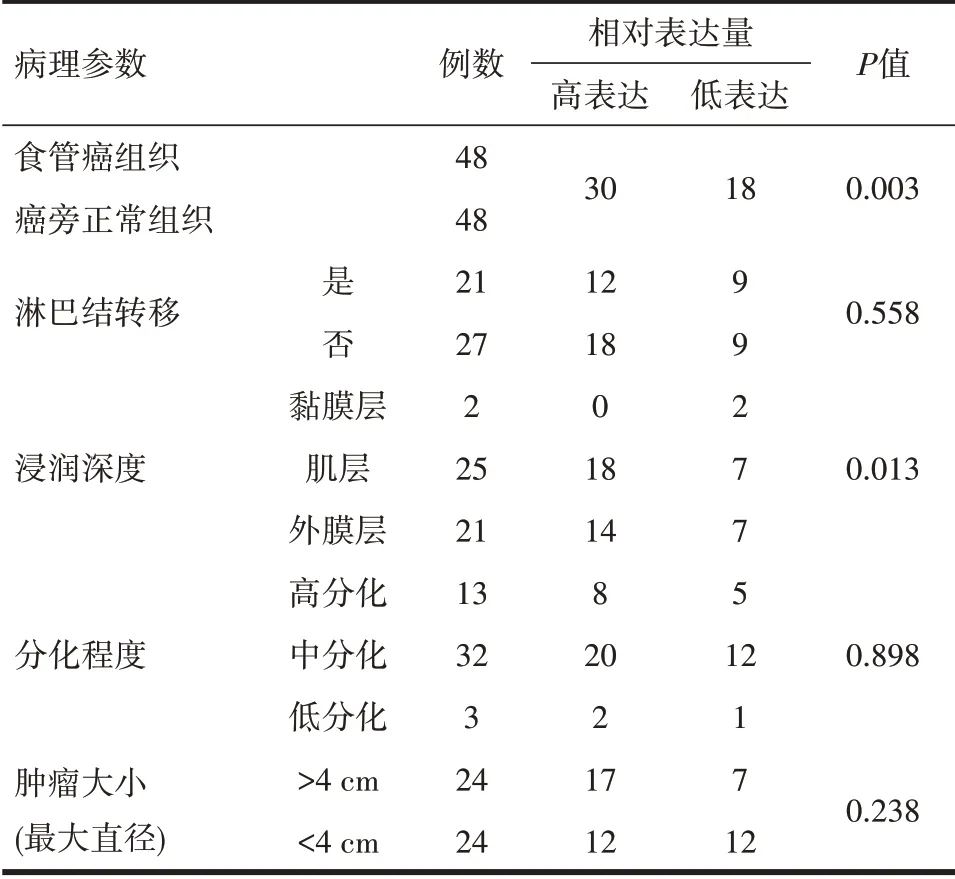
表1 H19在食管癌中的表达与临床病理参数的相关性分析

图2食管癌细胞中H19表达对EMT的影响

表2 H19与let-7在食管癌组织中表达的相关性分析
为了进一步阐明H19和let-7之间的相互作用,本研究通过qRT-PCR检测了H19和let-7在食管癌细胞株中的表达,结果发现与正常食管上皮细胞HEEC相比,H19在食管癌细胞Eca109、EC9706、KYSE30、KYSE150和KYSE450中的表达均上调(图3A),而let-7在食管癌细胞中的表达均下调(图3B)。此外,分别转染不同序列的H19干扰慢病毒后,H19表达均下调,而let-7的表达增多,与空白对照组和阴性对照组比较差异均有统计学意义(图3C,图3D,P<0.05)。以上结果表明H19可能通过负调控let-7的表达,从而介导食管癌细胞EMT过程。

图3 食管癌细胞中H19与let-7的相关性分析
3 讨论
非编码RNA(Non-conding RNAs,ncRNAs)是指人类基因组中仅转录而不翻译成蛋白质的RNA,根据功能不同可分为结构性非编码RNA(核糖体RNA、转运RNA、核小RNA、端粒相关RNA等)和调节性非编码RNA(微小RNA、小干扰RNA等),根据片段大小又可分为小于200 nt的小非编码RNA(small Nonconding RNAs,sncRNAs)和大于200 nt的长链非编码RNA(long Non-conding RNAs,lncRNAs)[7]。LncRNA
虽广泛见于动植物及原核生物,但其在不同物种间保守性差,并且由于其二级结构更为复杂,lncRNAs在转录水平和转录后水平均能够发挥调控作用,其与DNA、RNA和蛋白质之间的作用形式以及功能更为多样[8]。
作为最常见的lncRNA之一,H19在包括结直肠癌、胃癌、胆囊癌等多种肿瘤中表达上调,并参与各类肿瘤的转移过程[9-11]。在结直肠癌中,H19通过与miR-200a竞争性结合,抑制β-catenin表达,从而促进细胞增殖[9]。在胃癌相关的研究中发现,H19和miR-675在胃癌组织和细胞中的表达量均显著上调,H19/miR-675轴通过抑制FADD(Fas associated via death domain)表达,随后抑制包括caspase 8和caspase 3参与的caspase裂解级联,最终诱导胃癌细胞凋亡[10]。在胆囊癌中,敲低H19表达能够通过竞争性结合内源性miR-342-3p,调控FOXM1的表达,从而抑制胆囊癌细胞侵袭[11]。本课题组前期研究也发现,在食管癌中,敲低H19的表达后,食管癌细胞增殖、迁移和侵袭能力均显著下降,而细胞凋亡显著增多,说明H19是调控食管癌恶性表型的重要分子[12]。综上所述,H19及其相关基因组成的网络调控在肿瘤发生和侵袭中发挥重要的作用。
EMT是肿瘤进展转移的重要机制,研究发现H19参与了肿瘤EMT过程。在膀胱癌中,H19作为竞争性内源RNA,通过调控miR-29b-3p,从而介导EMT和膀胱癌转移[13]。在胆囊癌中,H19下调上皮标志物E-cadherin表达水平,增加间质标志物Vimentin和Twist1的表达[14]。在舌鳞癌中,敲低H19表达后,βcatenin/GSK-3β/cyclin D1/c-myc信号级联的活化受到抑制,从而上调E-cadherin和ZO-1表达,抑制Ncadherin、Vimentin、Snail1、Twist1和ZEB1的表达[15]。
在鼻咽癌中,H19通过抑制let-7促进肿瘤细胞增殖和转移[16]。在乳腺癌中,H19的过度表达破坏了let-7和LIN28之间的稳态平衡,导致let-7的抑制和随后LIN28的升高[17]。本研究发现,H19在食管癌组织及细胞系中均呈显著高表达,并且与食管癌患者预后不良显著相关,同时H19高表达伴随let-7低表达。通过慢病毒转染敲低食管癌细胞中H19的表达后,E-cadherin蛋白表达量上调,而β-catenin、Vimentin和Slug表达量均下调,说明H19参与促进食管癌EMT过程,进一步检测let-7的表达发现,H19表达下调后let-7的表达显著增多。结合本课题组前期研究结果,表明H19可能通过负调控let-7的表达,介导EMT过程,从而促进食管癌细胞恶性表型。此外,H19可能是let-7靶向原癌基因HMGA2的“支架”,H19锚定let-7间接激活HMGA2[18]。本课题组前期研究发现let-7在转录后水平靶向调控HMGA2的表达,参与食管癌EMT进程,因此,食管癌中H19调控let-7表达介导EMT的作用机制有待进一步验证。
总之,本研究发现H19在食管癌中过度表达,提示预后不良,H19通过抑制let-7,介导EMT,该过程可能促进食管癌细胞增殖和侵袭等恶性表型。该结果为进一步明确H19和let-7参与食管癌侵袭转移的机制,探讨阻断食管癌侵袭转移过程、改善患者预后提供新的思路。
