大鼠shRNA-Slfn5重组腺病毒载体的构建及其在EPCs中的转染效率 *
2021-05-18李玉珠况春燕
李玉珠,况春燕
(1.贵州大学医学院,贵阳 550025;2.贵州省人民医院心内科,贵阳 550002)
血管内皮损伤被认为是动脉粥样硬化的触发因素和关键因素。以往研究表明,来自骨髓或脾脏的内皮祖细胞(EPCs)有可能被整合到损伤区域并分化为内皮细胞(ECs),从而有助于改善内皮功能[1]。Schlafen(Slfn)基因家族包含10种鼠源基因(Slfn 1,1L,2,3,4,5,8,9,10和14),5种人类Slfn蛋白(SLFN5,11,12,13和14)[2-5]。Slfn5 基因由1个AAA结构域、1个独特的SLFN盒及1个预测的具有螺旋-转-螺旋结构域的转录调节区组成[6]。Slfn5是肾细胞癌(RCC)患者的较好生存标志,敲除RCC中的Slfn5会导致癌细胞显著增加。据报道,Slfn5可以调节涉及RCC迁移的基质金属蛋白酶(MMP)基因的表达,例如MMP-1和MMP-13[6-7]。由此可见,Slfn5是一个具有极其重要功能的蛋白,对其进一步研究有着重要的意义。然而,Slfn5是否可以调控心血管系统,对EPCs增殖及其迁移的影响及机制迄今为止尚未研究。为探讨Slfn5基因对EPCs生物学行为的影响,本研究构建了shRNA-Slfn5重组腺病毒用于感染EPCs并观察其在EPCs中的转染效率,现将研究结果报道如下。
1 材料与方法
1.1 材料来源
大鼠原代EPCs(上海庚运生物科技有限公司)、HEK293细胞(上海和元生物技术有限公司)、大肠杆菌DH5α株、测序引物(华大基因)、TaqDNA聚合酶、dNTP、pDKD-CMV-eGFP-U6-shRNA载体、AxyPrep质粒DNA小量试剂盒、无缝克隆试剂盒、DNA凝胶回收试剂盒、PrimescriptTMRT试剂盒、T4DNA连接酶、限制性内切酶AgeⅠ、EcoRⅠ、抗生素(氨苄青霉素、卡那霉素)、DMEM培养基、LB培养基、限制性内切酶和限制性内切酶缓冲液(10×)、乙酰化低密度脂蛋白(DiI-AC-LDL,美国Invitrogen公司)、多聚甲醛(PFA细胞芯片生物技术,中国深圳)、荆豆凝集素I (FITC-UEA-I,美国Sigma-Aldrich公司)。
1.2 干扰载体的构建
1.2.1干扰靶点的设计和引物合成
采用美国VectorNTI软件,针对大鼠Slfn5基因(GenBank Gene ID:XM_220775.7)的mRNA序列设计了5条 siRNR序列及1条无义的阴性对照(NC)序列见表1。人工合成上述6对引物,在正向引物和反向引物的5′末端分别加入AgeⅠ和EcoRⅠ的限制性位点,中间含发卡环(loop)序列(表2)。
1.2.2目的穿梭质粒的构建与鉴定
载体pDKD-CMV-eGFP-U6-shRNAs用AgeⅠ和EcoRⅠ消化使其线性化,通过在22 ℃下用T4DNA连接酶处理4 h。将聚合酶链反应片段插入纯化的穿梭载体中。将产物转化为DH5α感受态细胞,并将细胞在37 ℃下在卡那霉素抗性平板上孵育过夜。从平板中选择单个菌落,并在37 ℃的液体培养基中振荡(300 r/min)传代培养过夜。按照说明书用质粒纯化试剂盒提取并纯化质粒,然后在37 °C下消化2 h,消化后的质粒用1%琼脂糖凝胶电泳确认。正向引物hU6-F2:TACGATACAAGGCTGTTAGAGAG位于人U6启动子序列中,反向引物pYSEQR:CTATTAATAACTAATGCATGGC位于CMV启动子的5′序列。将菌落鉴定得到的阳性克隆被送至华大基因进行测序。经测序验证正确的质粒命名为shRNA-Slfn5(1)、shRNA-Slfn5(2)、shRNA-Slfn5(3)、shRNA-Slfn5(4)、shRNA-Slfn5(5)、shRNA-Slfn5(NC),最后质粒被提取。

表1 Slfn5基因siRNA序列片段
1.3 重组腺病毒的包装、扩增和滴度测定
1.3.1病毒包装和扩增
HEK293T细胞在37 ℃和5% CO2培养箱中在高糖DMEM培养基(美国Hyclon公司)中培养,该培养基含有10%胎牛血清(Gibco)。步骤:将HEK293细胞接种到6孔板上,培养24 h至对数生长期,用于在60%~80%汇合时转染;培养皿中加入1.5 mL不含血清的新鲜培养基,5 μg质粒DNA与10 μL Lipofectamine 2000混合,转染到293细胞中;转染后2、8、15 d,荧光显微下观察细胞形态变化。在细胞转化(具有病毒斑的扩大的圆形细胞形状)并开始分离后,轻轻刮下细胞,通过在-70 ℃/37 ℃下反复冷冻和解冻3次进行裂解。短暂离心后,收集病毒上清液并在-20 ℃下储存。病毒上清液用于第2次转染HEK293A细胞,病毒扩增后,收集病毒上清液并浓缩。
1.3.2腺病毒的滴度测定
将HEK293细胞按5.0 × 105个/孔接种24孔板后,培养12 h。依次将10-8~10-5稀释的病毒液加入24孔板中,每孔加入100 μL感染48 h。观察细胞培养中病毒空斑的形成,每孔随机选择5个视野,使用光学显微镜10×物镜下计算阳性细胞数。计算每孔阳性细胞的平均个数和病毒滴度。病毒滴度(PFU/mL) = (平均视野阳性细胞数×每孔视野的个数×稀释倍数) /0.1 mL。
1.4 重组腺病毒的鉴定
前面构建的Slfn5过表达腺病毒质粒(pADV-MCMV-Slfn5-3xFLAG-P2A-EGFP) 包含有 flag 标签,所以可以使用 Flag 抗体检测共表达与干扰质粒共转染的293T细胞。Western Blot验证质粒shRNA-Slfn5(1)、shRNA-Slfn5(2)、shRNA-Slfn5(3)、shRNA-Slfn5(4)、shRNA-Slfn5(5)对过表达病毒转染的293T细胞中Slfn5蛋白表达的干扰效果。
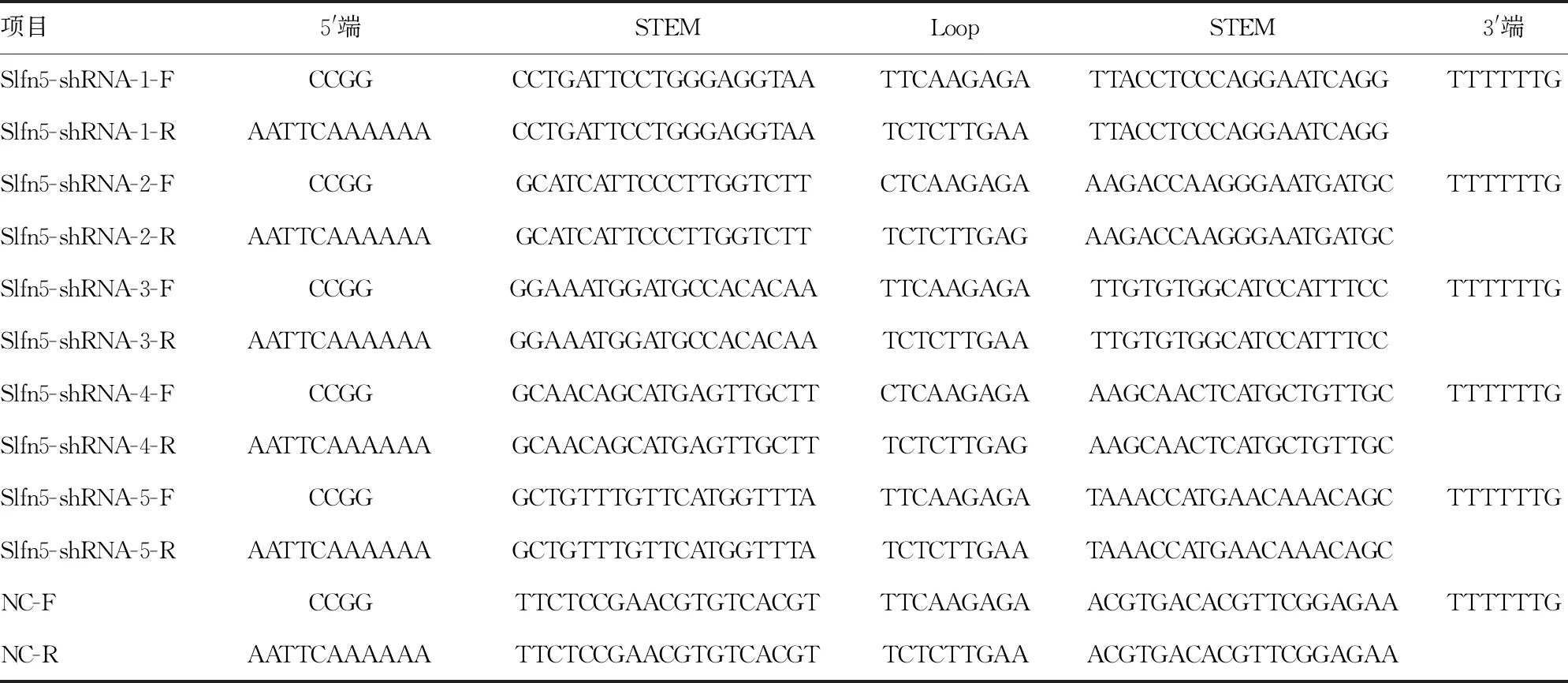
表2 病毒载体构建框架
1.5 EPCs的鉴定与转染
鉴定EPCs,细胞与2.4 ng/mL的DiI-AC-LDL结合,在37 °C下放置1 h;并固定在2%多聚甲醛15 min。用PBS洗涤后,细胞用10 mg/mL FITC-UEA-Ⅰ染色;样品用PBS漂洗3次,并用共聚焦显微镜拍照记录。此外,EPCs表型通过荧光激活细胞分选术(FACS)用5种抗体测定。用0.25%胰蛋白酶消化收集贴壁细胞,将之与FITC结合的抗体ECs标志物(CD31、CD34、KDR)、干细胞标志物(CD45、CD133)在4 ℃下孵育30 min,磷酸盐缓冲液(PBS)洗涤后,用PBS悬浮细胞进行流式细胞术检测。待EPCs长至大约板面积的70%即可加入重组腺病毒转染EPCs,在荧光显微镜下观察绿色荧光蛋白的表达,计算绿色荧光细胞所占所有细胞百分比,计算细胞转染效率,转染效率=视野可见的绿色荧光细胞数/总细胞数×100%(有绿色荧光表明转染上shRNA-Slfn5)。
2 结 果
2.1 目的穿梭质粒的鉴定
2.1.1菌落 PCR鉴定阳性克隆
在大肠杆菌DH5α中构建重组腺病毒质粒,用菌落PCR鉴定5组干扰质粒,每组选取8个转化子,观察到正确的克隆大约为332 bp 的特定条带,表明5个克隆是正确的(图1)。
2.1.2测序鉴定重组穿梭质粒
测序结果显示shRNA-Slfn5(1)、shRNA-Slfn5(2)、shRNA-Slfn5(3)、shRNA-Slfn5(4)、shRNA-Slfn5(5)、shRNA-Slfn5(NC)重组质粒中插入的序列与预期符合(图2),表明目的穿梭质粒构建成功。
2.2 重组腺病毒的包装及扩增
选取测序正确的shRNA-Slfn5 (5) 同源重组腺病毒基因组质粒转染入HEK293细胞,2 d后,在光学显微镜下观察到斑块形成、细胞变圆、肿胀和壁上裂开及其他损伤,HEK293A细胞出现绿色荧光蛋白的表达,并且随着培养时间的延长表达增加;随着时间增加,GFP的表达量愈多并且大多数细胞似乎表现出细胞病变效应,如肿胀、圆形、葡萄状,一些细胞漂浮;第 15 天时,HEK293 细胞大量死亡和损伤,收集毒液。病毒上清液用于第2次转染HEK293A细胞,病毒扩增。见图3。
2.3 重组腺病毒的滴度
测定腺病毒滴度为3.95×1010PFU/mL。
2.4 干扰质粒转染 293T 细胞的干扰效率
Slfn5的过表达腺病毒质粒与靶点质粒共转染293T细胞 48 h 后,shRNA-Slfn5(1)、shRNA-Slfn5(4)、shRNA-Slfn5(5)均可明显抑制 Flag蛋白的表达,而 shRNA-Slfn5(2)和shRNA-Slfn5(3)无明显干扰作用(图4) 。因此,确定shRNA-Slfn5(1)、shRNA-Slfn5(4)、shRNA-Slfn5(5)为目的质粒。

1:marker,从上到下方向依次为2 000,1 000,750,500,250,100;2~9:挑取的8个转化子。

A:shRNA-Slfn5(1);B:shRNA-Slfn5(2);C:shRNA-Slfn5(3);D:shRNA-Slfn5(4);E:shRNA-Slfn5(5);F:shRNA-Slfn5(NC)。

1A、1B:转染2 d HEK293细胞;2A、2B:转染8 d HEK293细胞;3A、3B:转染15 d HEK293细胞。
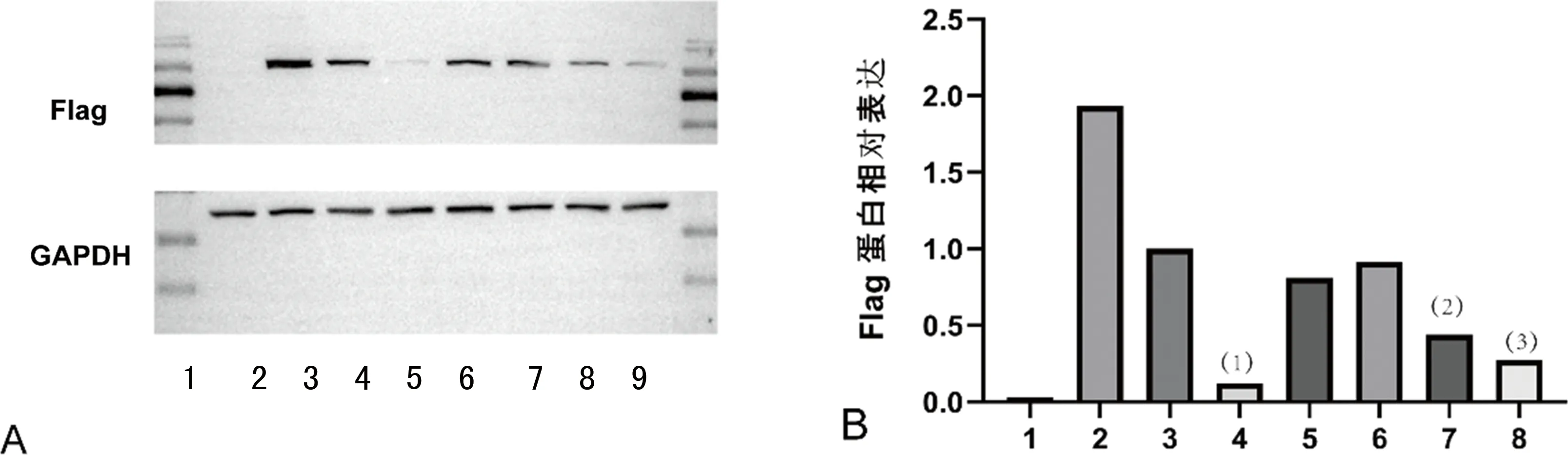
A:Western blot 蛋白条带[1:marker;2:293T细胞;3:过表达质粒;4:shRNA-Slfn5(NC);5:shRNA-Slfn5(1):6:shRNA-Slfn5(2);7:shRNA-Slfn5(3);8:shRNA-Slfn5(4);9:shRNA-Slfn5(5)];B:8个对照组灰度分析[1:293T细胞;2:过表达质粒;3:shRNA-Slfn5(NC);4:shRNA-Slfn5(1):5:shRNA-Slfn5(2);6:shRNA-Slfn5(3);7:shRNA-Slfn5(4);8:shRNA-Slfn5(5);(1)、(2)、(3)与对照组比较,P<0.05]。

A:通过流式分析EPCs中内皮细胞标志物、干细胞标志物的表达;B:在培养4~7 d后,分离的脾来源EPCs显示出纺锤形形态;C:细胞核用DAPI(蓝色)染色;D:细胞用DiI-AC-LDL标记呈红色;E:FITC-UEA-I标记呈绿色;F:C、D、E三者的叠加。
2.5 EPCs鉴定与转染效率
大多数细胞[(93.00±2.53)%]对DiI-ac-LDL和FITC-UEA-I均呈阳性,鉴定为EPCs。此外,CD31、CD34、CD45、KDR、CD133阳性细胞的占比分别为(99.70±3.84)%、(83.90±2.65)%、(0.80±2.82)%、(97.40±2.76)%、(81.60±2.84)%,见图5。当EPCs用重组腺病毒转染48 h时,在荧光显微镜下观察到细胞中有强绿色荧光效应的为转染上shRNA-Slfn5的EPCs,转染效率为(85.64±2.58)%,见图6。

A:转染48 h后白光下EPCs;B:转染48 h后EPCs绿色荧光的表达情况。
3 讨 论
血管内皮损伤导致动脉粥样硬化性血管疾病的发生和发展,并可能导致新内膜增生,支架内再狭窄和急性支架血栓形成[8]。因此,血管内皮的再生非常重要。由于ECs的增殖能力低,在血管修复过程中,ECs增殖替代受损内皮的能力受到限制。研究发现,EPCs在维持内皮完整性方面起着至关重要的作用。当血管内皮发生损伤时,EPCs被动员并到达损伤部位,分化为EC参与新血管形成和组织修复[9-12]。Slfn5蛋白及该家族的其他成员的功能仍然很大程度上未知。Slfn5核定位倾向于支持某些转录调控作用,但尚未完全确定[13]。Slfn5可影响多种细胞的生物学行为,但在不同的细胞中,其作用不同:通过在NIH 3T3成纤维细胞中过表达Slfn5基因,发现成纤维细胞的生长并未受到影响[14];通过基因干扰的方法敲低Slfn5的表达,人类恶性黑色素瘤细胞结果显示其有双重的作用,不仅促进恶性黑色素瘤细胞的不依赖支持物的生长和克隆形成能力,而且还增强该细胞在三维胶原中的侵袭能力[15]。
本课题组前期研究显示Slfn1可调控EPCs的生物学行为[12]。然而,尚不清楚作为同一基因家族的Slfn5是否也与EPCs的生物功能有关联。RNA干扰技术可以用于转录后基因沉默,具有严格的序列特异性、高效性和高稳定性,是疾病基因治疗的理想工具。这种方法已被广泛研究,并已发展成为研究基因功能和肿瘤基因治疗的重要工具[16]。重组腺病毒在体外和体内转染都是高效的,对于广泛的感染细胞,它可以感染静止细胞和有丝分裂细胞,并且它不整合到宿主细胞基因组中。因此,该腺病毒在基因工程和基因治疗中具有广泛的应用潜力[17]。本研究选择shRNA-Slfn5(5)作为目的基因片段,pDKD-CMV-eGFP-U6-shRNA作为干扰载体,成功地将shRNA-Slfn5基因片段插入到重组腺病毒载体中,构建了shRNA-Slfn5重组腺病毒,并将其包装到HEK293A细胞中。荧光检测和扩增实验表明,shRNA-Slfn5型腺病毒载体构建成功,并通过转染到EPCs内。本研究发现该重组腺病毒能成功感染EPCs,转染效率为(85.64±2.58)%,转染效率较满意,为进一步应用腺病毒表达抑制Slfn5研究对EPCs生物功能的影响奠定了基础。
