新生乳鼠侧脑室注射rAAV2/9 递送SNCA 构建全脑转基因鼠
2021-05-18李国祥潘玥胡鹏杜廷福马开利
李国祥潘 玥胡 鹏杜廷福马开利*
(1.中国医学科学院&北京协和医学院医学生物学研究所 药物安全性评价研究中心,昆明 650118;2.中国医学科学院&北京协和医学院 医学灵长类研究中心&神经科学中心,北京 100005)
帕金森病(Parkinson,s disease,PD)是第二大常见神经系统退行性疾病,其主要特征是中脑黑质多巴胺能神经元的死亡及α-突触核蛋白的聚集[1]。然而,α-突触核蛋白在PD 中确切的功能尚未完全研究清楚。 动物模型无疑是研究蛋白质功能及PD发病机理的一个重要工具,目前迫切地需要一些动物模型去探究α-突触核蛋白确切的生理功能及进行药物研发的评估。 尽管已经开发出许多模型,如毒素模型和转基因动物模型,部分能表现出黑质及纹状体多巴胺能神经元减少或多巴胺(dopamine,DA)水平降低以及行为障碍[2-6],表明α-突触核蛋白的积累可以显著影响DA 能神经元的功能,但在大多数小鼠中都没有发现明显的黑质及纹状体变性[7-9],不能完美地再现PD 的病理特征[10],给PD的研究带来了困扰。
在最近的研究中,有学者尝试用rAAV 在成年鼠中以脑立体定位注射的方式构建α-突触核蛋白局部过表达动物模型,能初步重现PD 的原发性运动障碍及部分多巴胺能神经元损伤[11-14],表明rAAV 可以作为一种快速靶向的动物模型建立的工具,然而靶向和局部α-突触核蛋白过表达有一定的局限性,局部注射的rAAV 只在部分脑区传导表达,而PD 的发生发展可能由多个脑区的共同参与。 最近研究表明,可以通过向胎鼠或乳鼠脑室内注射rAAV 来实现整个中枢神经系统的基因表达[15-18],与成年鼠注射病毒相比,这种方法可实现更有效的扩散和感染,且表达在注射后数天内开始,并持续于动物的整个生命周期[19-21]。 且有报道称rAAV2/9 能跨越血脑屏障,表现出在中枢神经系统广泛传导的能力[22],并能感染新生神经元[21,23]。 此外,人源SNCA(hSNCA)转基因小鼠模型已经被广泛应用和认可,人源α-突触核蛋白在小鼠中并不会引起强烈的免疫排斥反应而被清除,可长期表达存在[5-6,24]。 因此,本文旨在通过对新生乳鼠ICV 注射携带人源的SNCA-EGFP基因或EGFP的rAAV2/9,快速高效地构建脑中广泛表达α-突触核蛋白的转基因模型,并初步探究α-突触核蛋白过表达对小鼠脑的影响。
1 材料和方法
1.1 实验动物
SPF 级C57BL/6 小鼠30 只,8 周龄,体重20 ~22 g,雌雄2 ∶1,由中国医学科学院医学生物学研究所小动物部提供[SCXK(滇)K2019-0002]。 动物饲养在中国医学科学院医学生物学研究所药物安全性评价研究中心20℃~24℃的屏障环境中[SYXK(滇)K2018-0006],自由进水和进食,采用昼夜12 h 间断照明。 在实验前以雌雄2 ∶1的比例合笼,见栓后把母鼠分离单独饲养。 给予充足的食物和水源,在母鼠妊娠后第1 天(postnatal day,P0)进行病毒注射并标记后继续给予充足的食物和水源饲养。 实验经本单位伦理委员会审核批准(DWSP202012008),实验过程按实验动物使用的3R 原则给予动物人道关怀。
1.2 主要试剂与仪器
无内毒素质粒小提取试剂盒( 货号:CW2106S)、BCA 蛋白定量试剂盒(货号:CW0014S)购自康为科技有限公司;只与人源α-突触核蛋白反应的兔多克隆抗体α-synuclein(MJFR1) (货号:ab138501)、NeuN 鼠单克隆抗体(货号:ab104224)、DAPI(货号:ab104139)购自英国abcam;GFAP 鼠单克隆抗体(货号:Cat# G3893)及固绿(货号:F7252)购自美国Sigma;Iba 1 兔多克隆抗体(货号:016-20001)购自日本wako;抗聚集性α-synuclein(5G4)单克隆抗体(货号:MABN389)购自美国Merck;鼠α-synuclein 单克隆抗体(货号:610786)购自美国BD;兔来源TH 多克隆抗体(货号:PA5-85167)购自美国Invitrogen;GAPDH 单克隆抗体(货号:60004-1)购自美国Proteintech;594 波长免疫荧光兔二抗(货号:A11012)及488 波长鼠二抗(货号:A11001)购自美国Invitrogen;Western blot 兔源荧光二抗(货号:926-32211)及鼠源荧光二抗(货号:926-32210)购自 美 国 Li-cor; 免 疫 组 化 试 剂 盒( 货 号:GK5000705)购自上海基因科技;微量注射器购自瑞士Hamilton。
1.3 实验方法
1.3.1 质粒构建及病毒包装
pAAV-hSyn-EGFP、 pAAV-hSyn-SNCA-PGK-EGFP质粒由本实验室构建和保存。 两种质粒在大肠杆菌中扩增后用质粒小提试剂盒提取质粒DNA 并鉴定。 携带人源SNCA-EGFP及EGFP的重组腺相关病毒rAAV2/9 由泰尔图公司包装并纯化,其病毒滴度约为1.5×1013GC/mL,冻存在-80℃冰箱中待用。
1.3.2 新生乳鼠侧脑室注射
在注射前把注射针头、镊子和剪刀高压灭菌。取1.5 μL 病毒与0.5 μL 的固绿混合,充分混匀并置于冰上,固绿用于标记注射位点。 出生后第1 天(P0)的乳鼠与母鼠分离,置于冰上2~3 min 充分麻醉,用5 μL Hamilton 微量注射器注射小鼠侧脑室,进针深度为3 mm,注射速度约为1 μL/min,每侧注射1 μL,注射后留针1 min。 注射结束时擦拭75%乙醇并标记后放入笼中继续饲养2 周或3 个月进行解剖检测。
1.3.3 Western blot
处死小鼠取脑并分离各个脑区置于冰冷的EP管中,加入适量的RIPA 裂解后,取上清用BCA 试剂盒进行蛋白定量,之后加5×上样缓冲液进行煮沸5 min 待用。 配置SDS-PAGE 胶,上样,85 V 电压跑胶120 min 后,用半干转仪进行转膜,5%脱脂牛奶室温封闭45 min 后,抗体孵育4℃过夜,TBS 洗膜5min×3 次后,用羊抗鼠或抗兔的Western blot 荧光二抗室温孵育1 h,TBST 洗膜3 次后,Odyssey 红外激光扫描系统进行显影拍照。
1.3.4 免疫荧光
用多聚甲醛对2 周或3 个月的rAAV2/9 ICV 注射小鼠进行灌注,取脑后用多聚甲醛固定24 ~36 h,脱水机脱水处理,包埋后切片厚度为4 μm。 切好的片子65℃孵箱烤片,常规脱蜡水化,蒸馏水冲洗,PBS 浸泡5 min,Tris-EDTA 缓冲液微波炉煮沸进行抗原修复15 min,蒸馏水浸泡5 min,正常山羊血清室温封闭1 h 后,滴加相应稀释好的一抗4℃过夜,PBS 洗5 min×3 次,后滴加鼠或者兔来源的荧光二抗,DAPI 封片后用Panoramic MIDI 获取图片。
1.3.5 免疫组化
多聚甲醛对2 周或3 个月的rAAV2/9 ICV 注射小鼠进行灌注,取脑后用甲醛固定24 ~36 h,脱水机脱水处理,包埋后切片厚度为4 μm。 切好的片子65℃孵箱烤片,常规脱蜡水化,蒸馏水冲洗,PBS 浸泡5 min,用Tris-EDTA 缓冲液微波炉煮沸进行抗原修复15 min,蒸馏水浸泡5 min,3%过氧化氢孵育30min 去除内源性过氧化氢酶,正常山羊血清室温封闭1 h 后,滴加抗α-synuclein(MJFR1)兔多克隆抗体及Iba 1 兔多克隆抗体,4℃过夜。 PBS 洗5 min×3 次,滴加辣根过氧化物酶标记的二抗,室温孵育1.5 h,PBS 洗5 min×3 次,新鲜配置的DAB 显色液。苏木素复染3 min,盐酸乙醇脱色,氨水返蓝,梯度乙醇及二甲苯脱水,树胶封片,用Panoramic MIDI 获取图片。
2 结果
2.1 新生乳鼠侧脑室rAAV2/9 注射构建hSNCA转基因模型
为了高效构建一种hSNCA转基因鼠模型,我们按照如图1A 上所示方法对新生乳鼠侧脑室注射rAAV2/9。 在注射后,病毒扩散到各个脑室中(图1 A 下),表明注射位点是准确的。 两周后,用只与人源α-突触核蛋白反应的Anti-α-synuclein(MJFR1)抗体进行免疫荧光染色检测α-突触核蛋白在整个脑区的表达水平。 结果如图1B 所示,在对照组AAV-EGFP 中,未出现α-突触核蛋白阳性染色,表明抗体的特异性良好,不会与鼠源α-突触核蛋白发生交叉反应,而在实验组AAV-SNCA 中,检测到α-突触核蛋白广泛表达在转基因鼠的各个脑区。 为了验证这个结果,采用Western blot 分别检测2 周(图1C)及3 个月(图1D)年龄的鼠嗅球(olfactory bulb, OB)、 皮 层(cerebral cortex, CTX)、 海 马(hippocampus, hip)、 间 脑(interbrain, IB), 中 脑(middle brain,Mid),小脑(cerebellum,CB),后脑(hindbrain,HB)中α-突触核蛋白的表达,结果显示α-突触核蛋白在各个脑区中均表达,其中在小脑中表达量稍低,与免疫荧光结果一致。 这些结果表明转基因鼠构建成功,且α-突触核蛋白广泛持久地表达(2 周~3 个月),人源α-突触核蛋白并未发生强烈的免疫排斥反应而被清除。
2.2 ICV 注射rAAV2/9 后α-突触核蛋白在全脑广泛表达
为了进一步探究转基因鼠中α-突触核蛋白的表达模式,用α-突触核蛋白特异性抗体的免疫组织化学染色检测2 周龄鼠嗅球(olfactory bulb,OB)、皮层(cerebral cortex,CTX)、海马(hippocampus,Hip)、间脑(interbrain,IB)、中脑(middle brain,Mid)和小脑(cerebellum,CB)中α-突触核蛋白的表达。 结果显示,α-突触核蛋白在嗅球中高表达(图2A),少部分分布在胞核中。 在大脑皮层处(图2B),α-突触核蛋白高表达并主要分布在胞质中,而在海马的CA2/3 区(图2C),α-突触核蛋白广泛分布在颗粒细胞层的胞质及胞核中。 在间脑中(图2D),α-突触核蛋白广泛分布在丘脑及下丘脑中。 在中脑(图2E)中,α-突触核蛋白亦高表达,并主要在胞质中。 有趣的是,α-突触核蛋白特异性地表达在小脑的浦肯野细胞中(图2F)。
2.3 ICV 注射rAAV2/9 后α-突触核蛋白的表达定位
蛋白质的表达定位往往与其特定的功能相关,我们通过免疫荧光检测2 周龄鼠中人源α-突触核蛋白的亚细胞定位。 结果显示,在多巴胺能神经元(TH+神经元)中,α-突触核蛋白高表达,且其主要表达于神经元胞质中(图3A)。 在其它脑区,如图3B所示,嗅球及皮层中有少部分α-突触核蛋白表达在胞核中,而在海马的CA2/3 区,少数颗粒细胞的胞核中出现α-突触核蛋白核定位的现象,在小脑处,α-突触核蛋白在浦肯野细胞核中高表达,其结果与图2F 一致。
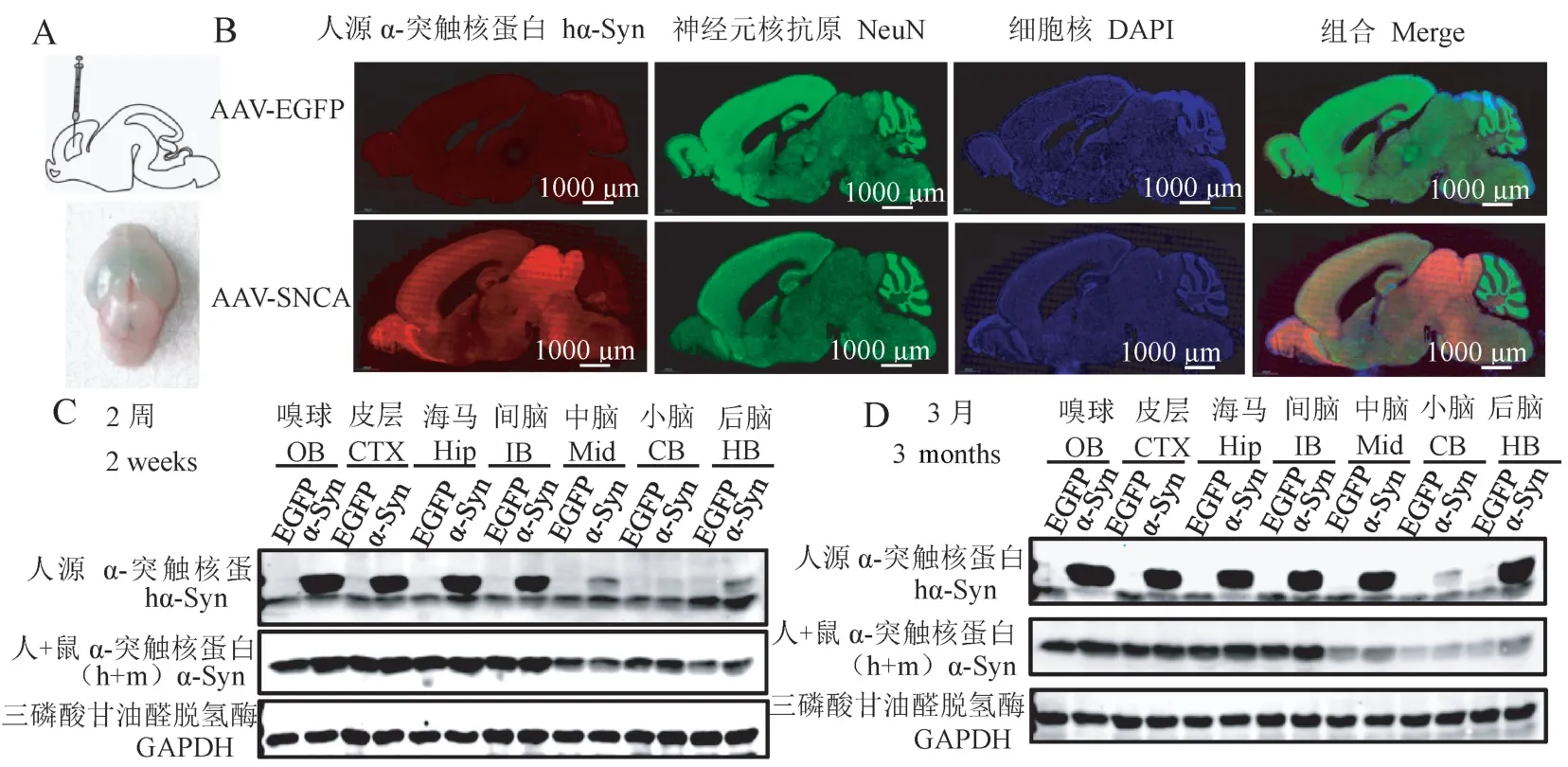
注:A:新生乳鼠注射方式模式图;B:2 周龄鼠α-突触核蛋白的免疫荧光染色;C:Western blot 检测2 周龄鼠脑中人源及总的α-突触核蛋白(人+鼠)在对照及转基因小鼠各个脑区的表达;D:Western blot 检测3 月龄鼠脑中人源及总的α-突触核蛋白(人+鼠)在对照及转基因小鼠各个脑区的表达。 GAPDH 作为内参。图1 SNCA 转基因鼠的构建Note. A, Cartoon describes the surgical approach for ICV injection in neonatal mouse brains. B, Immunofluorescence stain reveals the expression of αsynuclein in the whole brain at 2 weeks. C,Level of human and total α-synuclein expression in the transgene was assessed by Western blot at 2 weeks.D, Level of human and total α-synuclein expression in the transgene were assessed by Western blot at 3 months. GAPDH was used as an internal control.Figure 1 Construction of SNCA transgenic mice
2.4 ICV 注射rAAV2/9 后诱导胶质细胞增生
大量的研究表明PD 的发生可能与神经炎症密切相关。 于是,通过免疫荧光检测3 月龄转基因鼠脑中星形胶质细胞的数量(GFAP+细胞),如图4A所示,在黑质(Substantia nigra,SN)中,α-突触核蛋白广泛表达的区域出现星形胶质增生的现象,而在海马中(图4B)得到了同样的结果,GFAP+胶质细胞也显著地增生。 此外,免疫组化染色检测的小胶质细胞在海马(图4C)及皮层(图4D)也显著增生。
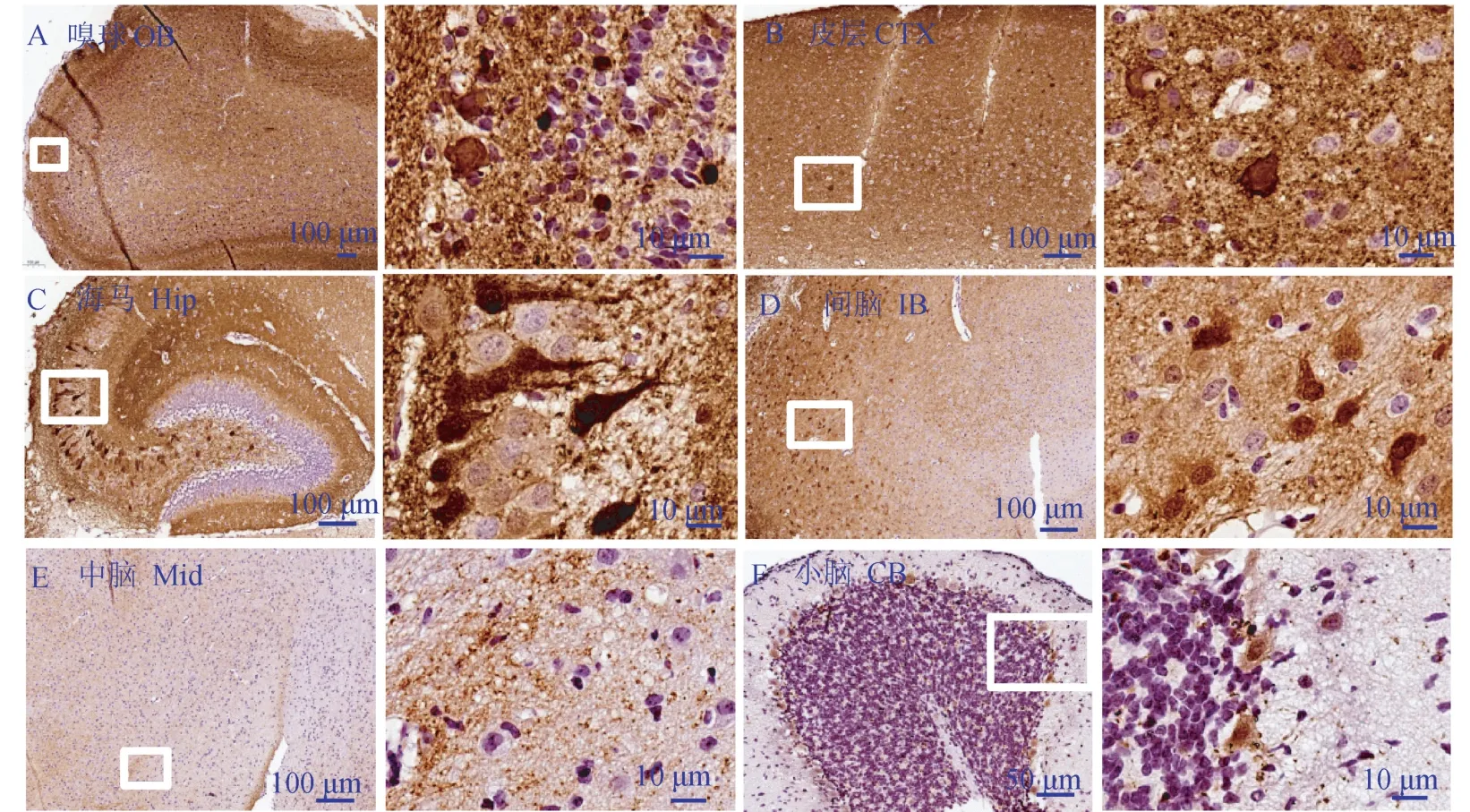
注:免疫组化分析2 周龄鼠人源α-突触核蛋白在各个脑区中的表达。 A:嗅球(OB);B:皮层(CTX);C:海马(Hip);D:间脑(IB);E:中脑(Mid);F:小脑(CB)。 后图为局部放大图。图2 转基因鼠中α-突触核蛋白在各个脑区中广泛表达Note. Level and distribution of human α-synuclein expression were evaluated histologically. A, Olfactory bulb(OB). B, Cerebral cortex(CTX). C,Hippocampus(Hip). D, Interbrain(IB). E, Middle brain(Mid). F, CB Cerebellum(CB). A partial enlarged view is attached after the figure.Figure 2 Widespread α-synuclein expression of the transgene throughout the mice brain
2.5 ICV 注射rAAV2/9 后出现病理性α-突触核蛋白
在PD 中,第129 位丝氨酸磷酸化(pS129)及聚集形式的α-突触核蛋白常被检测到,被认为是PD的标志之一。 在转基因鼠中,我们通过免疫组化检测表明,pS129 在3 月龄小鼠嗅球及皮层中(图5A)均出现,且在嗅球的神经元中强阳性染色。 进一步用抗聚集形式的α-突触核蛋白单克隆抗体(αsynuclein 5G4)检测其表达时(图5B),发现其在嗅球和皮层亦出现阳性染色,表达模式与pS129 一致。
3 讨论
rAAV 的研究及广泛应用,为我们高效地基因传递提供了非常快速有效的工具,先前多项研究通过靶向小鼠黑质、纹状体及嗅球构建α-突触核蛋白局部过表达小鼠模型,极大地促进人们对PD 发病机理的认识,然而由于靶向定点脑区注射后蛋白质过表达的区域局限性,所以在该研究中,基于rAAV2/9 在神经系统中的高效的传递效率[21-22],我们通过新生乳鼠侧脑室注射携带人源SNCA-EGFP或EGFP的rAAV2/9,构建了全脑人源α-突触核蛋白高表达的转基因鼠。 在注射rAAV2/9 后立即解剖乳鼠脑,发现固绿染色的病毒液在大脑各脑室之间扩散,表明注射位点的准确性。 前期的研究表明注射的时间点影响注射效率[15],于是在本实验中严格控制注射时间在出生后12 个小时之内。
在小鼠成长到2 周或3 个月后,用免疫荧光和Western blot 实验检测到了2 周及3 个月龄α-突触核蛋白在全脑中广泛的表达(图1 所示),这表明通过乳鼠侧脑室注射的方式在注射后早期α-突触核蛋白便能高表达,提示可以用此模型探究α-突触核蛋白在小鼠出生后脑发育过程中的作用。 此外,Western blot、免疫荧光及免疫组化实验表明,α-突触核蛋白趋向于在小鼠嗅球、皮层、海马、间脑及中脑中高表达,而在小脑中表达量稍低,这可能与病毒感染的细胞偏好性或者α-突触核蛋白表达的细胞偏好性有关,其具体的机理仍然需要进一步研究。此外,进一步通过免疫荧光探究α-突触核蛋白的亚细胞定位,发现在嗅球、皮层、海马及小脑中,α-突触核蛋白有胞核定位的现象,而之前的研究结果表明,α-突触核蛋白核易位与细胞毒性相关[25-26],提示这几个脑区的α-突触核蛋白可能产生细胞毒性。有趣的是,α-突触核蛋白在小脑浦肯野细胞中高表达,这提示α-突触核蛋白可能在小鼠的浦肯野细胞中发挥特定未知的功能。 免疫荧光结果表明,α-突触核蛋白在多巴胺能神经元中高表达,这为之后研究α-突触核蛋白参与PD 发生的机理奠定基础。
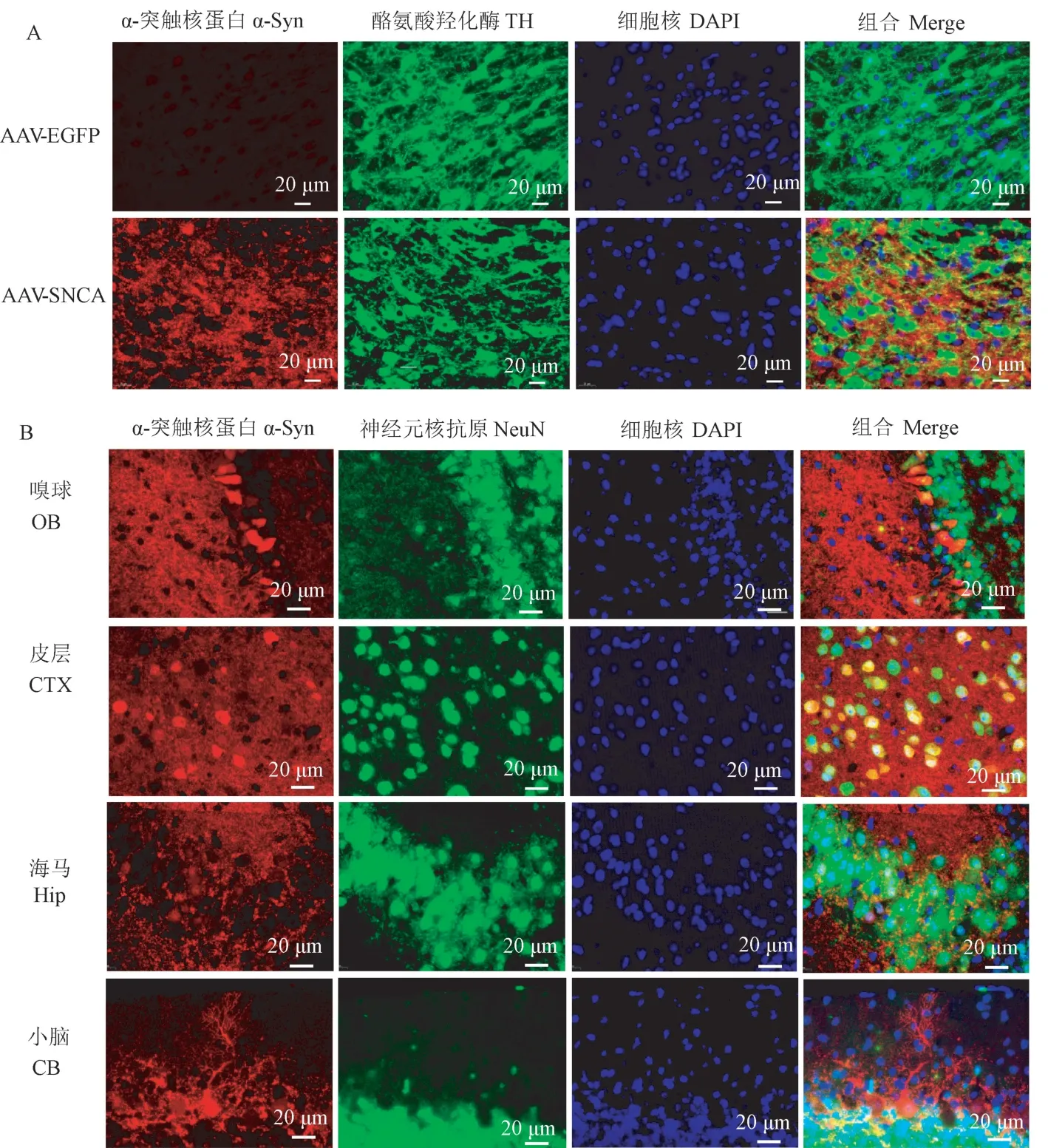
注:A:α-突触核蛋白在中脑黑质(SN)中表达,TH:多巴胺能神经元标志物;B:α-突触核蛋白在各脑区的表达及定位。图3 α-突触核蛋白在转基因鼠中的表达及亚细胞定位Note. A, α-synuclein is expression in the Substantia Nigra(SN). TH, The marker of dopaminergic neuron. B, Expression and subcellular localization of α-synuclein in different brain regions.Figure 3 Expression and subcellular localization of α-synuclein throughout the whole mice brain
之前的研究认为,星形胶质细胞及小胶质细胞参与的神经炎症与PD 的发生发展密切相关[27-28],于是我们检测转基因小鼠中星形胶质细胞及小胶质细胞的变化,有趣的是,在转基因小鼠中星形胶质细胞及小胶质细胞严重增生,这进一步提示α-突触核蛋白诱导的神经炎症可能参与到PD 的发生发展中。 最重要的是,在PD 患者的尸脑组织中,常检测到α-突触核蛋白pS129 及聚集的现象[29-31],而在通过rAAV2/9 构建的转基因鼠的嗅球及皮层中均检测到pS129 及聚集的现象,且在嗅球处高表达,这提示嗅球及皮层与PD 的发生发展密切相关。
总之,我们成功用携带人源SNCA的rAAV2/9构建了α-突触核蛋白的全脑转基因鼠,α-突触核蛋白在整个脑中广泛表达,并出现了胶质增生及病理性α-突触核蛋白表达的现象。 该转基因模型的成功建立,将为探究α-突触核蛋白的生理作用及其在PD 中的作用提供一定的基础。
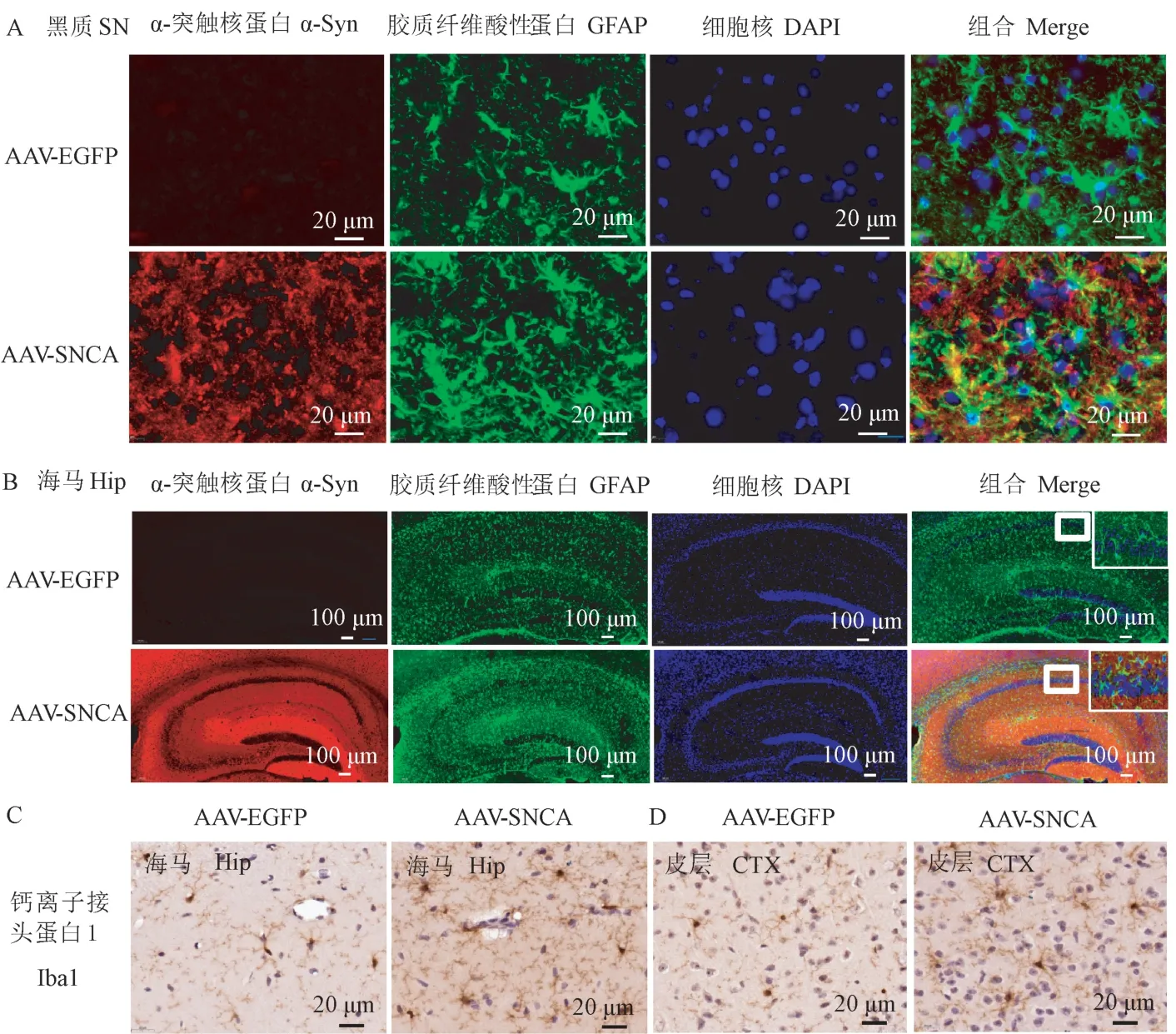
注:A:过表达α-突触核蛋白引起黑质(SN)的星形胶质细胞增生;B:过表达α-突触核蛋白引起海马(Hip)的星形胶质细胞增生;C:过表达α-突触核蛋白引起海马(Hip)的小胶质细胞增生;D:过表达α-突触核蛋白引起皮层(CTX)的小胶质细胞增生。GFAP:星形胶质细胞标志物;Iba 1:小胶质细胞标志物。图4 α-突触核蛋白过表达引起胶质细胞增生Note. A, Overexpression of α-synuclein incraese astrogliosis in Substantia nigra. B, Overexpression of α-synuclein incraese astrogliosis in Hippocampus. C, Overexpression of α-synuclein incraese microgliosis in Hippocampus. D, Overexpression of α-synuclein incraese microgliosis in Cerebral cortex. GFAP, The marker of astrocyte. Iba 1, The marker of microglia.Figure 4 Overexpression of α-synuclein associated with astrogliosis and microgliosis
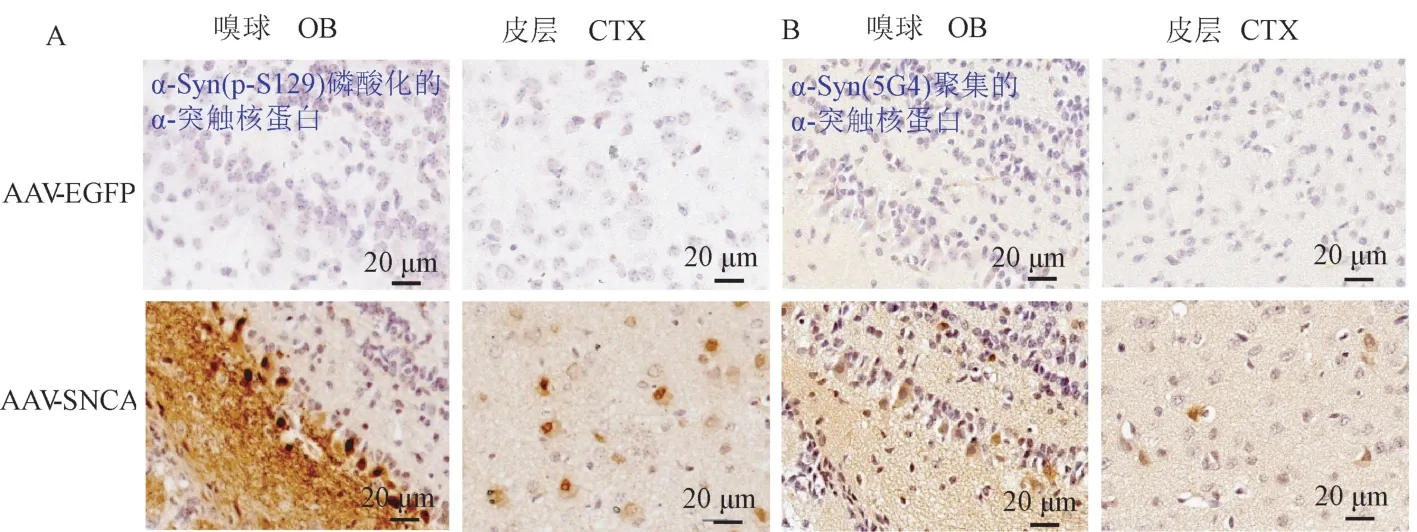
注:A:免疫组化检测嗅球(OB)和皮层(CTX)中α-突触核蛋白pS129 的表达分布;B:免疫组化染色检测嗅球(OB)和皮层(CTX)中聚集形式的α-突触核蛋白的表达分布。图5 病理性的α-突触核蛋白的检测Note. A, pS129 was detected within the neuronal soma in the olfactory bulb(OB)and cerebral cortex(CTX). B, Aggregated α-synuclein was detected within the neuronal soma in the olfactory bulb(OB)and cerebral cortex(CTX).Figure 5 Detection of α-synuclein-associated pathology
