mmu-miR-672-5p 调控大鼠胎盘绒毛膜滋养层细胞凋亡的机制
2021-05-18琳周知马宁周
陈 琳周 知马 宁周 璟
(海南省妇女儿童医学中心生殖医学中心,海口 570206)
胎盘的形成对于哺乳动物怀孕至关重要,其形成需要对滋养细胞的精确调控[1]。 子宫内膜中的滋养层细胞经历母体蜕膜和子宫螺旋动脉的增殖,分化,凋亡和侵袭,从而参与血管重塑[2]。 滋养细胞功能异常与不良妊娠并发症密切相关,包括先兆子痫,其特征是出现高血压,蛋白尿和水肿,这将会严重损害孕产妇的健康和胎儿的成长[3]。 因此,滋养细胞功能的精确调节对于维持正常胎盘至关重要。 有证据表明胎盘miRNA 的异常表达与先兆子痫相关[4]。 miRNA 是小的非编码RNA,主要在转录后水平上对靶基因的表达产生负调控[5]。 miRNA在许多病理和生理过程(例如细胞生长和凋亡,器官发生和发育)中起重要作用[6]。 Pineles 等[7]发现子痫前期患者胎盘中miR-672-5p 表达异常。 但是miR-672-5p 的生理学功能仍然未知,其是否与细胞凋亡相关值得探索。 基于此,本研究使用大鼠胎盘绒毛膜滋养层细胞作为研究对象,旨在探讨mmumiR-672-5p 调控大鼠胎盘绒毛膜滋养层细胞凋亡的分子机制。
1 材料和方法
1.1 实验细胞
大鼠胎盘绒毛膜滋养层细胞购自procell(货号:CP-R182;批号:OI2HO3)。
1.2 主要试剂与仪器
Lipofectamine 3000 购自北京科博晟创生物科技有限公司(货号:L3000008;批号:367H-TCSE9P0);大鼠胎盘绒毛膜滋养层细胞完全培养基购自procell(货号:CM-R182;批号:ZDJH23);pmir-glo utr1 质粒购自广州基旦生物科技有限公司(货号:JD190929001M; 批 号: C6XHL7QALI); mmu-miR-672-5p inhibitor、mmu-miR-672-5p mimics 均购自北京 擎 科 合 成;Zfp229、Zfp503、Slc4a5、Stk24、Tmem106b、Bax、Adgrb3、Tmem63b、Pmp22、Mroh2a、Dsn1、Pramef25、Naaladl2、Clk2、Stx16、Usp28、Clint1、Jph4、Msl2、Krtap8-1、Pkp2、Mllt3、Rai14 的siRNA 均由吉凯基因合成;Bax 过表达质粒通过大鼠胎盘绒毛膜滋养层细胞的cDNA 克隆至pCDNA3.1 表达载体上。 逆转录试剂盒购自昆明皇宝商贸有限公司(货号:218161;批号:3YR6CWE7);2×SDS 蛋白电泳上样缓冲液购自武汉洁洋盛科技有限公司(货号:M337-5ML;批号:NH4KPG2DH6);双荧光素酶报告基因试剂盒购自武汉纯度生物科技有限公司(货号:CDLG-4997;批号:UJV93S3Z27);荧光定量PCR 试剂盒购自上海兢蔚生物科技有限公司(货号:BL705A;批号:1VG4GA2N);TRIzol 试剂购自四川爱奇生物科技有限公司(货号:15596-026;批号:MA6-WP6CZCW8);Bax、GAPDH、CLEAVED-CAS3的抗体购自abcam(货号:ab32503、ab9482、ab2302;批号:PNCER6SXJ5T58BC8、YN1J21A4YKBMXTO7、ODQ7K45DO3FMO7IC);二抗购自北京海科鸿创生物科技有限公司(货号:Y2011);ECL 化学发光系统ChemiDocTMXRS + 购 自 Bio-rad 公 司( 型 号:1708265);CFX96 Touch 荧光定量PCR 检测系统购自Bio-rad 公司(型号:1845096)。
1.3 实验方法
1.3.1 细胞培养与转染
使用大鼠胎盘绒毛膜滋养层细胞完全培养基在37°C,5% CO2的培养箱中培养大鼠胎盘绒毛膜滋养层细胞。 每2 d 更换一次培养基。 将转染试剂与 mmu-miR-672-5p inhibitor、 mmu-miR-672-5p mimics、Bax 质粒、siRNA(Zfp229、Zfp503、Slc4a5、Stk24、Tmem106b、Bax、Adgrb3、Tmem63b、Pmp22、Mroh2a、Dsn1、Pramef25、Naaladl2、Clk2、Stx16、Usp28、Clint1、Jph4、Msl2、Krtap8 - 1、Pkp2、Mllt3、Rai14)混合后在室温下孵育15 min 后,缓缓滴入大鼠胎盘绒毛膜滋养层细胞中。
1.3.2 免疫印迹
通过蛋白质印迹检测BAX 和CLEAVED-CAS3的丰度。 使用放射免疫沉淀测定(RIPA)缓冲液裂解细胞。 用SDS-PAGE 分离总蛋白(30 μg),然后转移到聚偏二氟乙烯膜上。 将膜与抗BAX(1 ∶1000稀释),抗CLEAVED-CAS3(1 ∶1000 稀 释) 或 抗GAPDH(1 ∶1000 稀释)在4°C 孵育过夜。 然后将膜用TBST 洗涤3 次,并与辣根过氧化物酶偶联的二抗(1 ∶5000 稀释)孵育1 h。 使用增强的化学发光(ECL)试剂可视化蛋白质丰度。
1.3.3 荧光素酶报告实验
将Bax 的3 端非编码区克隆至pmir-glo utr1 载体上,作为pmir-glo utr1-Bax-WT。 将Bax 的3’端非编码区做G→C 突变后,克隆至pmir-glo utr1 载体上,作为pmir-glo utr1-Bax-MT。 将大鼠胎盘绒毛膜滋养层细胞与pmir-glo utr1-Bax-MT(800 ng)、pmirglo utr1-Bax-WT(800 ng)、对照载体(800 ng)、TK Renilla 报告基因(8 ng)根据试剂盒说明,使用Lipofectamine 3000 进行转染。 转染48 h 后,裂解了总细胞蛋白,并使用双重荧光素酶测定系统检测了荧光素酶活性(萤火虫和海肾)。
1.3.4 Annexin-V 染色
经过不同处理后,收集在6 孔板上生长的漂浮大鼠胎盘绒毛膜滋养层细胞和胰蛋白酶分离的细胞,并用4℃预冷的1×PBS 洗涤。 然后将细胞沉淀物用结合缓冲液重悬,并根据试剂盒方案用Annexin-V 染色。 荧光显微镜观察。 将实验组中凋亡细胞的百分比与对照转染组进行比较。 所有样品一式三份测量。
1.3.5 RNA-Seq
分别敲低和过表达mmu-miR-672-5p 后,抽取大鼠胎盘绒毛膜滋养层细胞的总RNA。 RNA 样品被送到北京基因组研究所(中国深圳)进行商业性RNA-Seq 服务和数据分析。 使用SOAPaligner/SOAP2 不匹配,将干净的读段映射到mouse 数据库。 计算每个基因的纯净读数数,然后将其标准化为每百万分之一读数(kbKM),该读数将读数数与基因表达水平相关。 利用log2 比率来确定基因调控。 选择log2 比率为-1 或log2 比率为1 的免疫基因进行进一步分析。
1.3.6 RNA 抽取与实时荧光定量PCR
使用逆转录定量PCR 对mmu-miR-672-5p 和Bax 的mRNA 丰度进行定量。 根据生产商的说明,使用总RNA 分离试剂从大鼠胎盘绒毛膜滋养层细胞中分离总RNA。 使用Prime Script RT Master Mix在20 μL 反应中将1 μg 总RNA 反转录为cDNA。根据制造商的说明,使用cDNA 作为模板和StepOne Plus 进行定量PCR。 使用针对mmu-miR-672-5p 和Bax 设计的引物扩增10 μL 反应体积中的1 μL cDNA。 所有mRNA 反应的PCR 条件是:在95°C 初始变性30 s、在95°C 进行5 s、在62°C 进行30 s 和40 个循环。 扩增方案后进行熔解曲线分析。 将每个mRNA 的丰度相对于每个样品中的GAPDH 标准化。
1.4 统计学方法
所有统计分析均使用SPSS 软件20.0,数据以平均数±标准差(±s)表示。 采用单因素组间比较采用单因素方差分析,方差齐者采用LSD 法比较,方差不齐者采用Tamhane′T2 法比较,以P<0.05 为差异有统计学意义。
2 结果
2.1 mmu-miR-672-5p 抑制大鼠胎盘绒毛膜滋养层细胞凋亡
如图1 所示,转染mmu-miR-672-5p mimics 过表达mmu-miR-672-5p 后,发现大鼠胎盘绒毛膜滋养层细胞的凋亡水平下降(P<0.05);转染mmu-miR-672-5p inhibitor 敲低mmu-miR-672-5p 后,发现大鼠胎盘绒毛膜滋养层细胞的凋亡水平上升(P<0.05)。
2.2 mmu-miR-672-5p 在大鼠胎盘绒毛膜滋养层细胞调控多种基因表达
如图2 所示,分别敲低和过表达mmu-miR-672-5p 后,通过高通量测序发现大鼠胎盘绒毛膜滋养层细胞中多种基因的表达被调节,以mmu-miR-672-5p inhibitor/mmu-miR-672-5p mimics Ratio 等于2 为阈值,大于阈值的基因有23 个,分别为Zfp229、Zfp503、Slc4a5、Stk24、Tmem106b、Bax、Adgrb3、Tmem63b、Pmp22、Mroh2a、Dsn1、Pramef25、Naaladl2、Clk2、Stx16、Usp28、Clint1、Jph4、Msl2、Krtap8-1、Pkp2、Mllt3、Rai14。
2.3 Bax 促进大鼠胎盘绒毛膜滋养层细胞凋亡
通过siRNA 敲低上述23 个基因,发现当敲低Zfp229、Zfp503、Slc4a5、Stk24、Tmem106b、Bax、Adgrb3、Tmem63b、Pmp22、Mroh2a、Dsn1、Pramef25、Naaladl2、Clk2、Stx16、Usp28、Clint1、Jph4、Msl2、Krtap8-1、Pkp2、Mllt3、Rai14 时,大鼠胎盘绒毛膜滋养层细胞的凋亡水平差异无显著性(P>0.05);当敲低Bax 时,大鼠胎盘绒毛膜滋养层细胞的凋亡水平下降(P<0.05),见图3。 通过转染Bax 质粒过表达Bax,发现CLEAVED-CAS3 的表达水平上升(图4),大鼠胎盘绒毛膜滋养层细胞的凋亡水平上升(P<0.05)(图4)。
2.4 mmu-miR-672-5p 靶向Bax 的3 端非编码区
转染mmu-miR-672-5p mimics 过表达mmu-miR-672-5p 后,发现Bax 的mRNA 和蛋白水平均下降(P<0.05);转染mmu-miR-672-5p inhibitor 敲低mmumiR-672-5p 后,发现Bax 的mRNA 和蛋白水平均上升(P<0.05),见图5。 通过荧光素酶报告系统,发现mmu-miR-672-5p 靶向Bax 的3 端非编码区(P<0.05),见图5。
2.5 mmu-miR-672-5p/Bax 回补实验
同时过表达mmu-miR-672-5p 和Bax 后,发现大鼠胎盘绒毛膜滋养层细胞的凋亡水平无显著变化(P>0.05),见图6;同时敲低mmu-miR-672-5p 和Bax 后,发现大鼠胎盘绒毛膜滋养层细胞的凋亡水平无显著变化(P>0.05),见图6。
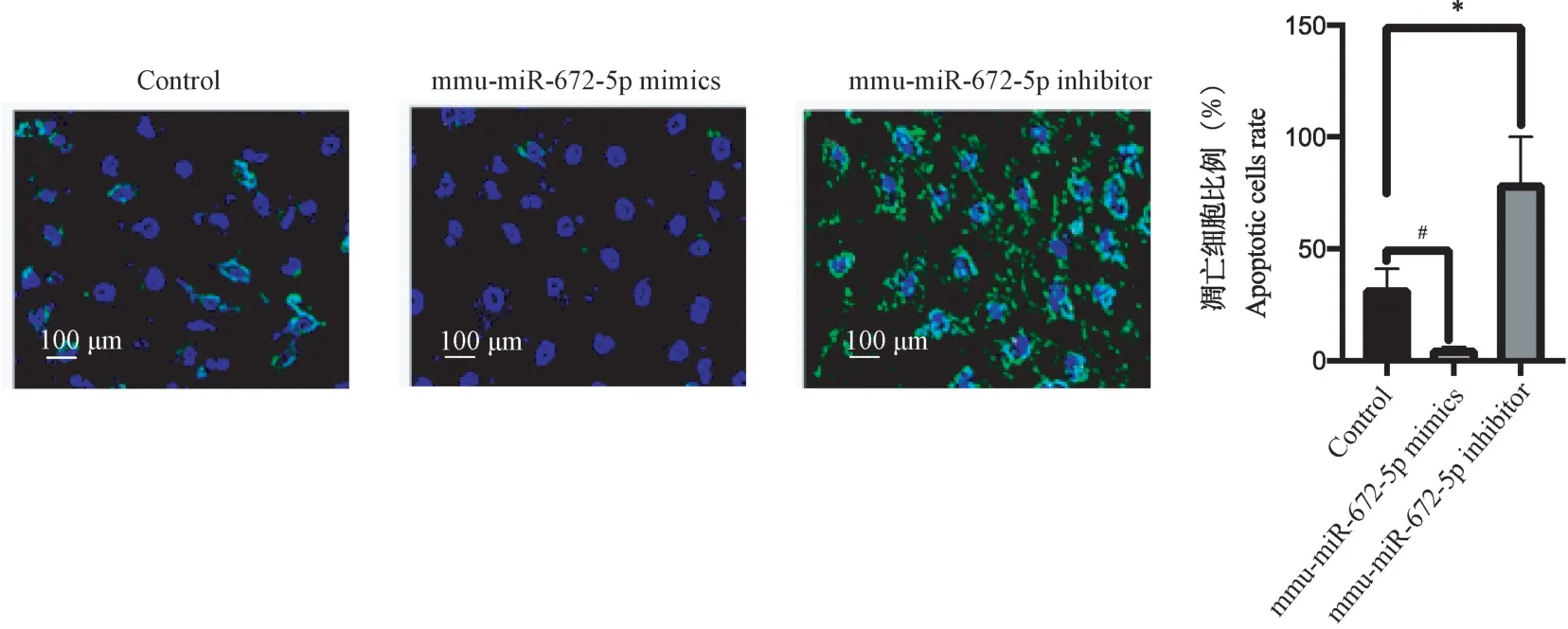
注:绿色染料:Annexin-V 阳性细胞的凋亡细胞;蓝色染料:dsDNA 阳性的细胞;mmu-miR-672-5p mimics 组与Control 组比较,#P<0.05;mmu-miR-672-5p inhibitor 组与Control 组比较,*P<0.05。图1 mmu-miR-672-5p 促进大鼠胎盘绒毛膜滋养层细胞凋亡Note. Green dye, Annexin-V positive apoptotic cells. Blue dye, dsDNA cells. Comparison between the mmu-miR-672-5p Mimics group and the control group, #P<0.05. Comparison of mmu-miR-672-5p inhibitor group and control group, *P<0.05.Figure 1 mmu-miR-672-5p promotes apoptosis of placental trophoblast cells in rats
3 讨论
本研究通过过表达或敲低mmu-miR-672-5p 体外培养的大鼠胎盘绒毛膜滋养层细胞,发现mmumiR-672-5p 抑制大鼠胎盘绒毛膜滋养层细胞凋亡。并通过RNA-seq 和RNAi 的方法发现mmu-miR-672-5p 靶向Bax 的3’端非编码区后,抑制了大鼠胎盘绒毛膜滋养层细胞凋亡。 本研究发现了大鼠胎盘绒毛膜滋养层细胞凋亡的新机制,为治疗子痫前期患者提供了理论基础。
子痫前期是一种主要针对孕妇的主要高血压疾病,是全球孕产妇发病的主要原因[8]。 它的特征是新发高血压,以及妊娠20 周后的蛋白尿[9]。 该病的原因可能与母亲、胎盘和/或胎儿相关,并且可能包括许多因素,例如免疫调节异常,内皮细胞损伤,遗传因素和营养因素[10]。 然而,没有任何一个因素可以令人满意地解释其原因和机制子痫前期。 一些研究报道[11],滋养层细胞凋亡发生在子痫前期中,并可能在疾病过程中起关键作用。 提示人体内mmu-miR-672-5p 的同源miR-672-5p 可能在子痫前期中表达失调,并且在子痫前期的发生发展中起重要作用,但这需要进一步的验证。 然而,miRNA 在子痫前期患者的滋养层细胞凋亡是否发挥主要的作用仍然值得进一步探究。
miRNA 是小的非编码RNA 分子(19 ~22 nt),参与靶标mRNA 的转录后调控[12]。 先前的研究表明[13],miRNA 与许多生物学和病理学过程密切相关,包括细胞增殖,凋亡,肿瘤发生,以及多种疾病。越来越多的证据表明[14],有许多miRNA 参与了子痫前期。 目前[15],已知至少有500 种不同的miRNA在胎盘滋养细胞中表达。 越来越多的证据表明[16],miRNA 在子痫前胎盘中表达异常,并与子痫前期密切相关。 在这项研究中,过表达mmu-miR-672-5p后,大鼠胎盘绒毛膜滋养层细胞的凋亡水平下降(P<0.05);敲低mmu-miR-672-5p 后,大鼠胎盘绒毛膜滋养层细胞的凋亡水平上升(P<0.05)。 Pineles等[7]发现子痫前期患者胎盘中miR-672-5p 表达异常。 因此,mmu-miR-672-5p 同源miRNA miR-672-5p 的异常表达可能是使子痫前期滋养层细胞凋亡的关键分子。 分别敲低和过表达mmu-miR-672-5p后,高通量测序发现大鼠胎盘绒毛膜滋养层细胞中多种基因的表达被调节,包括Zfp229、Zfp503、Slc4a5、Stk24、Tmem106b、Bax、Adgrb3、Tmem63b、Pmp22、Mroh2a、Dsn1、Pramef25、Naaladl2、Clk2、Stx16、Usp28、Clint1、Jph4、Msl2、Krtap8 - 1、Pkp2、Mllt3、Rai14。 敲低上述基因后,发现仅在敲低Bax时,大鼠胎盘绒毛膜滋养层细胞的凋亡水平下降(P<0.05)。 但是,除了Bax 基因,其他潜在受mmumiR-672-5p 调控的基因是否在子痫前期发生进展中发挥其他的作用仍值得进一步探究,包括细胞生长、器官发生和发育。 同时,本研究只选取了mmumiR-672-5p inhibitor/mmu-miR-672-5p mimics Ratio大于2 的基因来进行凋亡相关作用的研究,至于其他被Ratio 的基因是否在细胞凋亡中发挥作用值得进一步探讨。 此外,mmu-miR-672-5p 靶向Bax 的3端非编码区(P<0.05)。 过表达mmu-miR-672-5p后,Bax 的mRNA 和蛋白水平均下降(P<0.05);敲低mmu-miR-672-5p 后,Bax 的mRNA 和蛋白水平均上升(P<0.05)。 因此,mmu-miR-672-5p 通过与Bax的mRNA 形成双链RNA 后,Bax 的mRNA 被降解,随后Bax 蛋白的表达水平下降。

图2 mmu-miR-672-5p 在大鼠胎盘绒毛膜滋养层细胞调控多种基于表达Figure 2 Expression based regulation of mmu-miR-672-5p in rat placental chorionic trophoblasts
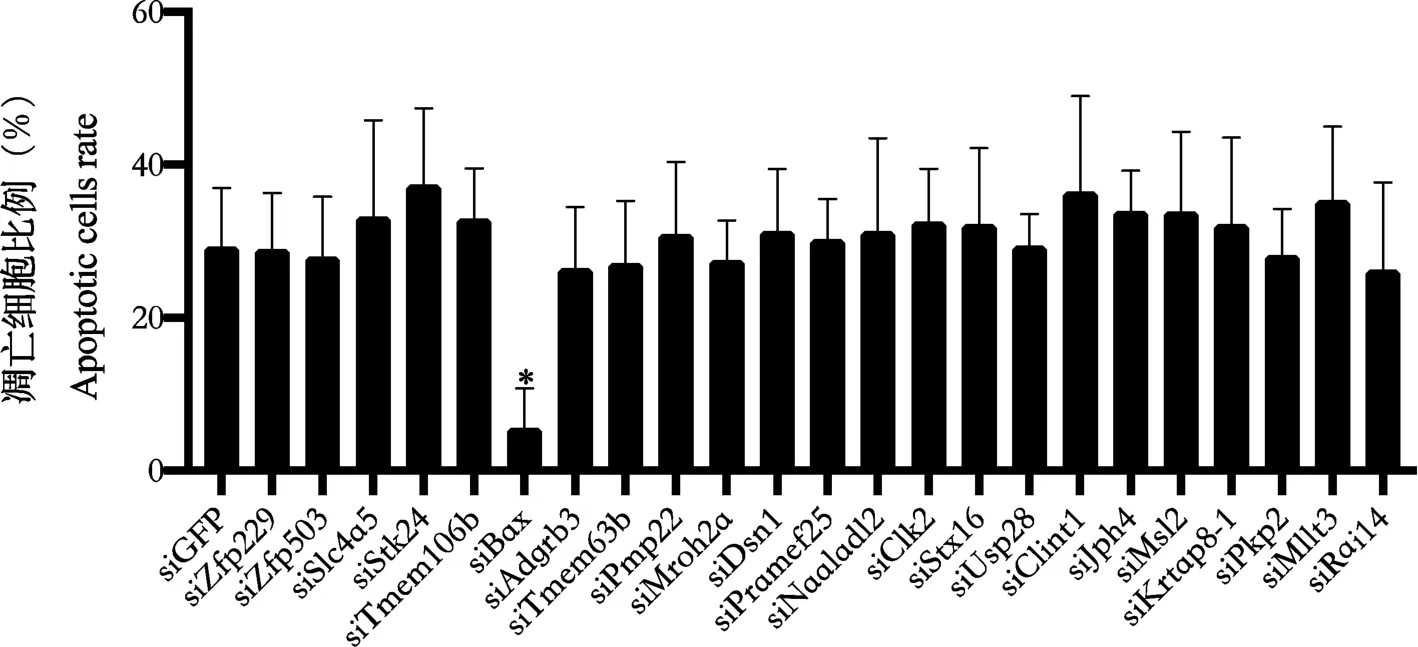
注:siBax 组与siGFP 比较,*P<0.05。图3 敲低相关基因后,大鼠胎盘绒毛膜滋养层细胞的凋亡水平Note. Comparison between siBax group and siGFP group, *P<0.05.Figure 3 apoptosis level of trophoblast cells in placenta of rats after knockdown of related genes
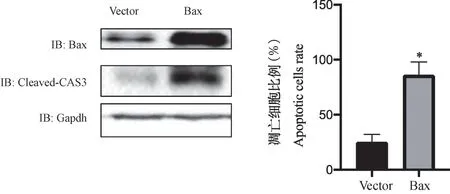
注:Bax 组与Vector 组比较,*P<0.05。图4 Bax 促进大鼠胎盘绒毛膜滋养层细胞凋亡Note. Comparison between Bax group and Vector group, *P<0.05.Figure 4 Bax promotes apoptosis of trophoblast cells in placenta of rats
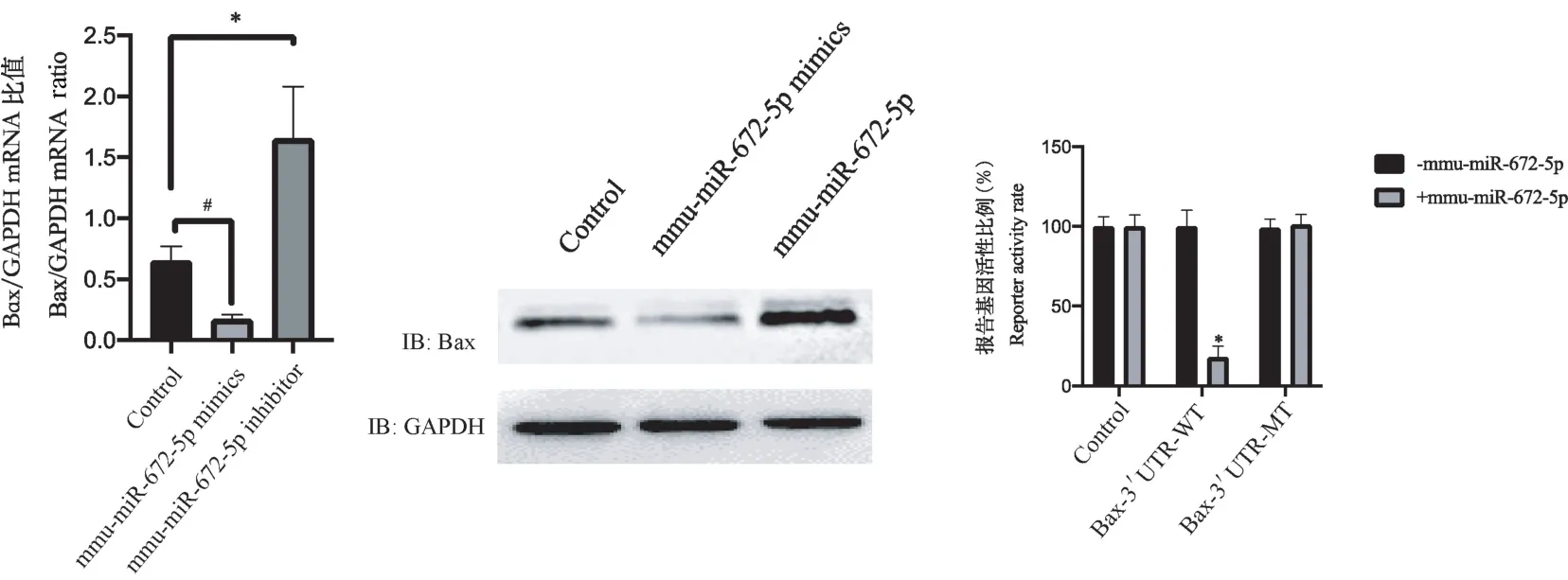
注:mmu-miR-672-5p mimics 组与control 组比较,#P<0.05;mmu-miR-672-5p inhibitor 组与control 组比较,*P<0.05;Bax-3’UTR-WT 组与control 组比较,*P<0.05。图5 mmu-miR-672-5p 靶向Bax 的3 端非编码区Note. Comparison between the mmu-miR-672-5p Mimics group and the control group, #P <0.05. Comparison between mmu-miR-672-5p inhibitor group and control group, *P<0.05. Comparison between Bax-3 ′UTR-WT group and control group, *P<0.05.Figure 5 3-terminal noncoding region of mmu-miR-672-5p targeting Bax
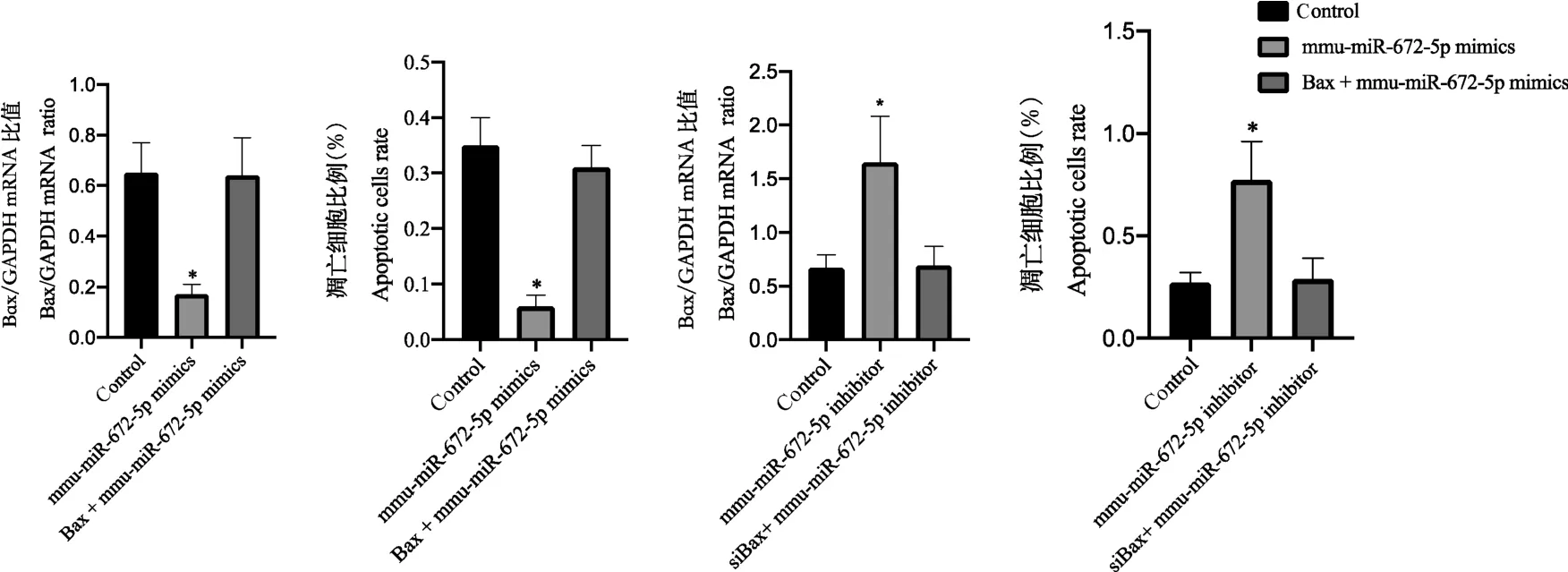
注:mmu-miR-672-5p mimics 组与control 组比较,*P<0.05;mmu-miR-672-5p inhibitor 组与control 组比较,*P<0.05。图6 同时过表达Bax 和mmu-miR-672-5p 后大鼠胎盘绒毛膜滋养层细胞的凋亡水平Note. Comparison between the mmu-miR-672-5p mimics group and the control group, *P<0.05. Comparison between mmu-miR-672-5p inhibitor group and control group, *P<0.05.Figure 6 Apoptosis level of placental trophoblast cells in rats after simultaneous overexpression of Bax and mmu-miR-672-5p
Bax 编码的蛋白质属于BCL2 蛋白质家族[17]。BCL2 家族成员形成异二聚体或同二聚体,并作为抗凋亡或促凋亡调节剂,参与多种细胞活动[18]。Bax 与BCL2 形成异二聚体,并起凋亡激活剂的作用[19]。 过表达Bax 后,CLEAVED-CAS3 的表达水平上升,大鼠胎盘绒毛膜滋养层细胞的凋亡水平上升(P<0.05)。 BAX 与BCL2 的关联和比例也决定了细胞凋亡后细胞的存活或死亡[20]。 据报道[21],Bax与线粒体电压依赖性阴离子通道(VDAC)相互作用并增加其开放性,从而导致膜电位的丧失和细胞色素c 的释放。 同时,caspase3 被切割形成CLEAVEDCAS3,随后引起细胞的凋亡。 同时过表达mmumiR-672-5p 和Bax 后,大鼠胎盘绒毛膜滋养层细胞的凋亡水平无显著变化(P>0.05);同时敲低mmumiR-672-5p 和Bax 后,发现大鼠胎盘绒毛膜滋养层细胞的凋亡水平无显著变化(P>0.05)。 因此,mmu-miR-672-5p 是Bax 引起凋亡的上游,并且Bax是miR-672-5p 下游中引起大鼠胎盘绒毛膜滋养层细胞凋亡的关键分子。
综上所述,mmu-miR-672-5p 通过靶向Bax 的3端非编码区,降低了Bax 的表达水平,随后抑制了大鼠胎盘绒毛膜滋养层细胞的凋亡。
