白细胞介素-33和皮肤鳞状细胞癌的相关性研究
2021-05-12程赛夏永华张孟杰张彩凤刘冬胡华
程赛,夏永华,张孟杰,张彩凤,刘冬,胡华
(新乡医学院第一附属医院,河南新乡453000)
皮肤鳞状细胞癌(Cutaneous squamous cell carcinoma,CSCC)是源于皮肤表皮的恶性肿瘤,好发于中老年。既往研究多认为基因突变、紫外线照射、人乳头瘤病毒感染等均是CSCC发病的重要原因[1],但近年来研究发现,炎性因子在CSCC的发病及其转移中扮演了重要作用[2-3]。CSCC发病率较高,流行病学研究结果显示,2000—2010年相对于1976—1984年,CSCC发病率增加了263%[4],致死率约为3%~4%[5]。因此,明确炎性因子在CSCC发病机制中的作用显得至关重要。白细胞介素(IL)-33属于IL-1家族中的一种炎性因子,参与了多种炎症性皮肤病如银屑病[6]、系统性红斑狼疮[7]等发病机制,Chen等[8]研究结果显示,头颈部鳞状细胞癌(SCC)癌组织中IL-33 mRNA及蛋白表达水平显著升高,且与病情进展及不良预后密切相关。目前,国内关于CSCC患者血清中IL-33表达水平的相关研究报道较少,本研究通过检测CSCC患者血清和皮损中IL-33蛋白表达水平,进一步明确CSCC和IL-33的相关性。
1 资料与方法
1.1 一般资料 纳入2018年1月—2019年8月于我院皮肤科就诊且经病理确诊的64例原发性CSCC患者作为CSCC组,其中男36例,女28例,平均年龄(57.15±13.02)岁。所有CSCC患者均排除合并结缔组织病、其他脏器肿瘤及内脏肿瘤皮肤转移等。另选取40例体检中心健康体检者作为对照组,其中男 21例,女 19例,平均年龄(56.25±11.52)岁。2组研究对象在年龄和性别上相比较,差异无统计学意义。上述所有研究对象均知情同意且签署知情同意协议书,本研究经过我院伦理委员会批准。
1.2 方法
1.2.1 CSCC患者一般资料的收集 收集CSCC患者的性别、年龄、发病部位(暴露部位如头面、颈部;非暴露部位如躯干、四肢等)、病程、肿瘤直径、有无淋巴结转移、肿瘤细胞分化程度、临床分期等详细信息。临床分期评估采用美国癌症协会非黑素瘤皮肤肿瘤淋巴结转移(TNM)分期系统[9],其中原位癌定义为0期;肿瘤直径<2 cm,无淋巴结和远处转移定义为Ⅰ期;肿瘤直径2~5 cm,无淋巴结和远处转移定义为Ⅱ期;肿瘤细胞侵犯其他组织(骨、软骨及骨骼肌等),但无淋巴结和远处转移;或无论肿瘤大小,只要存在淋巴结转移均定义为Ⅲ期;无论肿瘤大小及有无淋巴结转移,只要存在远处转移定义为Ⅳ期。
1.2.2 CSCC患者血清IL-33表达水平的检测 于入院后抽取所有研究对象外周静脉血3 mL于试管中,静置5 min后离心,取上层血清保存到新的EP管中,放入-80℃冰箱中保存待测。血清IL-33表达水平采用酶联免疫吸附试验(ELISA)法试剂盒进行检测,ELISA试剂盒购买自上海江莱生物科技有限公司(货号196508)。所有检测操作步骤严格按照说明书进行操作。
1.2.3 CSCC组织中IL-33蛋白相对表达水平的检测 取3例手术切除且经病理确诊的CSCC患者的部分皮肤鳞癌组织及其癌旁组织,另取3例本科室色素痣行手术切除的周围正常组织,生理盐水清洗后置于EP管中,放入-80℃冰箱中保存。为减少性别和年龄等因素导致CSCC组织、癌旁组织及正常组织中IL-33蛋白相对表达水平的差异,2组患者性别均为男性,平均年龄分别为(60.14±10.22)岁和(59.14±13.14)岁,性别和年龄相比差异无统计学意义。取3组皮肤组织于洁净研钵中,加入液氮并研磨成粉末,粉末移入EP管中并加入500 μL的RIPA裂解液,冰上孵育约30 min,在4℃下12 000 r/min(离心半径4 cm)离心20 min,离心后的上清液移入新的EP管进行分装,于-80℃冰箱中保存。配上层和下层胶并插入梳子,待胶凝固后加入5 μL蛋白样品和Marker进行电泳,电泳结束后取出凝胶,剪相应大小的聚偏氟乙烯(PVDF)膜,加入电转液中进行电转,牛奶封闭,加入一抗 IL-33(1∶1 000)抗体和β-actin(1∶1 000)4 ℃孵育过夜,洗膜后分别加入二抗(1∶1 000)孵育 1 h,采用化学发光法检测目的条带的灰度值,以目的蛋白与β-actin灰度值比值作为蛋白表达水平。所有实验重复3次。
1.3 统计学方法 采用SPSS 22.0统计学软件进行数据处理。计量资料符合正态分布,以均数±标准差(±s)表示,2组间比较采用独立样本t检验,计数资料采用频数或百分比表示,采用卡方检验;多组间比较采用方差分析;CSCC患者血清中IL-33表达水平的影响因素采用Logistic回归分析;采用受试者操作特征曲线(ROC)评估IL-33在诊断CSCC发生淋巴结转移中的临床效能,皮肤组织中IL-33蛋白相对表达水平采用Image J软件进行定量测定,P<0.05为差异有统计学意义。
2 结果
2.1 CSCC患者血清IL-33表达水平 CSCC组和对照组血清IL-33表达水平分别为(217.82±23.54)ng/mL 和(86.15±15.02)ng/mL,与对照组相比,CSCC组血清IL-33表达水平显著升高,差异有统计学意义(t=31.557,P<0.05)。
2.2 CSCC患者组织中IL-33蛋白相对表达水平 为进一步探讨CSCC组癌组织中IL-33蛋白相对表达水平是否升高,Western blot结果显示,CSCC组癌组织(1.12±0.13)中IL-33蛋白相对表达水平显著高于癌旁组织(0.53±0.04)和正常皮肤组织(0.13±0.01),差异有统计学意义(t1=7.538;t2=13.177,P<0.05);癌旁组织中IL-33蛋白相对表达水平显著高于正常皮肤组织,差异有统计学意义(t=16.803,P<0.05)。见图1。

图1 CSCC癌组织、CSCC组癌旁组织及正常皮肤组织中IL-33蛋白相对表达水平的比较(n=3)
2.3 CSCC患者血清IL-33表达水平与临床及病理特征的相关性 结果表明,CSCC患者病程越长、肿瘤直径越大、TNM分期越高、组织学分级越低、存在淋巴结或远处转移,血清中IL-33表达水平越高。见表1。
表1 血清IL-33表达水平与CSCC临床及病理特征的关系 (ng/mL,±s)
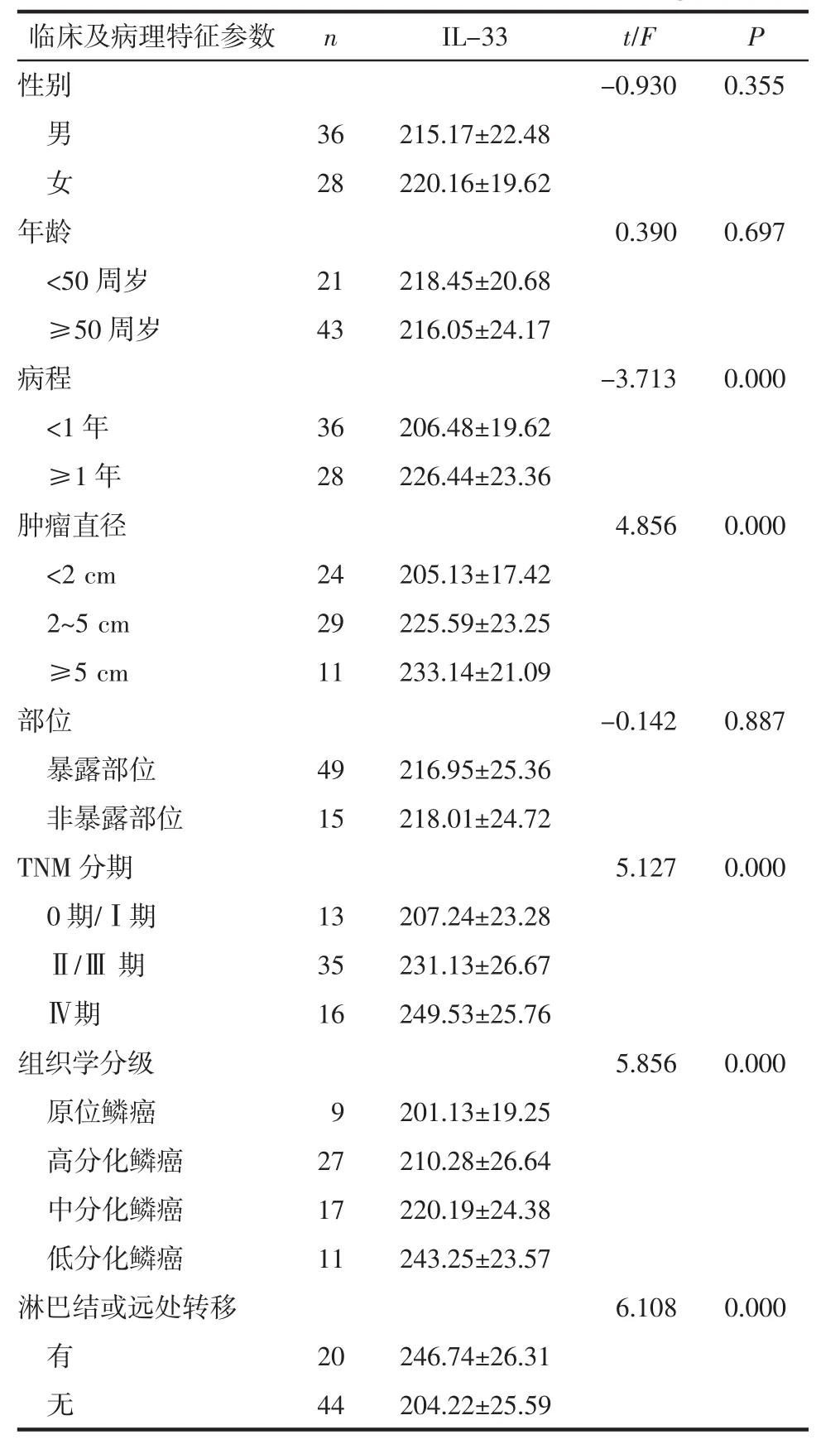
表1 血清IL-33表达水平与CSCC临床及病理特征的关系 (ng/mL,±s)
临床及病理特征参数 n I L-3 3 t/F P性别 -0.9 3 0 0.3 5 5男3 6 2 1 5.1 7±2 2.4 8女2 8 2 2 0.1 6±1 9.6 2年龄0.3 9 0 0.6 9 7<5 0周岁 2 1 2 1 8.4 5±2 0.6 8≥5 0周岁 4 3 2 1 6.0 5±2 4.1 7病程-3.7 1 3 0.0 0 0<1 年 3 6 2 0 6.4 8±1 9.6 2≥1年 2 8 2 2 6.4 4±2 3.3 6肿瘤直径 4.8 5 6 0.0 0 0<2 c m 2 4 2 0 5.1 3±1 7.4 2 2~5 c m 2 9 2 2 5.5 9±2 3.2 5≥5 c m 1 1 2 3 3.1 4±2 1.0 9部位-0.1 4 2 0.8 8 7暴露部位 4 9 2 1 6.9 5±2 5.3 6非暴露部位 1 5 2 1 8.0 1±2 4.7 2 T N M分期 5.1 2 7 0.0 0 0 0 期/Ⅰ期 1 3 2 0 7.2 4±2 3.2 8Ⅱ/Ⅲ 期 3 5 2 3 1.1 3±2 6.6 7Ⅳ期 1 6 2 4 9.5 3±2 5.7 6组织学分级 5.8 5 6 0.0 0 0原位鳞癌 9 2 0 1.1 3±1 9.2 5高分化鳞癌 2 7 2 1 0.2 8±2 6.6 4中分化鳞癌 1 7 2 2 0.1 9±2 4.3 8低分化鳞癌 1 1 2 4 3.2 5±2 3.5 7淋巴结或远处转移 6.1 0 8 0.0 0 0有2 0 2 4 6.7 4±2 6.3 1无4 4 2 0 4.2 2±2 5.5 9
2.4 CSCC患者血清IL-33表达水平的影响因素分析 Logistic回归分析结果显示,淋巴结或远处转移(OR=4.369)、组织学分级(OR=3.449)及 TNM 分期(OR=10.444)均是CSCC患者血清IL-33表达水平升高的危险因素。见表2。

表2 CSCC患者血清IL-33表达水平的多因素分析
2.5 ROC曲线评估血清IL-33水平对CSCC患者淋巴结或远处转移的诊断价值 将所有CSCC患者血清IL-33表达水平作为检验变量,将存在淋巴结或远处转移的SCC患者血清IL-33表达水平作为状态变量,绘制ROC曲线图发现,血清IL-33表达水平在诊断CSCC患者存在淋巴结或远处转移的曲线下面积(AUC)为 0.834(95%CI:0.743~0.924,P<0.05),当截断值为 237.25 ng/mL,此时敏感度和特异度分别为92.14%和86.39%。见图2。
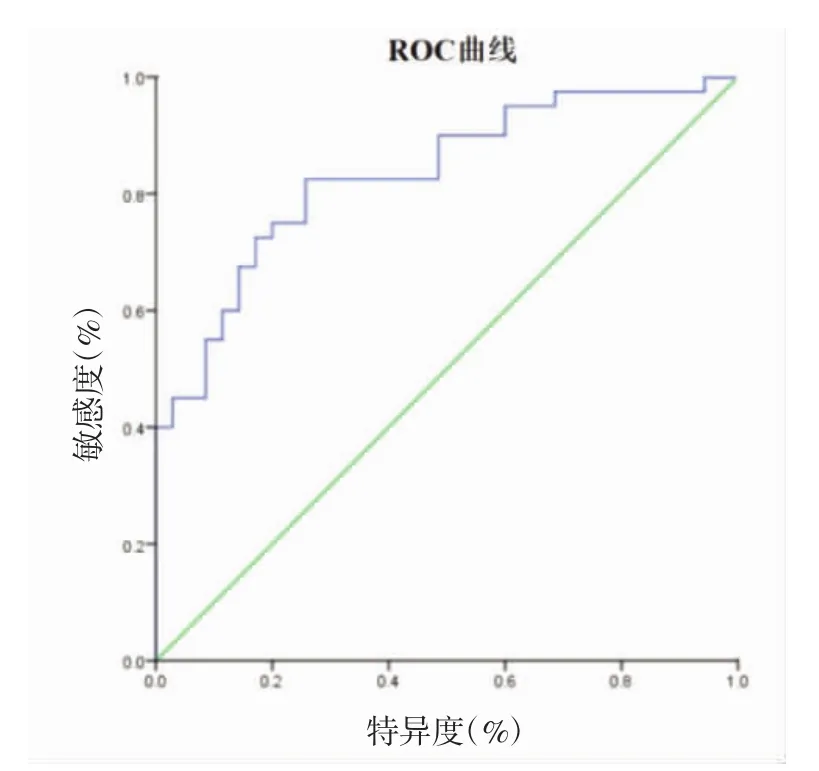
图2 血清IL-33评估CSCC患者是否存在淋巴结或远处转移的ROC曲线
3 讨论
CSCC是皮肤科较为常见的肿瘤性疾病,大量研究认为慢性炎性反应与CSCC发生发展密切相关[2-3],CSCC常常继发于皮肤慢性溃疡、日光性角化、瘢痕、盘状红斑狼疮等原有皮疹上也进一步证实炎性反应在其发病机制中的作用[10]。IL-33是IL-1家族中的一种炎性因子,主要由上皮细胞及内皮细胞等表达,当机体细胞或组织损伤或坏死时释放入血,故而IL-33也有“警报素”之称[11]。IL-33已被证实参与了如胃癌、肺癌、胰腺癌等多种肿瘤性疾病的发病机制中[12],但IL-33是否参与皮肤肿瘤的发病机制中尚不得知。考虑到上皮细胞和内皮细胞分泌IL-33,而CSCC则属于覆盖有鳞状上皮的皮肤恶性肿瘤,故而笔者猜测IL-33可能在CSCC的发病机制中扮演了重要作用。检索文献发现,国内外关于IL-33与CSCC的相关研究报道较少,Chen等[8]对40例头颈部CSCC患者的调查研究结果证实,癌组织中IL-33 mRNA、IL-33蛋白及血清中IL-33水平均显著升高,且血清IL-33表达水平相对较高的患者预后往往较差,在机制上证实IL-33促进肿瘤的局部侵袭与转移主要通过诱导细胞上皮间质转化(Epithelialto-Mesenchymal Transdifferentiation,EMT)这一重要途径;Wen等[13]发现IL-33也可通过促进癌组织中Foxp3+Tregs细胞的过度增殖而参与头颈部CSCC的发病机制,多项研究证实Foxp3+Tregs细胞与恶性肿瘤的发病机制有关[14-15];Ishikawa等[16]通过免疫组化证实舌鳞癌组织中IL-33及其受体ST2表达水平显著升高,且较高水平的IL-33和ST2水平均与发生淋巴结转移风险呈显著正相关;但国内林瀚青等[17]对20例(15例喉癌和5例下咽癌)头颈部CSCC组织中IL-33 mRNA检测后发现,IL-33 mRNA表达水平显著降低,且IL-33mRNA高表达水平的患者预后相对较差,这与其他研究结论截然相反的主要原因尚不明确。目前国内对CSCC和IL-33的相关性研究报道较少,笔者研究发现CSCC患者血清中IL-33和癌组织中IL-33蛋白相对表达水平均显著升高。这一结果提示IL-33可能参与了CSCC的发病机制。
多因素分析结果显示,组织学分级越低、发生淋巴结或远处转移、TNM分期越高,均是CSCC患者血清IL-33表达水平上调的主要危险因素。2013年,布列根和妇女医院(Brigham and Women’s Hospital,BWH)提出4项CSCC的预后不良因素,其中癌组织“组织学低分化”是其主要的预后不良的因素[18],研究证明,SCC的组织学分级越低,癌细胞更易发生淋巴结和远处转移,预后相对较差[19];另一方面,本研究采用的TNM分期是参考美国癌症协会关于非黑素瘤皮肤肿瘤TNM分期系统,该TNM分期系统综合考虑肿瘤直径、组织学分化程度及淋巴结和远处转移等多项因素,TNM分期系统对评估CSCC的临床分期有重要意义,TNM分期越高,CSCC患者预后往往较差。研究结果显示,TNM分期越高,CSCC患者血清IL-33表达水平越高,且TNM分期是CSCC患者血清IL-33表达水平升高的最为重要的危险因素,这也从侧面证实血清IL-33水平较高患者易发生淋巴结或远处转移这一结论。
早期对CSCC是否发生淋巴结或远处转移的评估至关重要,直接决定临床治疗方式及患者的预后。目前临床上主要通过计算机断层扫描(CT)、核磁共振成像(MRI)或体格检查中出现淋巴结肿大继而进行活检等确诊,在时间及经济成本均较高。因此,在临床上亟需寻找一种反应CSCC患者发生淋巴结或远处转移,且有较高敏感度和特异度的血清学标志物尤为重要。本研究通过ROC曲线探讨血清IL-33在诊断CSCC患者发生淋巴结或远处转移的临床效能,研究结果发现,血清IL-33诊断效能的ROC 曲线下面积达到 0.834(95%CI:0.743~0.924,P<0.05),敏感度和特异度分别为92.14%和86.39%,因此,血清IL-33有可能作为CSCC患者发生淋巴结或远处转移的一项血清学标志物。
综上,本研究结果发现,IL-33高表达可能参与了CSCC的发病机制,首次采用ROC曲线证实IL-33在诊断CSCC患者发生淋巴结或远处转移的临床效能较好,这为CSCC患者进行临床分期评估提供理论依据。同时,本研究的不足之处在于样本量较少,且本研究为一横断面研究,日后仍需要较大样本量的结果来验证笔者的结论,进一步开展大型队列研究探讨IL-33高表达与CSCC预后的关系。
