贝莱斯芽胞杆菌ZZBV-3的鉴定及其对草莓根腐病的防效
2021-05-11姚锦爱赖宝春余德亿
姚锦爱,黄 鹏,赖宝春,余德亿*
(1. 福建省作物有害生物监测与治理重点实验室/福建省农业科学院植物保护研究所,福州350013;2. 漳州市农业科学研究所,漳州363005)
草莓Fragaria ananassa为多年生宿根性草本植物,具有较高的食用和经济价值。近年来,我国草莓产业发展迅速,但随着栽培面积的扩大及土地多年连作,导致根腐越发严重,严重时发病率可达80%以上,给草莓生产带来巨大的经济损失[1,2]。尖孢镰刀菌 Fusarium oxysporum是引起草莓根腐病的主要病原菌之一,作为世界性土传病原真菌,其寄主范围广,还会引起黄瓜枯萎病、辣椒根腐病、棉花枯萎病等100多种植物病害发生[3]。草莓根腐病发病初期从幼根前端或中部变成褐色或黑褐色,不定根的中间部位表皮坏死,病健交界明显,被侵染的植株长势弱,叶片变黄,分蘖减少,结果减少,严重时维管束褐变、坏死,整株植株萎蔫,最后枯死[4,5]。
目前,对于草莓根腐病的防治仍以化学防治为主,然而化学药剂的长期使用,易导致农药残留及病原菌产生抗药性等问题的产生[6,7]。生物防治是目前植物病害防治的发展方向之一,其中微生物拮抗菌具有对环境友好、对人类健康安全,在防病的同时还能对作物产生促生作用等优点而备受关注[8-10]。现阶段,虽有解淀粉芽胞杆菌和枯草芽胞杆菌的一些菌株被筛选用于防控草莓根腐病的病原菌尖孢镰刀菌[11-13],但可供选择的菌株资源仍相对较少,因此仍有必要分离筛选对草莓根腐病原菌尖孢镰刀菌优质、高效的生防菌株。针对这一需求,本研究以漳州市草莓种植基地的土壤为拮抗菌分离来源,室内测定分离菌株对草莓根腐病原菌尖孢镰刀菌的抑菌活性,从中筛选出抑菌率最高的菌株,并在此基础上对所筛菌株进行分类鉴定及抑菌谱和盆栽防效测定,为该菌株的应用提供支持,也为利用微生物资源防控草莓根腐病提供参考。
1 材料与方法
1.1 供试材料
供试土壤样本采集自漳州市草莓种植基地,使用五点法采样,在草莓根系周围10~15 cm深处采集土样共20份,用营养琼脂(NA)培养基(蛋白胨10 g、牛肉膏粉3 g、氯化钠5 g、琼脂17 g、蒸馏水1 L)分离、纯化菌株。供试的草莓根腐病原菌 F. oxysporum、花生白绢病菌 Sclerotium rolfsii、草莓灰霉病菌Botrytis cinerea、兰花根腐病菌 F. oxysporum、兰花炭疽病菌 C. destructivum、柑橘青霉病菌 Penicillium italicum和玉米黑曲霉病Aspergillus niger等7株病原菌由福建省福州市农业科学院植物保护研究所提供,菌株保存和活化采用马铃薯葡萄糖琼脂(PDA)培养基(马铃薯6 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L)。供试草莓均为苗龄6个月的健康植株,采用经121 ℃、30 min高压蒸汽灭菌泥炭土为试验栽培基质,试验期间常规肥水管理。供试对照药剂为50%多菌灵可湿性粉剂(Carbendazim,江苏蓝丰生物化工有限公司)。
1.2 试验方法
1.2.1 拮抗菌株的分离 采用稀释涂布法分离土壤中的细菌[14],土样风干后称取1 g放入装有100 mL无菌水的试管中混匀,依次以10倍梯度稀释得到各浓度的土壤稀释液。分别取10-3、10-4和10-5的稀释液100 μL涂布于NA培养基平板,后倒置于(28±1)℃、RH(80±5)%、光周期12L:12D的HGZ-150型光照培养箱(上海慧泰仪器制造有限公司)内培养2 d,挑取培养基上的单菌落进行转接纯化;将纯化后的细菌菌株接种于NA斜面培养基中继续培养2 d,后置于4 ℃冰箱保存备用。
1.2.2 拮抗菌株的筛选 以草莓根腐病原菌尖孢镰刀菌为靶标菌,采用对峙法和抑菌圈法,对分离的细菌进行初筛和复筛[15,16]。初筛:用5 mm打孔器在纯化好的草莓根腐病菌边缘打孔,将菌饼接入PDA平板培养基中心,用无菌接菌环在距菌饼25 mm的四个方向分别接入从土壤分离到的细菌,置于与1.2.1相同条件的培养箱中培养5 d,从中筛选出抑菌带宽大于5 mm的菌株进行复筛。复筛:将5 mm纯化好的草莓根腐病菌菌饼接入PDA平板培养基中心,置于与1.2.1相同条件的培养箱中培养7~10 d,加入无菌水,轻轻刮下孢子,充分振荡混匀,用无菌滤纸过滤,稀释制成约含1×107孢子/mL的孢子悬浮液。取5 mL孢子悬浮液加入100 mL 45 ℃左右的PDA培养基中,摇匀,倒入培养皿中,制成含尖孢镰刀菌的平板。取初筛菌株,各自接种到装有50 mL NB液体培养基的三角瓶中,置于(28±1)℃、220 r/min的ZWY-240型旋转式摇床振荡培养2 d;收集发酵液,于(12±1)℃、10000 r/min的KDC-140HR型高速冷冻离心机中离心20 min,后取上清液用0.22 μm滤膜过滤除菌得到无菌发酵液;在含尖孢镰刀菌的PDA平板上用直径5 mm的打孔器选择合适的间距打孔, 并取50 μL滤液注入小孔内,静置30 min后,置于与1.2.1相同条件的培养箱中培养5 d,测量抑菌圈直径并记录试验结果。每处理重复3次,计算每株初筛菌株的抑菌率。
1.2.3 拮抗菌株的鉴定 将菌株接种至PDA平板培养基上,37 ℃培养24 h,观察菌落的形态、大小、边缘、透明度等特征,并结合革兰氏染色观察菌体及芽胞形态,并对照《常见细菌系统鉴定手册》[17]从形态特征初步鉴定菌株的属;结合16S rDNA和gyrB基因进行分子生物学鉴定[18,19],从基因层面最终确定所筛拮抗菌株的种。用细菌基因组DNA提取试剂盒(OMEGA)提取细菌的DNA。采用16S rDNA基因通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-TACGGCTACCTTGTTACGACTT-3′)[18]和 gyrB 基因简并引物(UP-1: 5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′和UP-2r: 5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′,其中 Y=C/T, R=A/G,N=A/G/C/T)[19],通过C1000 Thermal Cyclers 型PCR仪(Bio-Rad)对细菌基因组DNA进行扩增,其PCR反应条件:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸3 min,35个循环;最后72 ℃延伸5 min。使用DYCP-31DN型琼脂糖水平电泳仪(北京六一生物科技有限公司)检测PCR扩增产物,另用试剂盒回收目的条带,再送样生工生物工程(上海)股份有限公司进行测序;先对所测序列进行 BLAST 同源性比对,后上传登录至NCBI的GenBank数据库中,并从GenBank数据库获得相关菌株的16S rDNA和gyrB基因序列,在MEGA 5.0上用Neighbor-joining分析法构建系统发育进化树。
1.2.4 拮抗菌株的抑菌谱 以小核菌属的花生白绢病菌、葡萄孢核盘菌属的草莓灰霉病菌、镰刀菌属的兰花根腐病菌、炭疽菌属兰花炭疽病菌、青霉菌属的柑橘青霉病菌、曲霉属的玉米黑曲霉病菌等6个属的6种植物病原菌为靶标菌,按照1.2.2中初筛方法活化培养所鉴定拮抗菌和靶标菌,测定所鉴定菌株对6种植物病原菌的抑菌带宽,以抑菌带宽大于5 mm为抑菌指标[20]。
1.2.5 拮抗菌株的盆栽防效 试验使用草莓“红颜”和“甜查理”两个品种进行,试验设 3个处理:1)每株先灌根107孢子/mL尖孢镰刀菌菌液10 mL,2 d后喷施无菌水20 mL;2)每株先灌根107孢子/mL尖孢镰刀菌菌液10 mL,2 d后再喷施108cfu/mL生防菌ZZBV-3发酵液20 mL;3)每株先灌根107孢子/mL尖孢镰刀菌菌液10 mL,2 d后再喷施1000倍50%多菌灵溶液20 mL。每处理30株,重复3次。接种后第14 d统计病情指数并计算防效,病情分级标准:0级,无病斑;1级,0<病斑面积占总面积≤5%,植株长势受损;2级,5%<病斑面积占总面积≤15%,植株根茎部出现病斑;3 级,15%<病斑面积占总面积≤25%,植株根茎病部扩大,呈现黑腐状;4级,25%<病斑面积占总面积≤50%,叶片萎蔫倒伏;5级,病斑面积占总面积>50%,植株死亡。病情指数=Σ(各级病株数×各级级数)/(调查总株数×5)×100;防治效果(%)=(对照区病情指数-处理区病情指数)/对照区病情指数×100。。
1.3 数据统计与分析
利用DPS 7.05数据处理软件的DMRT检验法,分析比较拮抗菌株ZZBV-3对6种植物病原菌抑菌宽度及盆栽防效的差异显著性。
2 结果与分析
2.1 拮抗菌株的分离和筛选
通过稀释涂布法共分离到 39株菌株,将分离得到的菌株与草莓根腐病菌做生长对峙试验,初筛出抑菌带宽大于5 mm的菌株共3株用于复筛。复筛结果表明,菌株ZZBV-3抑菌活性最好,其抑菌圈直径为16.2 mm,对草莓根腐病菌的生长具有抑制作用(图1A)。
2.2 拮抗菌株的鉴定
菌株接种至NA培养基上,37 ℃培养24 h后生长良好,菌落呈淡黄色、边缘不规则、表面平滑、干燥(图1B),属革兰氏阳性菌,菌体杆状,长度1.2~1.7 µm,宽度0.5~0.6 µm,芽胞间生(图1C),对照《常见细菌系统鉴定手册》,初步将此菌株归为芽胞杆菌属。

图1 菌株ZZBV−3的抑菌圈直径(A)、菌落特征(B)和显微特征(C)Fig. 1 Inhibition diameter (A), colony morphology (B) and microscopic morphology (C) of strain ZZBV−3
对菌株ZZBV-3的DNA进行16S rDNA和gyrB扩增,经测序获得1445和1162 bp的序列片段;系统发育树结果表明,菌株ZZBV-3的16S rDNA基因序列(登录号:MW345914)与贝莱斯芽胞杆菌Bacillus velezensis模式菌株(登录号:MK641661、EF433407、KY694464)相似度分别为100%、99.83%和99.83%(图 2A),gyrB基因序列(登录号:MW350103)与贝莱斯芽胞杆菌模式菌株(登录号:MH921421和LC191187)相似度分别为99.83%和99.74%(图2B)。结合生防菌ZZBV-3菌株的形态特征,最终将ZZBV-3菌株鉴定为贝莱斯芽胞杆菌。
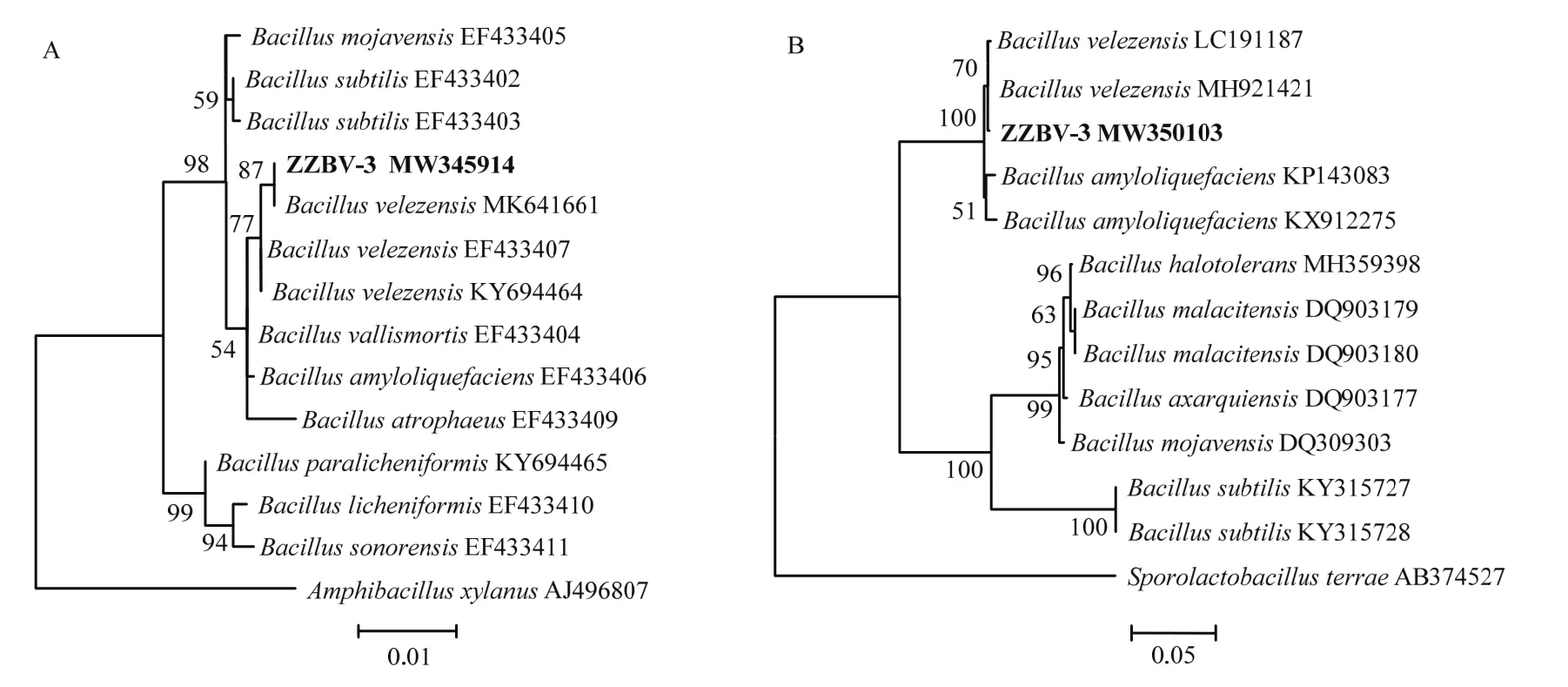
图2 基于16S rDNA(A)和gyrB(B)序列构建的系统发育树Fig. 2 Phylogenetic tree of strain ZZBV−3 constructed on the basis of 16S rDNA (A) and gyrB (B) sequences
2.3 拮抗菌株的抑菌谱
抑菌谱测定表明,菌株ZZBV-3对6个属的6种常见植物病原菌均具有不同程度的抑制作用,其中对镰刀菌属的兰花根腐病菌抑制作用最强,抑菌带宽达18.1 mm,对其他5个属的植物病原菌也有良好的抑制作用,抑菌带宽12.6~16.3 mm(表1)。可见,拮抗放线菌ZZBV-3对多种病原菌具有良好的抑菌效果。

表1 菌株ZZBV−3对6种植物病原菌的抑菌带宽Table 1 Inhibition width of strain ZZBV−3 against 6 phytopathogens
2.4 拮抗菌株的盆栽防效
盆栽试验结果表明,接种2 d后,喷施无菌水的“红颜”和“甜查理”品种均出现了叶片萎蔫、茎秆腐烂倒伏、植株死亡等病状;接种14 d后,“红颜”品种的病情指数达34.22、“甜查理”为57.11;而经过菌株ZZBV-3发酵液和1000倍50%多菌灵处理的植株,“红颜”品种病情指数仅为7.56和6.44;“甜查理”品种病情指数仅为10.67和9.33。从防治效果可以看出,菌株ZZBV-3发酵液在“红颜”和“甜查理”上防治效果达77.96%和81.18%,与施用1000倍50%多菌灵的防治效果80.98%和83.54%无显著差异(表2)。说明该菌株ZZBV-3对尖孢镰刀菌引起的草莓根腐病具有抑制作用。
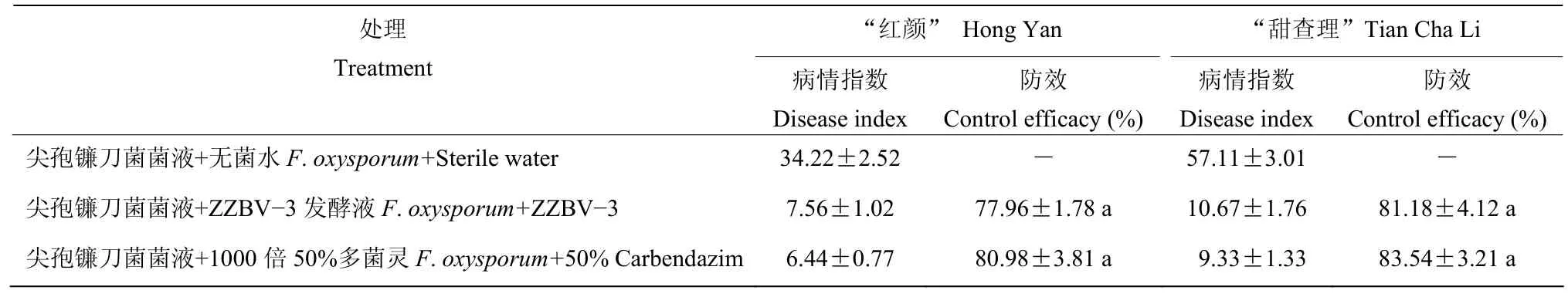
表2 菌株ZZBV−3对草莓根腐病的盆栽防效Table 2 Control efficacy of strain ZZBV−3 on strawberry root rot
3 讨论
生物防治是一种安全、有效、持久的控害方法,其中利用拮抗菌防治植物病害和促进植物生长已成为重要发展方向和研究热点之一[21-23]。菌株筛选和鉴定是拮抗菌应用的基础,是生物防治能否成功的关键所在;本研究从草莓种植基地土壤中分离筛选出一株对草莓根腐病菌尖孢镰刀菌具有显著拮抗效果的生防菌株ZZBV-3,其抑菌圈直径达16.2 mm;根据对生防菌株ZZBV-3的菌落形态观察、结合16S rDNA和gyrB序列分析和系统发育树的构建,最终将菌株ZZBV-3鉴定为贝莱斯芽胞杆菌。贝莱斯芽胞杆菌是一种新型生防细菌,王伟等[24]报道菌株X-75对番茄灰霉病菌灰葡萄孢菌Botrytis cinerea具有明显的拮抗作用,李生樟等[25]发现菌株 504 对水稻细菌性条斑病菌黄单胞菌Xanthomonas oryzae具有显著的抑制作用,Nam等[26]发现菌株nsb-1对草莓炭疽病菌胶孢炭疽菌C. gloeosporioides有良好抑菌作用。本研究中的贝莱斯芽胞杆菌ZZBV-3不仅对草莓根腐病菌具有显著的拮抗效果,对其他6个属的6种常见植物病原菌也有良好的抑制作用,抑菌谱广,研究结果为进一步研究其在田间应用中的效果提供了理论基础。
拮抗菌株仅在室内试验中表现出拮抗作用还是不够的,只有在田间应用中依旧表现出良好抑菌防效的生防菌株,才具有生防应用潜力[27]。本研究中菌株ZZBV-3对草莓“红颜”和“甜查理”品种上根腐病的盆栽防效达77.96%和81.18%,不仅与施用1000倍50%多菌灵的防治效果80.98%和83.54%相差不大,还与雷白时等[12]利用解淀粉芽胞杆菌防治草莓根腐病、李玉洋等[28]利用解淀粉芽胞杆菌SN06防治棉花枯萎病、任迁琪等[29]利用链霉菌F32防治西瓜枯萎病的盆栽防治效果相似。说明菌株ZZBV-3对草莓根腐病的发生具有抑制作用,在实际应用中具有一定的生防潜力,研究结果在丰富草莓根腐病原菌尖孢镰刀菌的生防资源的同时推动了贝莱斯芽胞杆菌等微生物资源在植物病害生防中的应用研究。
拮抗菌株有效定殖是其发挥防治植物病害功效的首要条件[27],菌株ZZBV-3如欲投入生产使用,还需探讨其在草莓植株体内和栽培基质中的定殖能力及定殖后的生防能力,也需进一步分析其代谢产物中的抑菌活性物质,明确其抑菌机制,只有这样才能更加安全、有效、长久地利用拮抗菌株防控目标作物上的致病菌。
