葡萄糖转运蛋白5低表达对骨肉瘤MG-63细胞系克隆形成能力和迁移能力的影响及其可能机制▲
2021-05-10刘树江苑萌萌吴文杰李志强
沈 朝 刘树江 苑萌萌 吴文杰 李志强
(河北省沧州市人民医院骨科,沧州市 061000,电子邮箱:yu235yong@163.com)
骨肉瘤是骨科常见的恶性肿瘤,主要发病人群为儿童和青少年[1]。由于该肿瘤早期临床症状不明显,部分患者确诊后癌细胞已转移,因此该病具有较高的转移率[1]。骨肉瘤可通过化疗和手术治疗,但许多患者治疗后仍出现复发和转移情况,导致5年生存率低于50%[2]。因此,研究骨肉瘤发生的分子机制,对临床寻找新的诊断和治疗靶点至关重要。
Wnt/β-连环蛋白信号通路在人体骨骼发育中必不可少,同时也是影响骨肉瘤发生和发展的重要信号通路[3]。研究显示,在骨肉瘤细胞等多种肿瘤细胞中,Wnt/β-连环蛋白信号通路主要参与增殖、侵袭、转移和凋亡等过程[4]。研究显示,骨肉瘤患者的Wnt/β-连环蛋白信号通路异常激活,且Wnt/β-连环蛋白信号通路与致癌基因细胞周期蛋白D1 (cyclin D1)和基质金属蛋白酶(matrix metalloproteinase,MMP)3等密切相关[5]。因此,研究该信号通路,可为治愈肿瘤疾病提供有效的治疗靶点。
骨肉瘤与其他肿瘤相似,在生长过程中均需要消耗大量能量,并将摄取葡萄糖作为摄取能量的重要途径[6]。在细胞对葡萄糖的摄取过程中,无论是主动转运还是易化扩散方式,葡萄糖转运蛋白5(glucose transporter 5,Glut5)均为主要的通道蛋白[7]。研究显示,Glut5在肺腺癌组织中高表达,沉默Glut5后肺腺癌细胞的增殖和克隆形成能力显著降低[8]。此外,还有学者发现,沉默Glut5后果糖摄取减少,并抑制了卵巢癌肿瘤的扩散[6]。但目前Glut5在骨肉瘤中的表达及作用机制仍不明确。因此,本实验通过RNA干扰技术,将短发夹RNA(short hairpin RNA,shRNA)-Glut5转染至骨肉瘤细胞系MG-63中,构建Glut5基因沉默的细胞模型,检测Glut5基因沉默对MG-63细胞克隆和迁移能力的影响,并基于Wnt/β-连环蛋白信号通路探讨其可能的作用机制。
1 材料与方法
1.1 细胞和主要实验试剂 人骨肉瘤细胞系MG-63购自美国ATCC生物标准品资源中心(货号:CRL-1427)。胎牛血清(杭州四季青生物工程材料有限公司,批号:11011-8611);MEM培养基(Gibco公司,批号:C11095500BT),Opti-MEM Ⅰ减血清培养基(Gibco公司,批号:31985-070);0.05%的胰蛋白酶(Sigma-Aldrich公司,批号:T1426);杂序的shRNA和shRNA-Glut5(上海吉凯基因化学技术有限公司);Lipofectamine 3000(Invitrogen公司,批号:L3000-008)、TRIzol试剂(Coolaber公司,批号:RE600);二喹啉甲酸试剂(Bidepharm公司,批号:BD13606);细胞计数(cell counting kit-8,CCK-8)试剂盒(Dojindo公司,批号:CK04);0.25%甲紫溶液(HLS公司,批号:ZRY-500);Transwell小室(BD公司,批号:353097);PrimeScriptTMRT试剂盒(Takara Biotechnology公司,批号:RR055B);SYBR-Green qPCR Master Mix(Generay公司,批号:GK8020);RIPA缓冲液(Biotopped公司,批号:top0737);十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)(Merck-Millipore公司,批号:CUS531);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(Solarbio公司,YZ-ISEQ00010-26.5cm*3.75);脱脂牛奶(Sigma公司,货号:T8793-5X10PAK);鼠抗兔Glut5兔多克隆抗体(Abcam公司,批号:ab36057),β-连环蛋白兔单克隆抗体(Abcam公司,批号:ab32572),cyclinD1兔单克隆抗体(Abcam公司,批号:ab40754),MMP3兔多克隆抗体(Abcam公司,批号:ab53015)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 兔多克隆抗体(Abcam公司,批号:ab181602);鼠抗兔二抗(CST公司,批号:7054);超敏ECL化学发光液(北京四正柏生物科技有限公司,4AW011-500)。
1.2 细胞培养 采用含10% 胎牛血清的MEM培养基培养MG-63细胞,并将其放入37 ℃恒温的5% CO2培养箱进行培养。每2~3 d传代一次,取对数生长期的细胞进行后续实验。
1.3 shRNA-Glut5转染MG-63细胞 将MG-63细胞接种于6孔板中,待细胞密度达40%~50%后,分为Con组、NC组和shRNA-Glut5组。Con组为未进行基因干扰的MG-63细胞,NC组、shRNA-Glut5组通过RNA干扰技术分别将杂序的shRNA、shRNA-Glut5转入MG-63细胞。具体转染方法:采用Opti-MEM Ⅰ减血清培养基稀释杂序的shRNA和shRNA-Glut5的存储溶液,常温孵育5 min;再加入Lipofectamine 3000混合后,常温孵育15 min,分别加入相应的6孔板中。待转染8 h后,换成含10% 胎牛血清的MEM培养基,培养至细胞密度达到90%,正置荧光显微镜下(上海蔡康光学仪器有限公司,型号:DFM-66C)观察转染效果,进行下一步实验。
1.4 CCK-8检测细胞增殖能力 转染48 h后收集Con组、NC组和shRNA-Glut5组的细胞,将3组细胞分别按5 000个/孔接种于96孔板。每组均设立6个复孔用于计算该组平均值。于细胞培养箱培养24 h、48 h和96 h后,分别添加CCK-8试剂,10 μL/孔,在37℃孵育2 h,通过Multiskan FC酶标仪(Thermo Fisher公司)检测450 nm波长处各孔OD值,分析各组细胞增殖情况。实验均独立重复3次。
1.5 二维克隆实验 取Con组、NC组和shRNA-Glut5组对数生长期的细胞,转染8 h后,使用0.05%胰蛋白酶消化后,使用MEM培养基中止消化,并吹打混匀制备成单细胞悬液。将每组细胞接种于6孔板内(1 000个/孔),培养10~14 d后,当孔内出现肉眼可见的克隆时,终止培养,弃去培养基,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗2~3次后,甲醇固定15 min,加入适量的0.25%甲紫溶液染色。在倒置显微镜(奥林巴斯公司,型号:CKX53)下观察大于50个细胞的克隆数,最后统计分析每个孔的克隆数,实验重复3次。
1.6 Transwell小室检测细胞迁移能力 Transwell小室表面加入100 μL稀释好的基底胶,十字摇匀后放置培养箱40 min。取Con组、NC组和shRNA-Glut5组转染48 h的细胞,用100 μL MEM培养基混合,以3×104个细胞接种至Transwell小室的上室,下室加500 μL 含10% 胎牛血清的MEM培养基;放置培养箱培养(37℃,5%CO2)12 h后,PBS洗涤2~3次,用棉签去掉上室的细胞;将小室放入4%多聚甲醛溶液中固定30 min后风干,再向孔内添加0.25%甲紫溶液,染色30 min。在倒置显微镜下随机选取5个视野 (×200),拍照记录迁移至下室的细胞总数。实验重复3次。
1.7 实时荧光定量PCR法检测相关基因mRNA表达水平 收集Con组、NC组和shRNA-Glut5组对数生长期的细胞,转染8 h后,采用TRIzol试剂分别提取各组细胞总RNA。采用NanoDrop 2000分光光度计(Thermo Fisher Scientific公司)检测RNA纯度和浓度后,采用PrimeScriptTMRT试剂盒反转录合成cDNA(反转录条件:37 ℃ 15 min,85 ℃ 5 s)。以GAPDH为内参基因,采用实时荧光定量PCR法检测相关基因mRNA表达水平,20 μL PCR反应体系包括0.4 μL cDNA,10 μL SYBR-Green qPCR Master Mix,0.4 μL相应的上下游引物,8.8 μL ddH2O,混匀。将混合好的PCR反应体系放入ABI7500实时荧光定量PCR仪中进行反应,PCR扩增条件为:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 45 s,72 ℃ 30 s,共40个循环。目的基因表达水平采用2- △△ct法计算。本实验所有PCR引物序列见表1。实验均独立重复3次。
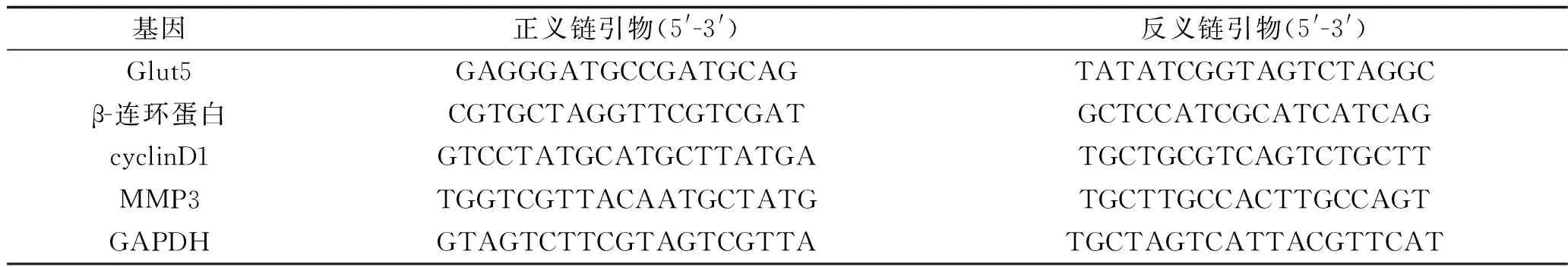
表1 实时荧光定量PCR所需的引物序列
1.8 蛋白质印迹法检测相关蛋白表达水平 收集Con组、NC组和shRNA-Glut5组对数生长期的细胞,转染8 h后,使用RIPA缓冲液提取各组细胞总蛋白。应用二喹啉甲酸试剂检测蛋白质的总浓度后,将其变性,保存于-20 ℃。采用SDS-PAGE电泳分离蛋白后,将其转移到PVDF膜。再用5%脱脂牛奶封闭1~2 h后,用TBST洗涤3次,10 min/次。然后将膜放入以1 ∶1 000稀释的Glut5、β-连环蛋白、cyclinD1和MMP3和GAPDH一抗中,4 ℃孵育10 h以上。再用TBST洗涤3次后,加入以1 ∶4 000稀释的相应二抗中,室温孵育2 h。TBST 洗涤3次,10 min/次,将超敏ECL化学发光液滴在膜上,立即放入化学发光成像仪(Invitrogen)进行化学发光。通过Image J软件分析结果,目的蛋白相对表达水平以GAPDH标准化。实验均独立重复3次。
1.9 统计学分析 应用SPPSS 19.0软件进行统计学分析。符合正态分布的计量资料以(x±s)表示,多组间比较采用方差分析,组内两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 转染效果 由于shRNA自带红色荧光蛋白mCherry,转染成功后,细胞则会发红色荧光。待shRNA-Glut5转染至MG-63细胞8 h后,在荧光倒置显微镜下可看到细胞呈现红色,提示shRNA-Glut5组细胞经转染可获得Glut5基因沉默表达的MG-63稳定细胞珠。细胞转染率85%左右,见图1。

图1 荧光倒置显微镜下观察shRNA转染情况注:A为白光视野下shRNA-Glut5组细胞;B为红色荧光背景下shRNA-Glut5组细胞。
2.2 3组MG-63细胞增殖能力的比较 各时间点,shRNA-Glut5组细胞的增殖能力均低于NC组以及Con组(均P<0.05),而Con组和NC组细胞的OD值差异无统计学意义(均P>0.05)。见表2。
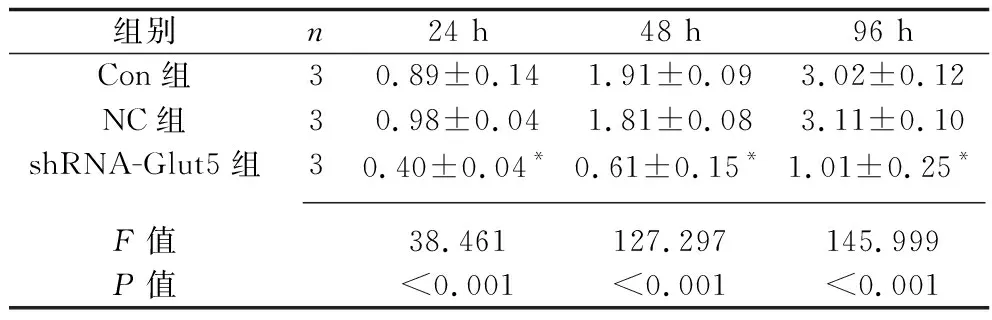
表2 3组MG-63细胞各时间点的OD值(x±s)
2.3 3组MG-63细胞克隆能力的比较 二维克隆实验结果显示,shRNA-Glut5组、Con组、NC组细胞形成的克隆数分别为(91.14±5.04)个、(483.12±12.33)个和(490.42±5.84)个,3组间差异有统计学意义(F=2220.374,P<0.001),其中shRNA-Glut5组的细胞形成克隆个数均少于其他两组(均P<0.05),而Con组和NC组细胞形成克隆个数差异无统计学意义(P>0.05)。见图2。

图2 3组MG-63细胞形成的克隆数(×200)
2.4 3组MG-63细胞迁移能力的比较 shRNA-Glut5组、NC组、Con组穿过基质胶膜的细胞数分别为(26±4)个、(83±3)个和(90±5)个,差异有统计学意义(F=221.820,P<0.001),其中shRNA-Glut5组穿过基质胶膜的细胞数少于其他两组(均P<0.05),而Con组和NC组穿过基质胶膜的细胞数差异无统计学意义(P>0.05)。见图3。
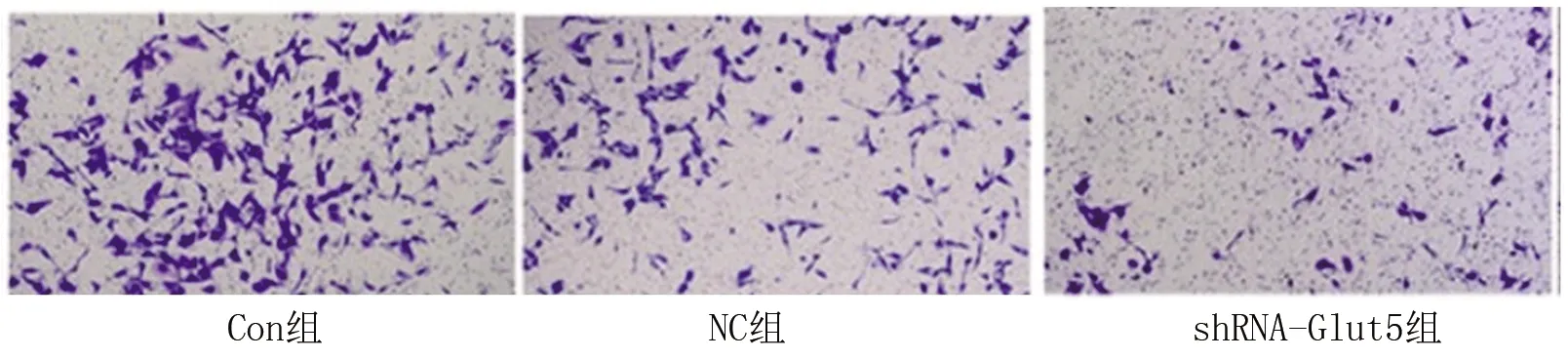
图3 3组MG-63细胞的迁移能力(×200)
2.5 3组MG-63细胞中Glut5、β-连环蛋白、cyclinD1和MMP3 mRNA表达水平的比较 shRNA-Glut5组的Glut5、 β-连环蛋白、 cyclinD1和MMP3的mRNA相对表达水平均低于其他两组(均P<0.05),而Con组和NC组相关基因mRNA表达水平比较差异无统计学意义(P>0.05)。见表3。
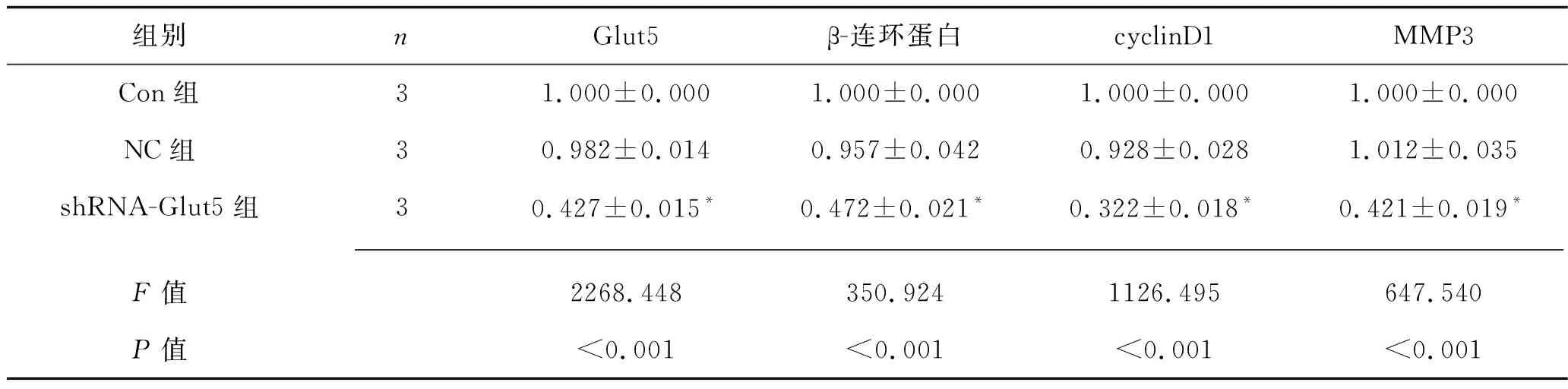
表3 3组MG-63细胞中相关因子mRNA的相对表达水平的比较(x±s)
2.6 3组MG-63细胞中Glut5、β-连环蛋白、cyclinD1和MMP3 蛋白表达水平的比较 shRNA-Glut5组的Glut5、β-连环蛋白、cyclinD1和MMP3的蛋白相对表达水平低于其他两组(P<0.05),而Con组和NC组相关蛋白表达水平比较差异无统计学意义(P>0.05)。见表4和图4。
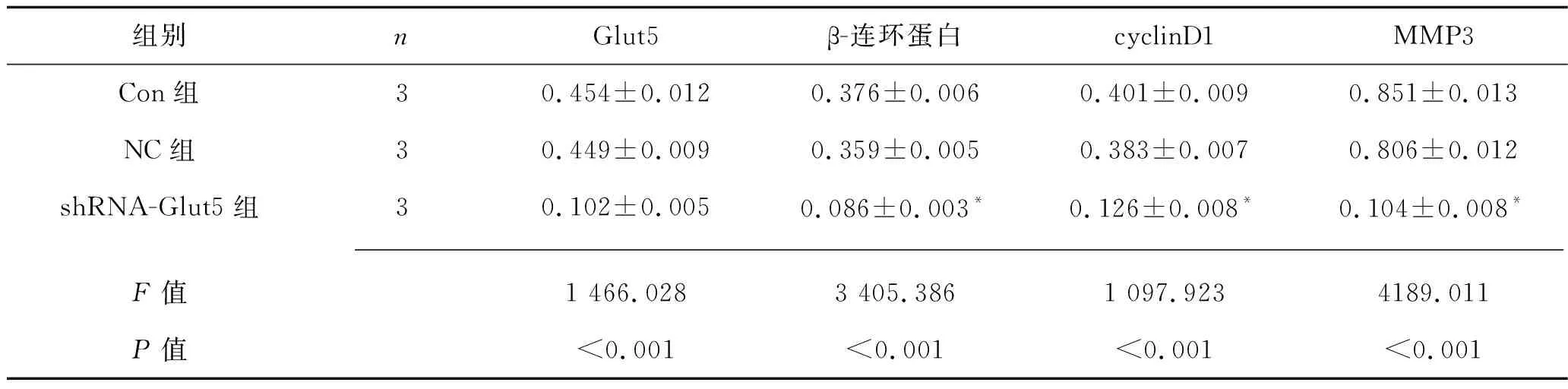
表4 3组MG-63细胞中相关因子蛋白的相对表达水平的比较(x±s)
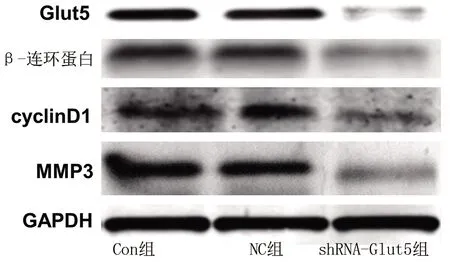
图4 3组MG-63细胞Glut5、β-连环蛋白、cyclinD1和MMP3 蛋白表达情况
3 讨 论
骨肉瘤是最常见的骨肿瘤,主要由成骨细胞系的祖细胞爆发式突变增殖而形成,多发于青少年和老年人,是导致全球儿童和青少年癌症相关死亡的第二大疾病。目前,最主要的治疗手段是外科手术和放射疗法等,但是效果仍不明显,患者生存率不超过50%[9]。因此,探究治疗骨肉瘤的新技术和途径对提高生存率、降低复发率有重要意义,而肿瘤基因疗法可作为治疗骨肉瘤方法之一。
在哺乳动物中,Glut5作为促进扩散的葡萄糖转运蛋白家族的一员,在细胞增殖分化等耗能量的过程中至关重要[10]。有研究表明,Glut5的活性改变与2型糖尿病和肥胖症有关[11],并且Glut5在卵巢癌、神经胶质瘤和肺癌等多种肿瘤组织中均呈高表达[12-14],沉默Glut5可抑制这些癌细胞在果糖培养基中的增殖、集落形成和迁移能力[15],这表明Glut5对癌细胞利用果糖是必需的。因此,Glut5可能是推动肿瘤发展的关键因子。但目前为止,未见有关Glut5在骨肉瘤细胞系MG-63中作用的研究报告。因此本研究分析Glut5对MG-63细胞克隆形成能力和迁移能力的影响。本研究结果显示,采用RNA干扰技术将Glut5基因的shRNA特异性地转入骨肉瘤MG-63细胞系后,shRNA-Glut5组细胞的增殖能力、细胞克隆数量及细胞迁移数量低于或少于NC组以及Con组(P<0.05),这表明沉默Glut5基因可抑制骨肉瘤MG-63细胞的增殖、克隆和迁移能力。
在哺乳动物发育过程中,Wnt信号通路主要参与调控细胞增殖、分化、迁移、黏附和干细胞自我更新过程,与肿瘤的发生和发展密切相关[16]。Wnt信号通路可以通过多个受体和转录因子以及其他通路,共同调控信息传导、致癌因子激活和抑癌因子突变,是导致各种癌症发生和发展的重要信号通路[17]。研究表明,Wnt信号通路中的低密度脂蛋白受体相关蛋白5是评估骨肉瘤发生和进展的候选标志物[18]。体内及体外实验研究均显示,通过抑制Wnt/β-连环蛋白信号通路的活性可以抑制骨肉瘤细胞的生长和侵袭转移[4]。Wnt/β-连环蛋白信号通路中的β-连环蛋白进入细胞核后,形成一系列的淋巴细胞增强因子,这些因子可激活致癌因子,如c-Myc、cyclinD1和MMP等[19]。本研究结果显示,下调Glut5基因后,骨肉瘤MG-63细胞中的Glut5、β-连环蛋白、cyclinD1和MMP3的mRNA和蛋白表达均受到抑制。因此我们推测,沉默Glut5的表达可通过抑制β-连环蛋白的表达,阻断Wnt/β-Catenin信号通路,从而抑制骨肉瘤 MG-63细胞系的增殖、克隆和迁移能力。
综上所述,Glut5可能是Wnt/β-连环蛋白信号通路的上游调控因子,沉默Glut5基因可抑制骨肉瘤MG-63细胞的增殖、克隆和迁移能力,这提示其可以作为骨肉瘤的治疗靶点。因此,在后续研究中,可以研究Glut5对骨肉瘤MG-63细胞系的凋亡、耐药和自噬等方面的调控作用;并且结合体外裸鼠成瘤实验,观察Glut5沉默后,对移植瘤生长状况的影响。由于国内外对Glut5研究报告较少,因此Glut5对骨肉瘤的调控作用需要进一步探讨。
