趋化因子受体CXCR4在乳腺癌骨转移患者乳腺组织中的表达水平及其临床意义▲
2021-05-10唐超莉胡洪波赵苑池谢一嫏覃文办
唐超莉 胡洪波 赵苑池 谢一嫏 周 翠 覃文办 黄 鹏
(广西崇左市人民医院肿瘤科,崇左市 530021,电子邮箱:863272700@qq.com)
乳腺癌是女性最常见的上皮性恶性肿瘤,全世界每年约有140万乳腺癌新发病例和45万乳腺癌死亡病例[1]。鉴于乳腺癌的恶性生物学行为特征,最终多会出现局部复发与远处转移。乳腺癌转移具有器官选择性,约75%的乳腺癌转移患者发生骨转移[2]。乳腺癌骨转移常引起顽固性骨痛、高钙血症、病理性骨折、肢体功能障碍等一系列骨相关事件,严重影响患者生活质量,甚至导致死亡。乳腺癌骨转移分子机制至今尚未完全明确,目前常用的治疗手段主要为姑息性治疗,包括局部治疗及系统性治疗,但均不能延长患者的生存期,而预防性治疗乳腺癌骨转移会引起不必要的副作用,并且成本高。因此,深入研究乳腺癌骨转移的分子机制,寻找有效的治疗靶点显得尤为重要。趋化因子(C-X-C基序)受体4[chemokine(C-X-C motif) receptor 4,CXCR4]介导的趋化和转移反应已在各种实体癌症中得到证实,提示CXCR4是一种趋化因子受体,常在乳腺、结肠和前列腺等器官的实体肿瘤中过度表达[3]。本研究观察乳腺癌骨转移患者乳腺组织中CXCR4基因及蛋白的表达水平,为研究乳腺癌骨转移的早期诊断和靶向治疗提供相关理论依据。现报告如下。
1 材料与方法
1.1 组织来源 收集2017 年 5月至 2019 年2 月在我院诊治的100例乳腺浸润性导管癌患者(乳腺癌无骨转移组)与100例乳腺浸润性导管癌骨转移患者(乳腺癌骨转移组)的乳腺组织,均为女性,年龄 21~75(44.65±8.76)岁。患者术前均未接受放化疗,其手术切除标本常规石蜡包埋、固定后行苏木精-伊红染色,经2位病理医生按世界卫生组织《乳腺病理组织学分类》(2003 新版)标准[4]读片,确认其浸润性导管癌的病理类型,余下组织-80℃保存。收集同期在我院体检的100健康女性的乳腺组织(正常对照组),年龄23~74(45.75±8.41)岁。3组研究对象的年龄、绝经情况等一般资料比较,以及乳腺癌无骨转移组与乳腺癌骨转移组患者乳腺癌组织学分级的比较,差异均无统计学意义(均P>0.05),具有可比性,见表1。本研究经过本院医学伦理委员会批准,所有研究对象均签署知情同意书。

表1 3组研究对象一般资料的比较(n)
1.2 免疫组化 对3组研究对象的石蜡包埋块进行相应处理:(1)选好各组研究对象组织切片,60℃恒温箱过夜。(2)脱蜡脱水:将切片依次放入二甲苯Ⅰ、Ⅱ、Ⅲ 中各10 min;再依次放入无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、85%乙醇、70%乙醇、60%乙醇中各5 min。(3)冲洗:自来水冲洗5 min,磷酸盐缓冲液冲洗3次,3 min/次。(4)抗原修复:向压力锅中倒入适量pH值=6.0的酸盐性修复液,修复液必须浸没整张组织切片,调大火加热至水沸腾,将已脱蜡水化的切片插入耐高温的染色架中,放进已煮沸的修复液中,盖紧锅盖,扣好压力锅继续加热,从喷气开始计时5 min后,将压力锅撤离热源,放置5 min后,用自来水冲洗使之冷却。(5)冲洗:取出切片,磷酸盐缓冲液冲洗3次,每次3 min;再用配制好的0.9%过氧化氢冲洗15 min;再用磷酸盐缓冲液冲洗3次,每次3 min。(6)封闭:每张切片滴加1滴动物血清,37℃温箱下孵育15 min。(7)加一抗:甩去动物血清,每张切片滴加1滴CXCR4一抗(Abbkine公司,批号:ATSFE2501), 37℃温箱下孵育60 min。(8)加二抗:磷酸盐缓冲液冲洗3次,每次3 min。每张切片各滴加1滴二抗(福建迈新公司,批号:1901180014A),37℃温箱下孵育30 min。(9)加过氧化物酶:磷酸盐缓冲液冲洗3次,每次3 min。然后每张切片加1滴链霉菌抗生物-过氧化物酶溶液,37℃温箱下孵育15 min。(10)显色:磷酸盐缓冲液冲洗3次,每次3 min。然后每张切片加二氨基联苯胺显色剂,静置1~3 min。自来水冲洗数分钟。(11)染色:放入苏木素中染色3 min后用自来水冲洗数分钟。再快速过入盐酸酒精,自来水冲洗数分钟。(12)晾干切片,滴加树脂,盖上载玻片,于显微镜下观察。计数4个不同高倍视野下的200个癌细胞,根据细胞染色情况计算阳性细胞百分数。无阳性细胞数记为阴性(-),阳性细胞百分数<25%记为弱阳性(+),阳性细胞百分数25%~49%记为中等阳性(++),阳性细胞百分数≥50%为强阳性(+++)。由两名病理学医师独立评估,当意见不一致时,由第三位病理学医师介入,最终的决定是基于三分之二的病理学医师同意评估。
1.3 PCR方法 采用逆转录PCR方法检测三组患者的CXCR4 mRNA表达情况。 分别取3组研究对象的乳腺组织约100 mg,加入1 mL的TRIzol溶液(Invitrogen公司)进行匀浆,根据RNA说明书提取总RNA。取3 μg总RNA,根据M-MuLV逆转录试剂盒(MBI Fermentas公司)说明书逆转录为cDNA;在美国MJR公司生产的定量PCR检测仪上进行实时荧光定量PCR检测。CXCR4上游引物:5′-ACTACACCGAGGAAATGGGCT-3′,下游引物:5′-CCCACAATGCCAGTTAAGAAGA -3′,预计产物长度为133 bp;β-肌动蛋白基因上游引物:5′-GGTGACGAGGCCCAGAGCAAGAG-3′,下游引物:5′-CCCGGCCAGCCAGGTCCAG-3′, 预计产物长度为388 bp,以上引物均由上海生工生物有限公司设计。反应体系为20 μL:cDNA为1 μL,CXCR4上下游引物各0.5 μL,RealMaster Mix(SYBR Green) (北京天根生物科技有限公司)为9 μL,ddH2O 9 μL。反应条件为:94℃ 5 min,然后94℃ 30 s,62.2℃ 30 s,70℃ 30 s,共40个循环。每份cDNA样本均在相同反应条件下进行。由定量PCR仪采集荧光信号,电脑自动分析荧光信号并将其转换为CT值,并根据标准曲线得出拷贝数。通过制作标准曲线对实验进行质量控制,用内参基因β-肌动蛋白对mRNA含量的变异进行较正。CXCR4精确含量=CXCR4 拷贝数/内参β-肌动蛋白拷贝数。
1.4 统计学分析 采用SPSS 22.0进行统计学分析。计量资料采用(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验;计数资料以例数和百分比表示,组间比较采用χ2检验。以P<0.05表示差异具有统计学意义。
2 结 果
2.1 3组研究对象乳腺组织CXCR4阳性表达情况的比较 3组研究对象乳腺组织CXCR4阳性表达情况的比较,差异具有统计学意义(P<0.05),乳腺癌骨转移患者乳腺组织CXCR4的阳性表达最强,见表2及图1~4。
2.2 乳腺癌阳性表达情况患者乳腺癌组织CXCR4的阳性表达情况与临床病理特征的关系 乳腺癌组织CXCR4的阳性表达情况与糖类抗原153(carbohydrate antigen 153,CA153)、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子2(human epidermal growth factor 2,HER-2)、肿瘤原发灶大小无关(均P>0.05),而与细胞核增殖相关抗原(Ki-67)、肿瘤分期相关(均P<0.05),见表3。

表2 3组研究对象乳腺组织CXCR4阳性表达情况的比较[n(%)]
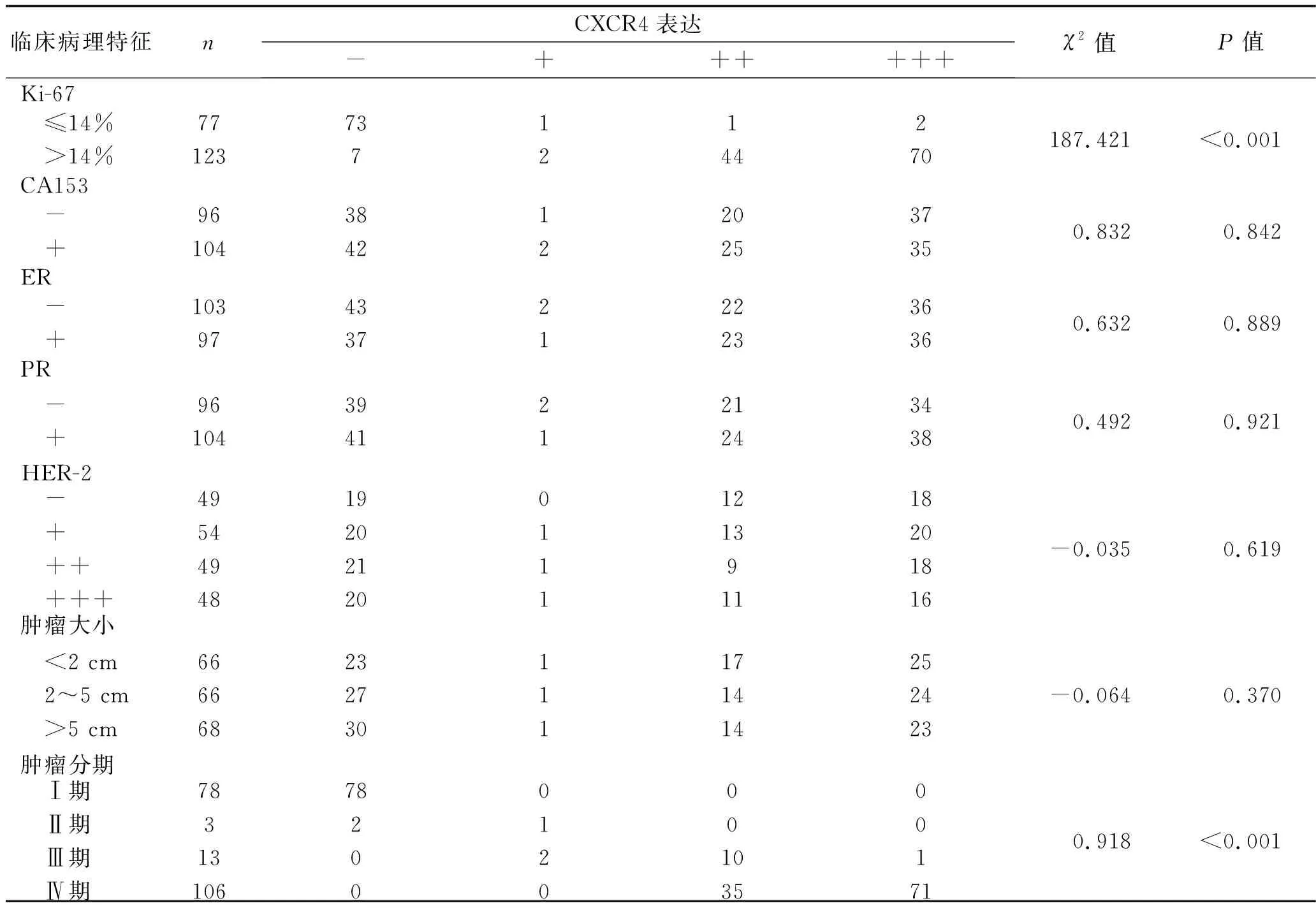
表3 乳腺癌肿瘤组织CXCR4表达情况与患者临床病理特征的关系(n)
2.3 3组研究对象乳腺组织CXCR4 mRNA相对表达量的比较 正常对照组、乳腺癌无骨转移组、乳腺癌骨转移组患者乳腺组织的CXCR4 mRNA相对表达量分别为(0.63±0.21)、(1.15±0.24)、(2.44±0.27),3组乳腺组织的CXCR4 mRNA相对表达量比较差异有统计学意义(F=1 492.153,P<0.001),其中乳腺组织的CXCR4 mRNA相对表达量由高到低为乳腺癌骨转移组>乳腺癌无骨转移组>正常对照组(均P<0.05)。
3 讨 论
乳腺癌是一种异质性疾病,可表现出多种组织病理学和分子特征。CXCR4属于特异性G蛋白-偶联受体,是趋化因子基质细胞衍生物-1的特异性受体,与配体具有较高的亲和力。趋化因子(C-X-C基序)配体12[chemokine(C-X-C motif)ligand 12,CXCL12]是CXCR4的唯一配体,在多种癌症中具有自分泌/旁分泌生长因子的作用。与CXCR4结合的CXCL12可启动各种信号通路,导致基因转录、介导细胞趋化、细胞存活和增殖的增加,而且与肿瘤细胞向区域和远处转移的能力有关[5]。CXCR4在20多种恶性肿瘤中表达上调,并且与预后不良和侵袭性表型相关。在肝癌中,CXCR4表达与肿瘤大小、远处播散和患者预后不良有关[6]。在胃癌中,长链非编码RNA HOTAIR表达增加,通过miRNA-126/CXCR4轴和下游信号通路促进胃癌的增殖和转移[7]。研究表明,CXCR4表达与肾细胞癌患者的肿瘤转移、肿瘤进展和预后有关,且CXCR4的表达与肾细胞癌患者病理分级、转移状态和总生存期显著相关[8]。CXCR4蛋白在胰腺癌组织中呈高表达,并且与肿瘤的发生发展关系密切[9]。大多数乳腺癌患者CXCR4表达呈阳性,乳腺癌组织CXCR4表达强度与腋窝淋巴结受累呈指数关系,原发肿瘤大小、HER2(+)亚型、淋巴血管浸润也与CXCR4阳性表达呈指数关系[10-11]。 Yang等[12]的研究表明,CXCR4或CXCR7基因的单次敲除可显著降低三阴型乳腺癌细胞的增殖、生长、迁移和侵袭,延缓G1/S周期的转化,而共敲除对这些生物学能力的抑制作用更显著。Shanmugam等[13]的研究表明,过表达的CXCR4与乳腺癌患者癌细胞增殖、转移增加有关,也是预后不良的指标之一。Liao等[14]的研究表明,CXCR4可促进破骨细胞形成,在非小细胞癌骨转移中起关键作用。还有研究表明,CXCR4的高表达与乳腺癌骨转移风险显著相关,CXCR4阳性患者(13.1%)骨转移发生率明显高于CXCR4阴性患者(2.4%)[15-16]。
本研究结果显示,3组研究对象乳腺组织CXCR4阳性表达情况比较,差异具有统计学意义(P<0.05),乳腺癌骨转移患者乳腺组织CXCR4的阳性表达情况最强,而且乳腺组织的CXCR4 mRNA的相对表达量由高到低为乳腺癌骨转移组>乳腺癌无骨转移组>正常对照组(均P<0.05),与Cabioglu等[15]的研究结果一致,说明CXCR4基因可能成为一个乳腺癌骨转移的基因治疗靶点,其在乳腺癌骨转移中的作用机制,可能与高表达CXCR4的肿瘤细胞迁移到富含CXCL12的骨髓环境相关。随着肿瘤转移的扩散,CXCR4/CXCL12轴影响肿瘤进展的其他方面,包括为骨髓中的肿瘤细胞提供一个保护性的生态位,并通过召集CXCR4阳性的促血管生成细胞支持缺氧驱动的血管生成[17]。本研究结果显示,乳腺癌组织CXCR4的阳性表达情况与CA153、ER、PR、HER-2、肿瘤原发灶大小无关(均P>0.05),而与Ki-67、肿瘤分期相关(均P<0.05),与Pehlivan等[10]的研究结果有所不同,这可能与研究病例数不同有关。Ki-67是细胞增殖活跃的指标,本研究结果显示Ki-67阳性>14%的乳腺癌细胞中CXCR4表达阳性率更高,而且 CXCR4在恶性程度高、组织学分化差、肿瘤分期晚的乳腺癌组织中表达更高,说明CXR4可能成为评估乳腺癌预后的指标。
综上所述, CXCR4在乳腺癌组织中的表达升高,且在乳腺癌骨转移患者乳腺组织中的表达更高,其有可能成为乳腺癌骨转移治疗的新靶点,为乳腺癌骨转移早期诊断及治疗提供新的方向。
