猪流行性腹泻病毒AH-2018-HF1株全基因组序列测定与分析
2021-05-06王震震樊玉镇殷宗俊徐前明
孙 裴,王震震,李 亮,李 杰,樊玉镇,殷宗俊,徐前明,王 勇,李 郁
(1安徽农业大学 动物科技学院,安徽 合肥 230036;2南京农业大学 动物医学院,江苏 南京 210095)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)所引起的猪的一种急性、高度传染性肠道疾病,临床症状以呕吐、水样腹泻和脱水死亡为特征,可造成5日龄及以下仔猪严重脱水,死亡率高达90%~100%[1-2]。PED自1978年在英国和比利时报道后,在匈牙利、德国、日本和韩国等多个欧亚国家相继发生[3-5]。我国于1984年首次报道了PED,但一直处于散发流行,PED并不严重[6],2010年秋季,我国南方大规模暴发PED,并迅速蔓延至全国各省区,给养猪业造成了巨大的经济损失[7]。此后,PED在美国、欧洲、韩国和日本等地也造成了极大损失[8-11]。
PEDV属于冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus),为单股正链RNA病毒,基因组全长约28 kb,包含5′非翻译区(5′-UTR)、3′非翻译区(3′-UTR)和7个开放阅读框(ORFs),从5′到3′端依次是 ORF1ab基因、S基因、ORF3基因、E基因、M基因、N基因[12]。ORF3基因编码一种离子通道蛋白,与病毒毒力相关[13-14]。S基因在不同毒株之间极易发生突变,导致S蛋白氨基酸的插入、缺失及定点突变,而且强毒与弱毒之间的差异非常明显,因此常以S基因为参考来了解不同地区 PEDV 毒株的遗传变异和流行情况[15-17]。
2018年安徽省合肥市某规模化猪场猪群免疫了传统的猪流行性腹泻二联苗,但新生仔猪仍然发生了严重的腹泻,对腹泻病料进行鉴定,证明为PED感染。为揭示该PEDV毒株的遗传进化情况,以及与国内外其他PEDV毒株之间的关系,本研究进一步提取病毒总RNA,并对全基因组序列进行了克隆测序和分析,旨在明确安徽省境内PEDV目前的流行动态,丰富国内PEDV研究资料。
1 材料与方法
1.1 材 料
1.1.1 待检样品与细胞 2018年从安徽省合肥市某规模化猪场采集PED发病仔猪的肠道组织,-80 ℃冻存备用;JM109感受态细胞、Vero细胞,均由安徽农业大学动物传染病实验室保存。
1.1.2 主要试剂 TRIzol,购自Invitrogen公司;EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix、2×Transtaq High Fidelity PCR SuperMix Ⅱ,购于北京全式金生物有限公司;DNA胶回收试剂盒、质粒小提试剂盒,购自上海生工生物工程技术服务有限公司;pMD19-T Simple载体,购自宝生物工程有限公司。
1.2 病料RNA提取及反转录
取-80 ℃保存的PED感染肠道组织,加DMEM研磨制成悬液并在高速冷冻离心机上4 ℃、 8 000 r/min离心5 min,取上清用TRIzol法提取RNA。根据EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix说明书,将提取的RNA反转录为cDNA。
1.3 PEDV全基因的克隆
参考GenBank中的 PEDV CV777 株全基因序列(登录号AF353511)及文献[18],根据分段重叠法将病毒全基因组分为9个片段,采用Oligo 6.0软件设计9对引物,引物序列见表1,由上海通用生物有限公司合成。

表1 试验所用引物序列Table 1 Sequences of primers used in this test
分段扩增PEDV各基因片段,PCR反应体系为:上下游引物各2 μL、2×TransTaqHigh Fidelity PCR SuperMixⅡ 25 μL、cDNA 2 μL,RNase-free Water补足至50 μL。PCR反应程序:95 ℃预变性2 min;95 ℃变性30 s,47~55 ℃(具体见表1)退火30 s,72 ℃ 延伸2~4.5 min(延伸速度为1 min/kb,1~9号引物延伸时间分别为4.5,4,3,4,4,4.5,4,3,2 min),30个循环;72 ℃延伸10 min。反应结束后,取5 μL PCR产物进行1%琼脂糖凝胶电泳检测,切胶回收目的片段。每个片段独立重复3次。
将目的片段与pMD19-T Simple载体进行连接,连接产物转化到JM109感受态细胞,挑取单克隆37 ℃培养12 h。用质粒小提试剂盒提取重组质粒,进行PCR鉴定,将阳性的质粒送至生物公司进行基因测序。测序结果用DNAstar软件拼接,获得PEDV毒株全基因组序列。
1.4 PEDV全基因组序列分析
将拼接的PEDV毒株全基因组序列与GenBank上公布的国内外25株PEDV毒株(表2)进行比对和分析。应用MegAlign软件Clustal W算法进行同源性分析,使用MEGA 软件Neighbor-Joining算法绘制系统进化树。

表2 PEDV参考毒株信息Table 2 Information of PEDV reference strains
2 结果与分析
2.1 PEDV基因的分段扩增
经1% 琼脂糖凝胶电泳鉴定,1~9号引物PCR扩增分别获得了4 036,3 724,2 874,3 600,3 950,4 187,3 576,2 953和1 138 bp的片段(图1),与预期结果一致。

M.D8000 DNA Marker;P1-P9.分别为1~9号引物的扩增产物,片段长度分别为4 036,3 724,2 874,3 600,3 950,4 187,3 576,2 953和1 138 bpM.D8000 DNA Marker;P1-P9.The amplification products of primers 1-9,the fragment lengths are 4 036,3 724,2 874,3 600,3 950,4 187,3 576,2 953 and 1 138 bp图1 PEDV全基因组引物扩增结果Fig.1 PEDV genome-wide primer amplification results
2.2 PEDV各基因片段的测序与拼接
使用DNAstar软件将测序后的9个片段序列进行拼接,最终获得此毒株的全基因组序列,序列全长为27 937 bp,基因结构为5′UTR-ORF1ab-S-ORF3-E-M-N-3′UTR,各基因所在位置如表3所示。将该毒株命名为AH-2018-HF1,其基因组序列已上传至GenBank 数据库(登录号:MN315264)。
2.3 PEDV AH-2018-HF1株的全基因组特征
与经典毒株CV777(疫苗株)相比,AH-2018-HF1株全基因组含有多个缺失或插入区域,其中5′UTR核苷酸有5 bp碱基缺失和1 bp碱基插入,与CV777的同源性为98.9%;ORF1ab有25 bp碱基缺失,核苷酸序列同源性为98.3%;S基因有6 bp碱基缺失,核苷酸序列同源性为96.8%;ORF3有49 bp碱基缺失,核苷酸序列同源性为97.9%;E基因有12 bp碱基缺失,核苷酸序列同源性为97.3%;M和N基因无碱基缺失和插入,核苷酸序列同源性分别为98.9%和97.4%。
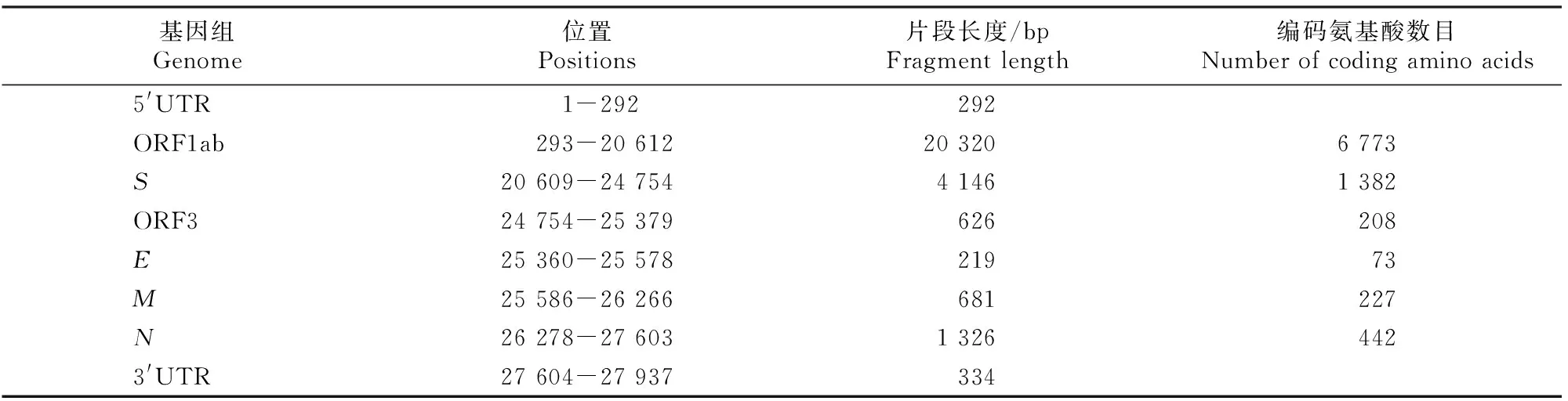
表3 PEDV AH-2018-HF1株的基因组结构Table 3 Genomic structure of PEDV strain AH-2018-HF1
2.4 PEDV AH-2018-HF1株全基因组序列同源性分析
PEDV AH-2018-HF1株与GenBank 中25个参考毒株全基因组序列同源性的分析比对结果(表4)显示,AH-2018-HF1株与2012年山东毒株SD-M核苷酸同源性最高,为99.9%,与2015年江苏毒株HLJBY的核苷酸同源性为99.8%,与疫苗毒株CV777核苷酸同源性为97.7%;与近年流行变异毒株核苷酸同源性较低,为96.0%~97.2%。

表4 PEDV AH-2018-HF1株与参考毒株全基因组序列核苷酸同源性比对Table 4 Nucleotide homology alignment of the whole genome sequence of PEDV AH-2018-HF1 strain and reference strains

表4(续) Continued table 4
2.5 PEDV AH-2018-HF1株S基因序列分析
AH-2018-HF1株S基因全长为4 146 bp,编码1 382个氨基酸。核苷酸层面,AH-2018-HF1株与参考毒株的同源性为92.7%~99.8%,与CV777、JS2008和SD-M等经典毒株的核苷酸同源性为96.2%~99.8%,其中与毒株SD-M核苷酸同源性最高,为99.8%;与AH2012、AJ1102和CH/HNAY/2015等国内变异毒株的核苷酸同源性为92.9%~93.5%;与USA/Colorado/2013、FR/001/2014和K14JB01等国外流行毒株的核苷酸同源性为92.7%~95.8%。与CV777、LZC经典毒株相比,AH-2018-HF1株S基因在459~460位缺失碱基ATA。同时,与近年中国和欧美国家变异毒株相比,AH-2018-HF1株S基因核苷酸在461-462位插入TGGAAA,在174-175位缺失CAGGGTGTCAAT。与所有参考菌株相比,在2 319-2 321位缺失GTT。与经典毒株和变异毒株相比,AH-2018-HF1株S基因碱基的缺失与插入导致编码的蛋白质在153-154位缺失异亮氨酸,在154-155位插入甘氨酸和赖氨酸,在57-58位缺失谷氨酰胺、脯氨酸、缬氨酸和天冬酰胺,在773-774位缺失缬氨酸。
2.6 PEDV AH-2018-HF1株ORF3基因序列分析
AH-2018-HF1株ORF3基因全长为626 bp,编码207个氨基酸。AH-2018-HF1株与25株参考毒株的核苷酸同源性为88.6%~100%。与AH2012、AJ1102和USA/Colorado/2013等流行变异毒株及经典毒株CV777相比,AH-2018-HF1株核苷酸在245-246位有49个碱基缺失。AH-2018-HF1株与毒株SD-M和JS2008的核苷酸同源性最高,为100%;其次为HLJBY,核苷酸同源性为99.7%,有1个碱基发生了突变(导致1个氨基酸突变)。与CV777的核苷酸同源性最低,仅为90.8%。
2.7 PEDV AH-2018-HF1株系统进化分析
PEDV毒株全基因组序列的系统进化分析结果(图2)显示,供试PEDV可分为2个群:GⅠ和GⅡ,AH-2018-HF1毒株属于GⅠ群,与毒株SD-M处于同一进化分支,亲缘关系最近,其次为HLJBY和JS2008毒株,再次为CV777和LZC毒株;GⅡ群主要囊括了近年来中国出现的PEDV变异毒株和欧美流行毒株,与AH-2018-HF1亲缘关系较远。

图2 PEDV全基因组序列系统进化分析Fig.2 Phylogenetic analysis of the whole genome sequence of PEDV
S基因是PEDV遗传进化和流行病学研究的重要基因,因此本试验对AH-2018-HF1和参考毒株的S基因进行了系统进化分析。结果(图3)显示,S基因的系统进化树与全基因组系统进化树具有相似的分组结构,同样分为GⅠ群和GⅡ群,并且AH-2018-HF1株属于GⅠ群,与SD-M和HLJBY毒株的亲缘关系最近。
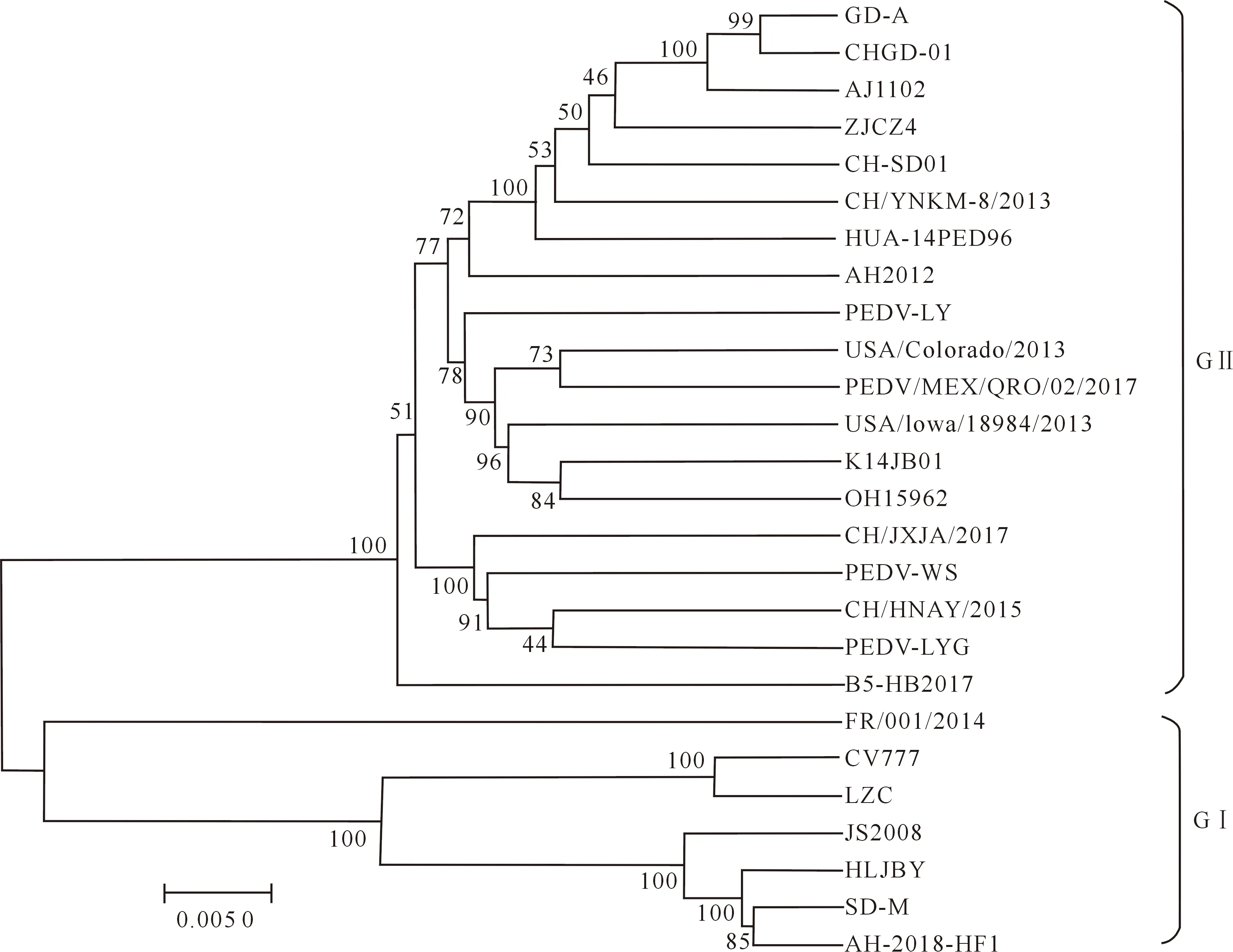
图3 PEDV S基因序列系统进化分析Fig.3 Phylogenetic analysis of PEDV S gene sequence
PEDV ORF3作为病毒唯一的辅助基因,可能与PEDV的毒力有关,因此本试验对 AH-2018-HF1 ORF3基因与其他PEDV参考毒株进行了系统进化分析。 结果(图4)显示,ORF3的系统进化树不同于全基因组和S基因的系统进化树,大部分流行变异毒株属于GⅡ群;AH-2018-HF1株与AJ1102、CH/YNKM-8/2013、CHGD-01、GD-A和ZJCZ4变异毒株则属于GⅠ群。

图4 PEDV ORF3基因序列系统进化分析Fig.4 Phylogenetic analysis of PEDV ORF3 gene sequence
3 讨 论
PED是由PEDV引起的仔猪和育肥猪的一种急性肠道传染病,已成为世界上最具危害性的猪病毒性疾病之一,对全球养猪业造成了巨大的经济损失[19]。目前生物安全和疫苗接种是防控该病的基本方法,但不能有效地根除PEDV[20-21]。
PEDV的基因组测序鉴定与分析对该病的流行病学及病毒基因结构变异监测十分重要[22]。S基因是PEDV的毒力基因,在PEDV的遗传进化过程中起重要作用[23-24]。本研究中, PED AH-2018-HF1株全基因组与CV777株同源性为97.7%,S基因序列同源性为96.8%。与CV777、LZC等经典毒株相比,AH-2018-HF1株S基因在459-461位缺失碱基ATA。同时,与近年中国和欧美国家变异毒株相比,AH-2018-HF1株核苷酸在461-462位插入TGGAAA,在174-175位缺失CAGGGTGTCAAT。与所有参考毒株相比,AH-2018-HF1在2 319-2 320位缺失GTT。这些突变可能会影响S蛋白的结构和功能,导致毒株的毒力发生变化。Park等[25]比较了野生型和减毒型PEDV,发现减毒型毒株ORF3中均有17个氨基酸缺失(82-98位),表明PEDV全长基因组基因的缺失对病毒毒力有影响。AH-2018-HF1株ORF3基因与CV777株相比,有13个碱基发生突变,导致5个氨基酸突变,在245-293位有49个碱基缺失,暗示毒株AH-2018-HF1毒力可能降低,但此毒株能否作为减毒毒株用于研制PEDV的减毒活疫苗,还需后续动物致病性试验进行进一步验证。
为深入了解PEDV AH-2018-HF1株的遗传变异情况和流行病学现状,将该毒株与其他不同地点、不同年份的毒株进行了全基因组、S基因和ORF3基因序列比较分析。全基因组序列同源性分析显示,AH-2018-HF1株与SD-M株核苷酸同源性最高(99.9%),亲缘关系最近,与HLJBY株的核苷酸同源性为99.8%,与毒株CV777核苷酸同源性为97.7%;与近年中国流行变异毒株和欧美流行流行毒株核苷酸同源性较低,亲缘关系较远。表明PEDV在我国存在流行变异情况。S基因系统进化结果与全基因组系统进化结果相似,但ORF3系统进化结果与全基因组序列系统进化结果不同,ORF3基因的系统进化树显示AH-2018-HF1株与部分流行变异株属于GⅠ群。系统发育树结果提示,AH-2018-HF1 ORF3可能是流行株与经典株之间基因重组的结果,并且发现基于PEDV不同基因构建的进化树不同,这可为PEDV重组和进化分析提供数据支持。
